hcl и hno
 Скачать 2.86 Mb. Скачать 2.86 Mb.
|
|
7 билет Метод МО. Энергетические диаграммы гомоядерных молекул. Энергетически диаграммы для частиц: O2, C2, N2 (порядок, энергия, длина связи). Необратимый гидролиз. Совместный гидролиз. Цинк, кадмий. Химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль цинка. (1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу. В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями. N2. Электроны 1s слоя участие в образовании химической связи не принимают, 8 орбиталей внешнего слоя 2х атомов азота комбинируются в 8 МО. На 2s и 2p орбиталях находится 10е. При образовании молекулы е заселяют орбитали с наиболее низкой энергией. Разрыхляющие орбитали П*2рх, П*2ру и 6*2рz остаются незаселенными, е 2s орбиталей, заполняя при комбинировании связывающую и разрыхляющую орбитали, фактически не образуют хим. Связи – это неподелынные электронные пары на атомах азота. Порядок связи в молекуле азота 3, энергия связи 940 кДж/ моль. О2. Отличительная особенность - орбитали П*2рх, П*2ру и 6*2рz находится. Во внешнем слое 12 е, 10е заполняют 62s, 6*2s, 62pz, П2px, П2py. 2е должны быть на П*2px – П*2py. Так как энергии равны, то по правилу Хунда е занимают обе орбитали, порядок связи 2. В молекуле 2 неспаренных е – она парамагнитна. Е связи 494 кДж /моль. 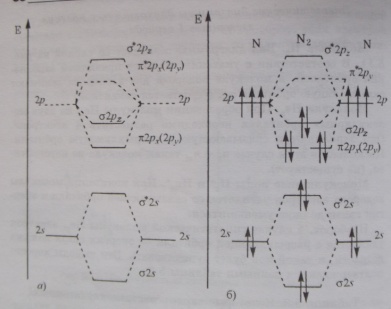 (2)Гидролиз-обменное взаимодействие между ионами соли и водой Особые случаи гидролиза. Необратимый гидролиз. Необрати мый гидролиз известен только для некоторых солей — Cr2S3, A12S3 и др. В воде эти соли полностью разлагаются: Cr,S3 + 6Н0Н -> 2Сг(0Н)3 + 3H2S. К числу особых случаев гидролиза следует отнести и совместный гидролиз. Совместный гидролиз возможен в растворе двух или более со лей. Условием для протекания этого типа гидролиза является гидро лиз одной соли по катиону, а второй — по аниону: А” + НОН НА + ОН", Ме+ + НОН МеОН + Н\ Образующиеся гидроксид-ионы и ионы водорода выводятся из сферы реакции в виде молекулы воды. Этот тип — тип необратимого гидролиза. Он характерен для со лей металлов со степенями окисления +3 и +2 (Fe3+, Ст3+. Си2*, Zn2+ и др.). Природа продуктов гидролиза определяется природой их солей. В случае солей металлов со степенями окисления +3 продук тами реакции является слабые основания и кислота: CrCl3 + 3Na2C03 + 6Н20 -> 2Сг(ОН)3 + Н2С03 + 6NaCI 2А1С13 + 3Na2S + 6 Н20 = 2А1(ОН)3 + 6NaCl + 3H2S. Если соль образована металлами со степенями окисления +2, то один из продуктов реакции — основная соль: 2CuC12 + 2Na2C03 + Н20 = (Cu0H)2C03 + СО, + 2NaCl. (3). Цинк и кадмий сгорают в токе кислорода с образованием оксидов ЭО.С серой и галогенами цинк и кадмий реагируют только при нагревании. В ряду Zn-Cd-Hg химическая активность понижается, что подтверждается и значениями стандартных электродных потенциалов (табл. 5). Цинк и кадмий не взаимодействуют с водой, так как покрыты защитной оксидной пленкой. В растворах аммиака защитная пленка растворяется: Zn + 4NH3 +2Н20 = [Zn(NH3)4](OH)2 + H2t Цинк вытесняет водород из кислот и щелочей, кадмий — только из кислот: Cd +2НС1 = CdCl2 + Н2Т Zn +2КОН + 2Н20 = K2[Zn(OH)4] + Н2Т. Цинк и кадмий восстанавливают концентрированную серную кислоту до S02, а при нагревании — до H2S: 4Zn + 5H2S04 = 4ZnS04 + H2St +4H20 Cd + 2H2S04 = CdS04 + S02T + 2H20 Цинк и кадмий ведут себя по отношению к HN03 значительно активнее. Цинк, например, способен максимально восстанавливать очень разбавленную HN03: 4Zn + 10HN03 = 4Zn(N03)2 + NH4N03 +3H20 Цинк, кадмий и ртуть легко образуют сплавы как друг с другом, так и с другими металлами.Гидроксиды цинка и кадмия получают обменной реакцией соответствующих солей со щелочами. Zn(OH)2, Cd(OH)2 — малорастворимые, бесцветные соединения. Гидроксид цинка амфотерен с преобладанием основных свойств:Zn(OH)2 + 2Н+ = Zn2+ + 2Н20 Zn(OH)2 + 20Н = [Zn(OH)4]2 С увеличением радиуса катиона от Zn к Cd усиливаются основные свойства. Cd(OH)2 проявляет кислотные свойства только при длительном кипячении с концентрированной щелочью. Оба гидроксида растворяются в аммиаке с образованием комплексов: Э(ОН)2 + 4NH3 = [3(NH3)4]2+ + 20Н Гидроксиды ртути не получены в свободном виде, так как разлагаются с отщеплением воды из-за сильного поляризующего действия катионов ртути на гидроксид- ионы: Hg(N03)2 + 2NaOH = HgO + 2Н20 + 2NaN03 Hg2(N03)2 + 2NaOH = Hg20 + H20 + 2NaN03 В присутствии растворимых карбонатов соли цинка и кадмия полностью гидролизованы с выделением осадков основных солей: 2Э2+ + 2С032 + Н20 = (Э0Н)2С03 + С02 Электрическая проводимость растворов однотипных солей цинка, кадмия и ртути в ряду Zn-Cd-Hg уменьшается. Электрическая проводимость растворов обусловлена концентрацией ионов в растворе. В воде соли цинка ионизированы практически полностью, соли кадмия образуют аутокомплексы типа Cd[CdX3]2 и Cd[CdX4], Поэтому в растворах солей кадмия концентрация ионов, а вместе с ней и электрическая проводимость, меньше, чем в растворах аналогичных солей цинка. При добавлении аммиака к растворам солей цинка и кадмия образуются аммиачные комплексы состава [3(NH3)4]2+ или [3(NH3)2Cl2]. [Zn(NH3)2Cl2] — молекулярное соединение, имеющее тетраэдрическое строение; [Cd(NH3)2Cl2] — полимер с координационным числом кадмия 6.Цинк необходим животным для нормального роста, дыхания и кровеобразования. (4) C(H+)=sqrt(Ka*Cm) C(H+)=10-5 моль/л pH=-lg[H+] =5 8билет Метод молекулярных орбиталей (ММО). Порядок заполнения молекулярных орбиталей. Условия устойчивости молекул. Кратность связей в ММО. Гидролиз солей. Степень и константа гидролиза. Факторы, влияющие на степень гидролиза солей. Общая характеристика s-элементов I группы. Характер связи в соединениях. Химическая активность. (1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу. В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями. Принципы заполнения АО: Принцип наименьшей энергии Правило Хунда(суммарное значение спинового квантового числа данного подслоя должно быть максимальным) Правило Паули(2 и более тождественные частицы не могут находиться в одном квантовом состоянии) Порядок заполнения должен быть таким, чтобы при данном числе электронов обеспечивалась минимальная энергия молекулярной системы. Первой заполняется орбиталь с наименьшей энергией. Орбитали располагаются в соответствии с порядком возрастания их энергии: 61s<61s*<62s<62s*<62pz<П2p= П2p< П*2p=< П*2p<62pz* Размещение электронов на связывающих орбиталях стабилизирует молекулу, заполнение разрыхляющих орбиталей, наоборот, разрыхляет, делает менее прочными связи в молекуле. Условия устойчивости молекул: молекула будет устойчива только тогда, когда сумма электронов на связывающих орбиталях превышают сумму электронов на разрыхляющих орбиталях Pim = (neсв-ne*)/2 Pim > 0 молекула существует (2) Гидролиз — обменное взаимодействие между ионами соли и водой. В реакцию гидролиза вступают: соли, образованные слабой кислотой и сильными основаниями (KN02, Na,P04, NaX03 и т. д.); соли, образованные слабым основанием и сильной кислотой (NH4C1, CuCl2, ZnClj FeClj и т.д.); соли, образованные и слабым основанием и слабой кислотой (NH4CN, (NH4)2S и т. д.). 1) Степень гидролиза. 2) Kг (Кр) – константа гидролиза, выводимая на основании закона действующих масс применительно ионного уравн   Природа вещества. Концентрация соли: степень гидролиза увеличивается с уменьшением концентрации соли, что связано с увеличением концентрации воды.Повышение температуры усиливает гидролиз, т.е. это процесс эндотремический. Добавление кислот и оснований:  (3)Все s-элементы I группы проявляют устойчивую степень окисления +1. Т.к. значения энергии ионизации низкие, проявляются сильные восстановительные свойства атомов. С увеличением порядкового номера усиливаются металлические свойства. В свободном состоянии s-элементы I и II группы-металлы серебристо-белого цвета. Щелочные металлы имеют рыхлую кристаллическую решетку, легкие, низкоплавкие, s-элементы химически активны. s-элементы I группы образуют с кислородом оксиды Э2О, пероксиды Э2О2, надпероксиды ЭО2(Э2О4) и озониды ЭО3. С ростом радиуса атомов при переходе от лития к цезию устойчивость пероксидов увеличивается, а оксидов – уменьшается. При взаимодействии с кислородом литий образует оксид: 4Li+O2 =2LiO2 натрий – пероксид:2Na+ O2 = Na2O2 элементы подгруппы калия – надпероксиды: K+ O2 =KO2 Озониды образуют только калий, рубидий, цезий: K+ O3 =KO3 4KOH+4O2 = KO3 + O2 +2H2O Оксиды натрия и элементов подгруппы калия получают из пероксидов: Na2O2 + 2Na=2Na2O. Биологическая роль: тело животных и человека состоит частично из этих атомов, которые осуществляют многие процессы в организме. (4) Ksp=S2 S=1.14*10-4моль/л V=m/(c*M)=2.895л 9 билет Метод ВС. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекул. Энергия Гиббса как критерий самопроизвольного протекания процесса. Кобальт, никель. Строение атома, степени окисления, химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль кобальта. (1) С помощью метода валентных связей можно определить геометрическую форму молекулы, зная, какие из гибридных орбиталей заполняются электронами. sp – линейная, sp2 – треугольная, sp3 – идеальный тетраэдр, sp2d – квадрат, согласно теории гибридизации dsp3 – тригональная бипирамида, sp3d2 – октаэдр, d2sp3 – октаэдрическая форма (2)Из-за того, что тепловой эффект реакции(ΔH) не может являться критерием самопроизвольности процесса(из-за того, что существуют самопроизвольные экзогенные процессы и эндотермические реакции), вводится изобарно-изотермический потенциал –ΔG - энергия Гиббса. Основной критерий – переходит ли система в более устойчивое состояние. Энергия Гиббса зависит от: энтальпийного фактора: стремление частиц образовывать сложные связи для понижения П(потенциальной энергии) энтропийного фактора: при повышении температуры частицы стремятся разорвать связи Таким образом, энергия Гиббса наиболее четко показывает устойчивость системы :ΔG=ΔH-TΔS ΔG<0 – процесс протекает самопроизвольно ΔG=0 – процесс равновесный ΔG>0 – процесс не протекает самопроизвольно (3) Кобальт и никель устойчивы к воздействию воды, так как защищены оксидной пленкой. Кобальт и никель взаимодействуют с серой и галогенами только при нагревании. В очень мелкораздробленном состоянии кобальт и никель обладают пирофорными свойствами, то есть воспламеняются на воздухе при обычной температуре.Кобальт и никель вытесняют водород из разбавленных кислот: Э + НС1 = ЭС12 + н2, но не реагируют с растворами щелочей. В обычных условиях концентрированные серная и азотная кислоты пассивируют эти металлы, а при нагревании окисляют до солей кобальта(П), никеля(П): Со + 2H2S04 = C0SO4 + S02 + 2Н20 конц. В ряду Fe(OH)2, Со(ОН)2, Ni(ОН)2 увеличивается устойчивость гидроксидов и уменьшаются восстановительные свойства. Гидроксид железа(П) окисляется кислородом воздуха в момент получения, Со(ОН)2 — значительно медленнее, а №(ОН)2 на воздухе устойчив и окисляется под действием более сильных окислителей: 2Ni(OH)2 + NaCIO + Н20 = 2Ni(OH)3 + NaCl В ряду Fe(OH)3, Со(ОН)з, Ni(ОН)з устойчивость гидроксидов уменьшается, окислительные свойства возрастают. Гидроксиды кобальта(Ш) и никеля(Ш) окисляют концентрированные НС1 и H2S04: 2Ni(OH)3 + 6НС1 = 2№С12 + С12 + 6Н20 4Ni(OH)3 + 4H2S04 = 4NiS04 + 02 + 10Н20 Кобальт(П) и никель(П) чрезвычайно склонны к образованию комплексных соединений с координационными числами 4 и 6: Ni(CO)4, K2[Ni(CN)4], Н2[СоС14], [Со(Н20)6]С12, [Ni(NH3)6]Cl2, и другие. Кобальт(Ш) образует прочные связи с лигандами, содержащими донорный атом азота (аммиак, этилендиамин, тиоцианат-ион и другие). Так, ион гексааминкобальт(П) легко окисляется в растворе кислородом воздуха в более устойчивый ион гексааминкобальт(Ш): 4[Co(NH3)6]C12 + 2Н20 + 02 = 4[Co(NH3)6](OH)C12 Для качественного и количественного определения никеля(П) применяется реакция с реактивом Чугаева (этанольный раствор диметилглиоксима), в результате которой образуется диметилглиоксимат никеля — осадок малинового цвета. (4) C =m/ M*V=0,033 моль/л pKa=-lgKa=4.7447 pH=(4.7447-lg0.033)/2=3.1131 |
