hcl и hno
 Скачать 2.86 Mb. Скачать 2.86 Mb.
|
|
(4) Ksp=4S3 S=2.189*10-17 моль/л n=C*V=6.567*10-17 m=n*M=1,627*10-14 5 билет Описание молекул методом МО. Энергетические диаграммы гетероядерных молекул. Примеры. Понятие о несвязывающих МО. Растворы слабых электролитов. Константы ионизации слабых кислот и оснований (рКа, рКb). Кремний, природные соединения. Силициды, силаны, силикаты. Галогениды. (1) Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу. В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью , и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома. Величина «b» антибатна ковалентности связи. Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов. Однако в отличие от гомоядерных эти молекулы хотя и изоэлектронны, но образованы атомами с неодинаковыми зарядами атомов Z. Например, в молекуле СО АО кислорода лежат ниже АО углерода (это различие отражается на величинах потенциалов ионизации атомов: I1 углерода – 11,09 эВ, I1 кислорода – 13,62 эВ). Схема МО молекул СО, BF и молекулярных ионов NO+, CN– несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул. На рис. 3.13 приведена энергетическая диаграмма МО молекулы СО. При сохранении кратности связи энергия связи СО равна 1070 кДж∙моль–1 против 842 кДж∙моль–1 в N2. Это увеличение вызвано дополнительным вкладом ионной составляющей из-за разности электроотрицательностей атомов углерода и кислорода. Адекватное экспериментальным данным строение монооксида углерода соответствует формуле C– ≡ O+. Такое необычное распределение зарядов обусловлено переходом лишней по сравнению с углеродом () электроннной пары O() на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду. 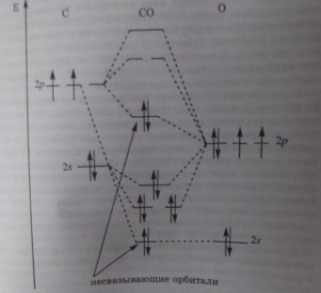 (2) Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами, а процесс распада молекул на положительно и отрицательно заряженные ионы под действием растворителя называется электролитической диссоциацией. Процесс ионизации обратим: Константа ионизации показывает отношение частиц, диссоциирующих в раствор, к количеству непродиссоциировавшего вещества. Ионизация слабого электролита — процесс равновесный:СН3СООН <± Н+ + СН3СОСГ. В отличие от солей среди кислот и оснований есть и сильные и слабые электролиты. Большинство кислот и оснований — слабые электролиты. Ka и Kb зависят от природы, температуры, но не зависят от концентрации вещества.Ионизация электролитов, основность иили кислотность которых более 1 происходит ступенчато: Диссоциация по каждой последующей ступени происходит в меньшей степени, чем по предыдущей.  (3) По содержанию в земной коре кремний занимает третье место после кислорода и водорода. В природе кремний встречается в виде диоксида кремния, силикатов и алюмосиликатов. «Аморфный» (мелкокристаллический) кремний получают из диоксида кремния, применяя в качестве восстановителя магний или уголь: Si02 + 2Mg = Si + 2MgO Si02 + 2C = Si + 2CO Кристаллический кремний высокой степени чистоты получают разложением гидрида или восстановлением хлорида кремния водородом:SiCl4 + 2Н2 = Si + 4НС1 Соединения кремния с металлами, силициды, подобно карбидам, могут быть ионными (с активными металлами) или ковалентными (с неметаллами). Ионные силициды разлагаются водой и кислотами: Mg2Si + 4НС1 = 2MgCl2 + SiH4 Mg2Si + 4H20 = 2Mg(OH)2 + SiH4 и окисляются растворами щелочей: Mg2Si + 2NaOH + 5H20 = Na2Si03 + 4H2 + 2Mg(OH)2 Ковалентные силициды, например MoSi2, инертны. Соединения кремния с водородом — кремневодороды или силаны — по составу аналогичны предельным углеводородам и имеют общую формулу Si„H2n 2, где п = 1-8. Однако они менее устойчивы и более реакционноспособны Устойчивость силанов уменьшается с увеличением числа атомов кремния в молекуле. В настоящее время выделены силаны до Si8Hi8. Силаны токсичны. Восстановительные свойства у силанов выражены сильнее, чем у углеводородов, они легко самовоспламеняются на воздухе и разрушаются щелочами: SiH4 + 202 = Si02 + 2Н20 Si2H6 + 4NaOH + 2Н20 = 2Na2Si03 + 7Н2 Галогениды кремния получают непосредственным взаимодействием кремния с галогенами, а также из диоксида кремния: Si02 + 2С + 2Г2 = Sir 4 + 2СО Тетрафторсилан можно получить также по реакции: Si02 + 4HF = SiF4 + 2Н20 Галогениды кремния — летучие ковалентные соединения, относящиеся к классу галогенангидридов; гидролизуются аналогично галогенидам бора: 3SiF4 + 4Н20 = 2H2[SiF6] + H4Si04 SiCl4 + 4H20 = 4HC1 + H4Si04 Образующийся при гидролизе тетрафторсилана гексафторидосиликат водорода (кремнефтороводородная кислота) — H2[SiF6] — является сильной двухосновной кислотой. (4) Мn+2+4H2O +5e=МnO4 +8H+ z=5 n=V*C(1/z)/z=0.01моль m=n*M=1.51г 6 билет Многоэлектронные атомы. Строение многоэлектронных атомов. (Энергетические уровни, подуровни, орбитали). Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости (Кsp). Условия растворения и образования осадков. Растворимость малорастворимых электролитов. Смещение равновесий в насыщенных растворах малорастворимых электролитов. Характеристика d-элементов II группы. Оксиды, гидроксиды, соли, комплексные соединения. (1)Многоэлектронные атомы- атомы 2 и более е.Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто. Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни).Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.закономерность заполнения электронных (принцип Паули): В атоме нет е с одинаковыми квант числами. Правило хунда(максимальный заряд на оболочке) и заполняются по принципу наим. Е. (2)В насыщенном р-ре сильного малорастворимого электролита устанавливается равновесие между осадком(тв.форма) и ионами электролита. СаСО3 = Са2+(р)+ СО32-(р). Кр (константа равновесия) =(а(Са2+(р))*а( СО32-(р))/а(СаСО3(т)). Где а(Са2+(р)) и а( СО32-(р) – активные концентрации ионов Са2+ и СО32-.т.к. а(СаСО3(т)) – постоянна, т.е. произведение Кр* а(СаСО3(т)) при данной температуре, величина постоянная. Ksр = а(Са2+(р))*а( СО32-(р)). Произведение растворимости –постоянная величина при постоянной температуре, характеризующая растворимость труднорастворимого электролита. Для труднорастворимого электролита АmBn. Ksр(АmBn) = [A]m *[B]n . [A]в степени m *[B] в степени n. Если в растворе произведение реальных концентраций ионов[A]m и [B]n (больше чем произведение растворимости при данной температуре то выпадет осадок). Чтобы растворить осадок нужно:1) уменьшить в его насыщенном р-ре концентрации соответствующих ионов, за счет вовлечения их в разные комплекс, либо путем изменения кислотности среды. 2)более полное связывание ионов. 3)за счет связывания ионов в слабый электролит. 4)за счет связывания ионов в малорастворимый комплекс. (3) Цинк и кадмий сгорают в токе кислорода с образованием оксидов ЭО.С серой и галогенами цинк и кадмий реагируют только при нагревании. В ряду Zn-Cd-Hg химическая активность понижается, что подтверждается и значениями стандартных электродных потенциалов (табл. 5). Цинк и кадмий не взаимодействуют с водой, так как покрыты защитной оксидной пленкой. В растворах аммиака защитная пленка растворяется:Zn + 4NH3 +2Н20 = [Zn(NH3)4](OH)2 + H2t Цинк вытесняет водород из кислот и щелочей, кадмий — только из кислот:Cd +2НС1 = CdCl2 + Н2Т Zn +2КОН + 2Н20 = K2[Zn(OH)4] + Н2Т. Цинк и кадмий восстанавливают концентрированную серную кислоту до S02, а при нагревании — до H2S:4Zn + 5H2S04 = 4ZnS04 + H2St +4H20 Cd + 2H2S04 = CdS04 + S02T + 2H20 Цинк и кадмий ведут себя по отношению к HN03 значительно активнее. Цинк, например, способен максимально восстанавливать очень разбавленную HN03:4Zn + 10HN03 = 4Zn(N03)2 + NH4N03 +3H20 Цинк, кадмий и ртуть легко образуют сплавы как друг с другом, так и с другими металлами.. Гидроксиды цинка и кадмия получают обменной реакцией соответствующих солей со щелочами. Zn(OH)2, Cd(OH)2 — малорастворимые, бесцветные соединения. Гидроксид цинка амфотерен с преобладанием основных свойств:Zn(OH)2 + 2Н+ = Zn2+ + 2Н20 Zn(OH)2 + 20Н = [Zn(OH)4]2 С увеличением радиуса катиона от Zn к Cd усиливаются основные свойства. Cd(OH)2 проявляет кислотные свойства только при длительном кипячении с концентрированной щелочью. Оба гидроксида растворяются в аммиаке с образованием комплексов: Э(ОН)2 + 4NH3 = [3(NH3)4]2+ + 20Н Гидроксиды ртути не получены в свободном виде, так как разлагаются с отщеплением воды из-за сильного поляризующего действия катионов ртути на гидроксид- ионы: Hg(N03)2 + 2NaOH = HgO + 2Н20 + 2NaN03 Hg2(N03)2 + 2NaOH = Hg20 + H20 + 2NaN03 Основные свойства оксидов ртути выражены слабо. Малорастворимые соли ртути (HgS, Hg2Cl2 и т. д.) гидролизу практически не подвергаются. Сулема HgCl2, являясь слабым электролитом, гидролизована в малой степени, а нитраты ртути в водных растворах сильно гидролизованы и образуют малорастворимые оксосоли, так как основные соли, подобно гидроксидам ртути, неустойчивы. Приготовление растворов нитратов ртути для предотвращения гидролиза ведут в присутствии азотной кислоты. В присутствии растворимых карбонатов соли цинка и кадмия полностью гидролизованы с выделением осадков основных солей: 2Э2+ + 2С032 + Н20 = (Э0Н)2С03 + С02 Электрическая проводимость растворов однотипных солей цинка, кадмия и ртути в ряду Zn-Cd-Hg уменьшается. Электрическая проводимость растворов обусловлена концентрацией ионов в растворе. В воде соли цинка ионизированы практически полностью, соли кадмия образуют аутокомплексы типа Cd[CdX3]2 и Cd[CdX4], Поэтому в растворах солей кадмия концентрация ионов, а вместе с ней и электрическая проводимость, меньше, чем в растворах аналогичных солей цинка. Растворы солей ртути, HgCl2 и особенно Hg(CN)2, неэлектропроводны, так как соли не являются электролитами вследствие высокой степени ковалентности связей Hg-Cl и Hg-CN. Соединения ртути(II) проявляют свойства окислителя 2HgCl2 + S02 +2Н20 = Hg2Cl2 + H2SO4 + 2НС1 Соли ртути(1) характеризуются окислительно-восстановительной двойственностью: Hg2(N03)2 + 4HN03 = 2Hg(N03)2 +2N02t +2H20 Hg2Cl2 + SnCl2 = SnCl4 + 2Hg. При добавлении аммиака к растворам солей цинка и кадмия образуются аммиачные комплексы состава [3(NH3)4]2+ или [3(NH3)2Cl2]. [Zn(NH3)2Cl2] — молекулярное соединение, имеющее тетраэдрическое строение; [Cd(NH3)2Cl2] — полимер с координационным числом кадмия 6. (4) pH=14-pOH pOH=-lgC[OH-] pOH=3.34 pH=10.66 |
