hcl и hno
 Скачать 2.86 Mb. Скачать 2.86 Mb.
|
|
11 билет Эндо- и экзотермические реакции. термохимические уравнения. закон Гесса – основной закон термохимии. Следствия из закона Гесса. Понятие о коллигативных свойствах растворов. Степень ионизации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов. Характеристика платиновых металлов. Строение атомов, химические свойства. Оксиды, гидроксиды, соли. (1) Закон Гесса —Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Cледствия: Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции Тепловой эффект химической реакции равен разности сумм теплот образованияпродуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. например: 2H2 + O2 → 2 H2O Эндотерми́ческие реа́кциихимические реакции, сопровождающиеся поглощением теплоты. К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия), электролитической диссоциации (например, растворение солей в воде), ионизации, фотосинтеза. (2)Коллигативные свойства растворов — это свойства, которые при данных условиях оказываются равными и независимыми от хим. природы растворённого в-ва; свойства р-ров, которые зависят лишь от количества кинетических единиц и от их теплового движения. Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества: Tкип =i*E*Cm. Tзам = i*К*Сm Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов. 1)Относительное понижение давления насыщенного пара растворителя над раствором прямопропорционально мольной доле растворенного вещества. N=(P0 – P)/P0. P0 – давление насыщ. пара над P – давление насыщенного пара над раствором. N – мольная доля растворенного вещества. N = n2/(n2+n1), n – кол-во вещества 2)Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от при роды растворённого вещества и прямо пропорционально моляльной концентрации раствора. Tзам = К*Сm 3)Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора . Tкип = E*Cm. 4)Осмотическое давление – давление которое нужно приложить к системе чтобы осмос прекратился. π = CMв-ва*R*T . CMв-ва - молярная концентрация р-ра, R - универсальная газовая постоянная, T – температура (3) Наибольшее сходство в химических свойствах платиновых металлов наблюдается в диадах. Сплавлением порошкообразных Ru и Os со щелочами в присутствии окислителей можно получить осматы и рутенаты: Э+ КС103 + 2КОН = К3Э04 + КС1 + Н20 При нагревании эти металлы довольно легко образуют оксиды Ru02 и OsO4. Оксид осмия(УШ) может быть получен и при окислении осмия дымящей азотной кислотой: Os + 8HN03 = OSO4 + 8N02 + 4Н20 Медленное окисление порошкообразного осмия до OsO4 происходит на воздухе даже при комнатной температуре, что придает металлу характерный запах (отсюда название элемента — «пахучий»). Родиевая чернь (мелкодисперсный металл) растворяется при нагревании в «царской водке» и соляной кислоте, насыщенной кислородом или хлором: 4Rh + 24НС1 +302 = 4H3[RhCl6] + 6Н20 Аналогичное поведение характерно для иридия.Палладий относительно легко растворим в «царской водке», а также в горячих концентрированных азотной и серной кислотах: 3Pd + 8HNO3 = 3Pd(N03)2 + 2NO + 4Н20 Платину можно перевести в растворимое состояние действием «царской водки» или соляной кислоты, насыщенной хлором, при этом образуется гексахлоридоплатинат(1У) водорода (хлороплатиновая кислота): 3Pt + 4HN03 + 18НС1 = 3H2[PtCl6] + 4NO + 8Н20. С кислородом палладий и платина не взаимодействуют. (4) Ksp=S2 S=1.26*10-5моль/л S=1.26*10-5моль/л*253=318*10-5г/л 12билет Гетерогенное равновесие в растворах электролитов. Условия выпадения и растворения осадков. Общая характеристика s-элементов II группы: оксиды, гидроксиды, соли. Свинец. Свойства оксидов, гидроксидов, солей. Свинцовый сурик. (1) В насыщенном р-ре сильного малорастворимого электролита устанавливается равновесие между осадком(тв.форма) и ионами электролита. СаСО3 = Са2+(р)+ СО32-(р). Кр (константа равновесия) =(а(Са2+(р))*а( СО32-(р))/а(СаСО3(т)). Где а(Са2+(р)) и а( СО32-(р) – активные концентрации ионов Са2+ и СО32-.т.к. а(СаСО3(т)) – постоянна, т.е. произведение Кр* а(СаСО3(т)) при данной температуре, величина постоянная. Ksр = а(Са2+(р))*а( СО32-(р)). Произведение растворимости –постоянная величина при постоянной температуре, характеризующая растворимость труднорастворимого электролита. Для труднорастворимого электролита АmBn. Ksр(АmBn) = [A]m *[B]n . [A]в степени m *[B] в степени n. Если в растворе произведение реальных концентраций ионов[A]m и [B]n (больше чем произведение растворимости при данной температуре то выпадет осадок). Чтобы растворить осадок нужно:1) уменьшить в его насыщенном р-ре концентрации соответствующих ионов, за счет вовлечения их в разные комплекс, либо путем изменения кислотности среды. 2)более полное связывание ионов. 3)за счет связывания ионов в слабый электролит. 4)за счет связывания ионов в малорастворимый комплекс. (2)Все s-элементы II группы +2.Не имеют отрицательных степеней окисления,так как значения энергии ионизации низкие, поэтому проявляются сильные восстановительные свойства атомов. С увеличением порядкового номера усиливаются металлические свойства. В свободном состоянии s-элементы I и II групп – металлы серебристо-белого цвета. Ca, Sr, Ba называют - щелочно-земельные металлы. Для s-элементов в их соединениях наиболее характерен ионный тип химической связи. s-элементы II группы при взаимодействии с кислородом образуют оксиды : 2Э+ O2 =2ЭO s-элементы II группы взаимодействуют с водой: Э+2Н2О=Э(ОН)2+Н2 Магний взаимодействует с водой только при нагревании. Бериллий почти не реагирует. s-элементы II группы энергично реагируют с кислотами: 4Ba+10HNO3разб=4Ba(NO3)2+NH4NO3+3H2O Ba2++4HNO3=4Ba(NO3)2+2NO2+2H2O Со щелочами только бериллий: Be+2NaOH+2H2O=Na2[Be(OH)4]+H2 (3)ПолучениеРЬО + С = РЬ + со Свинец взаимодействует с кислотами исключительно как металл, образуя соли свинца(П). В разбавленных соляной и серной кислотах свинец практически не растворяется вследствие солевой пассивации — металл покрывается пленками малорастворимых в воде РЬС12 и PbS04. С концентрированными соляной и серной кислотами свинец взаимодействует с образованием растворимых соединений: Pb + 4НС1 = Н2[РЬС14] + Н2. Свинец не реагирует с концентрированной азотной кислотой (и(Н1М03) > 65 %) из-за малой растворимости в ней нитрата свинца. С более разбавленной азотной кислотой (HN03) = 20-30 %) свинец взаимодействует: ЗРЬ + 8HN03 = 3Pb(N03)2 + 2NO + 4Н20 При окислении кислородом свинец образует — РЬО. Остальные оксиды получают косвенно: Pb(CH3COO)2 + СаОС12 + Н20 = РЬ02 + СаС12 + 2СН3СООН Малорастворимые гидроксиды Э(ОН)2 получают из солей: Pb(N03)2 + 2NaOH = Pb(OH)2 + 2NaN03 Гидроксид свинца(П) проявляют амфотерные свойства с усилением основных. Гидроксид свинца(4) — свинцовая кислота — неустойчив и существует только в виде РЬ02. Однако хорошо известны соли орто- и метасвинцовой кислоты. Например, Са2РЬ04 — ортоплюмбат и СаРЬОз — метаплюмбат кальция. Оксиды свинца РЬ20з и РЬз04 (свинцовый сурик) можно рассматривать, как метаплюмбат свинца(П) — РЬРЬОз и ортоплюмбат свинца(П) — РЬ2РЬ04. Наличие в этих соединениях свинца в различных степенях окисления можно доказать реакциями с азотной и концентрированной соляной кислотами: Pb203+ 2HN03 = Pb(N03)2 + РЬ02 + Н20 Pb304 + 4HN03 = 2Pb(N03)2 + Pb02 + 2Н20 Pb203 + 6НС1 = 2РЬС12 + С12 + ЗН20 Pb304 + 8НС1 = ЗРЬС12 + С12 + 4Н20 Содержание свинца(4) в исходных соединениях можно определить по количеству выпавшего в осадок РЬ02 или выделившегося хлора. (4) pH=-lgС[H+] С[H+]=10-3моль/л C[H+]=sqrt(Ka*Cm) Cm=0.476*10-2моль/л 13 билет Метод МО. Энергетические диаграммы гетероядерных молекул. Энергетические диаграммы для частиц: NO, NO+ (порядок, энергия, длина связи). Гидролиз. Основные типы гидролиза. Реакция среды в растворах кислых солей. Углерод. Соединения с металлами, серой, галогенами, азотом. Цианиды, цианаты, тиоцианаты. (1) Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу. В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью , и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома. Величина «b» антибатна ковалентности связи. Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов. Однако в отличие от гомоядерных эти молекулы хотя и изоэлектронны, но образованы атомами с неодинаковыми зарядами атомов Z. Схема МО молекул СО, BF и молекулярных ионов NO+, CN– несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул. Молекула NO имеет один электрон на разрыхляющей орбитали. Вследствие этого энергия связи NO (680 кДж/моль) меньше, чем у N2 или CO. Удаление электрона у молекулы NO (ионизация с образованием NO+) увеличивает энергию связи атомов до 1050–1080 кДж/моль. Молекула NO содержит нечётное число электронов, следовательно, она парамагнитна, кратность связи равна 2,5. ион NO+, называемый нитрозилом или нитрозонием. Переход от молекулы NO (потенциал ионизации 9,27 эВ) к иону NO + сопровождается упрочением и укорочением связи N—О; энергия диссоциации связи увеличивается от 627 до 1047 кДж/моль, длина связи сокращается от 0,11507 до 0,1063 нм. энергия связи в NO равна 623 кДж/моль, а в NO+ она составляет 1050 кДж/моль. длина связи N—O составляет 0,123 нм 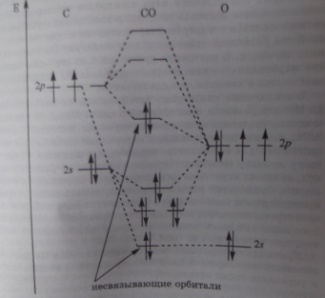 (2) Гидролиз – обменные взаимодействия ионов и молекул с водой. Два основных механизма: Гидролиз по катиону. Катионы связываются с гидратирующей их молекулой воды донорно-акцепторной связью, где донор - О, входящий в состав OH- и имеющий по две свободные эл. пары, а акцептор – катионы со свободными квантовыми ячейками. Гидролиз по аниону. Анионы связываются с молекулами воды водородной связью. Сильное воздействие аниона может привести к отрыву протона, и водородная связь становится ковалентной.  Соли, образованные катионами сильных оснований и анионами сильных кислот гидролизу не подвергаются ввиду малого поляризующего действия частиц на молекулы воды, небольших зарядов и радиусов. Соли, образованные сильным основанием и слабой кислотой гидролизуются по аниону. Среда раствора щелочная. NaCN+H20->HCN+NaOH Если анион многозаряден, гидролиз протекает ступенчато. Na2CO3+H20->NaHCO3+NaOH NaHCO3+H2O->NaOH+H2CO3 Соли, образованные слабым основанием и сильной кислотой гидролизуются по катиону. Среда раствора кислая. NH4Cl+H2O->NH4OH+HCl Если катион многозаряден, гидролиз ступенчатый. CuCl+H2O->(CuOH)Cl+HCl Соль образована слабым основанием и слабой кислотой. pH среды определяется по силе образовавшихся основания и кислоты. Растворы таких солей слабокислые или слабощелочные. а) Катион и анион однозарядны. CH3COONH4+H2O->CH3COOH+NH4OH б) Катион однозаряден, анион многозарядный + наоборот. Гидролиз протекает ступенчато, но каждая следующая стадия выражена в меньшей степени, чем предыдущая. I. (NH4)2CO3+H2O->NH4OH+NH4HCO3 II. NH4CO3+H2O->NH4OH+H2CO3 K1>K2 в) Многозарядные катион и анион – необратимый гидролиз (соли, не существующие в растворе – соли Fe, Cr в СО +3 и др). Fe2S3+6H20->2Fe(OH)3+3H2S Совместный гидролиз – это гидролиз, протекающий при одновременном присутствии в растворе солей с противоположным характером гидролиза: одна – по катиону, др. – по аниону. 2CuCl2+2Na2CO3+H20->2NaCl+(CuOH)2CO3+CO2 Механизм совместного гидролиза: Cu(2+)+HOH->CuOH(+)+H(+) CO3(2-)+HOH->HCO3(-)+OH(-) --------равновесие Другой пример совместного гидролиза: 2FeCl3+3Na2S+6H2O->2Fe(OH)3+3H2S+6NaCl (3)Содержание углерода в земной коре сравнительно невелико, однако его природные соединения весьма распространены. Свободный углерод встречается в природе в виде алмаза и графита. В минералах углерод находится, главным образом, в виде карбонатов. Наиболее важные из них: кальцит — СаСОз (мрамор, известняк, мел), доломит— СаСОз, магнезит— MgCCh, витерит— ВаСОз. Природные воды содержат в растворенном состоянии гидрокарбонаты кальция и магния Са(НСОз)г, Mg(HCCh)2, которые придают ей временную жесткость. Кроме того, углерод образует основу органического мира. Как продукт разложения органических соединений прежних геологических эпох, углерод встречается в виде каменных углей, горючих сланцев, торфа, нефти. Углерод образует ряд оксидов: СО, С02, С20з и другие. Монооксид углерода (СО) образуется при неполном сгорании угля и органических веществ, а также при разложении муравьиной кислоты: НСООН Нг5°4 > со + Н20 . Этот оксид является кислотным и со щелочами (при температуре 120 °С и давлении 500 кПа) образует соли муравьиной кислоты — формиаты: СО + NaOH = HCOONa . СО — сильный восстановитель и легко вступает в реакции присоединения с образованием карбонилов неметаллов: СО + С12 = сось СО + S = COS и металлов: 5СО + Fe = Fe(CO)5 Диоксид углерода (углекислый газ) — СО2 — продукт полного сгорания угля и органических соединений. С водой образует слабую и неустойчивую угольную кислоту Н2СО3. СО2 в больших количествах используют для получения мочевины (карбамида), которую применяют в качестве удобрений, корма для скота, в органическом синтезе, производстве полимеров. Ален-1,3-дион (недокись углерда)— 0=С=С=С=0— бесцветный газ с удушливым запахом, при нагревании разлагается: С3О2 = со2 + С . Из галогенпроизводных углерода наибольшее значение имеют тетрахлорметан (четыреххлористый углерод) — ССЦ, который в больших количествах получают хлорированием дисульфида углерода в присутствии SbCb в качестве катализатора: CS2 + ЗС12 = ССЦ + S2CI2. Тетрахлорметан — тяжелая негорючая жидкость, т. кип. 76 °С, в химическом отношении инертна. Используется в качестве растворителя, с водой практически не смешивается и при обычных условиях с ней не реагирует. При высокой температуре в присутствии раскаленного железа в качестве катализатора ССЦ гидролизуется как галогенангидрид: ССЦ + 2Н20 = С02 + 4НС1 Хлороформ (СНСЦ) — тяжелая жидкость, применяется как растворитель. Йодоформ (CHI3) — желтые кристаллы со специфическим запахом. Смешанные галогенпроизводные углерода— фреоны, например, фреон-12 (CCI2F2), негорючие и нетоксичные, малореакционноспособные вещества, применяются как хладоагенты в холодильных установках. Дисульфид углерода (сероуглерод) образуется при пропускании пара серы над раскаленным углем: С + 2S = CS2 Это бесцветная жидкость, т. кип. 46,2 °С. При комнатной температуре медленно, а при 150 °С — быстро, разлагается водой: CS2 + 2Н20 = С02 + 2H2S, применяется в качестве растворителя. CS2 — ковалентный сульфид, при взаимодействии с ионными сульфидами образует тритио карбонаты: CS2 + K2S = K2CS3 При действии на тритиокарбонаты минеральных кислот выделяется двухосновная тиоугольная кислота H2CS3; K2CS3 + 2НС1 = H2CS3 + 2КС1, медленно разлагающаяся при стоянии: H2CS3 = H2S + cs2 С азотом углерод непосредственно не взаимодействует. Бинарное соединение углерода с азотом — (CN)2 — оксалонитрил, получают термическим разложением цианидов металлов: Hg(CN)2 = Hg + (CN)2 2Cu(CN)2 = 2Cu(CN) + (CN)2 Молекула дициана имеет линейную структуру N=C-C=N. Оксалонитрил — газ, по свойствам близок к галогенам, поэтому его называют псевдогалогеном. В реакциях дициан может выступать как окислитель: (CN)2 + Н2 = 2HCN, и как восстановитель: (CN)2 + С12 = 2C1CN В растворах щелочей, как и галогены, диспропорционирует: (CN)2 + 2КОН = KCN + KOCN + Н20 Цианид водорода (циановодород) — HCN — летучая бесцветная жидкость, т. кип. +26 °С. Молекулы HCN — линейные, полярные, ассоциированы за счет водородных связей HCN HCN HCN. В водных растворах HCN— слабая кислота. Эти растворы называют также циановодородной или синильной кислотой. Соли — цианиды. HCN и цианиды очень токсичны. Цианид водорода и цианиды металлов легко окисляются с образованием циановой (HOCN) и тиоциановой (HSCN) кислот или их солей — цианатов и тиоцианатов (роданидов): 2HCN + 02 = 2HOCN KCN + Н202 = KOCN + Н20 KCN + S = KSCN KCN + K2S2 = KSCN + K2S Эти реакции применяются для дезинтоксикации HCN и цианидов. Циановая кислота — HOCN— в свободном состоянии неустойчива, в водном растворе существует в виде двух таутомерных форм: циановой и изоциановой кислот. При обычных условиях преобладает изоформа. Изомером циановой кислоты является фульминовая (гремучая) кислота — H-0-N=C. Кислота и ее соли (фульминаты) неустойчивы и легко разлагаются со взрывом: Hg(ONC)2 = Hg + 2СО + N2 Тиоциановая (родановодородная) кислота— сильная кислота. Она нетоксичная, в водном растворе существует, как и циановая, в двух таутомерных формах: H-N=C=S H-S-C=N (4) α=sqrt(Ka/Cm) Ka=1.2*10-4 pH=-lgC[H+]=-lg (sqrt(Ka*Cm))=2.22 14билет Метод молекулярных орбиталей (ММО). Энергетические диаграммы гетероядерных молекул. Примеры. Понятие о несвязывающих МО Общие свойства металлов. Положение в периодической системе. Активность металлов. ряд стандартных электродных потенциалов металлов. Литий и щелочные металлы. Получение, хранение. Гидриды, оксиды, пероксиды, надпероксиды. соли. Биологическая роль натрия и калия. (1) ) Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу. В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью , и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома. Величина «b» антибатна ковалентности связи. Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов. Однако в отличие от гомоядерных эти молекулы хотя и изоэлектронны, но образованы атомами с неодинаковыми зарядами атомов Z. Например, в молекуле СО АО кислорода лежат ниже АО углерода Схема МО молекул СО, несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул. При сохранении кратности связи энергия связи СО равна 1070 кДж∙моль–1 против 842 кДж∙моль–1 в N2. Это увеличение вызвано дополнительным вкладом ионной составляющей из-за разности электроотрицательностей атомов углерода и кислорода. Адекватное экспериментальным данным строение монооксида углерода соответствует формуле C– ≡ O+. Такое необычное распределение зарядов обусловлено переходом лишней по сравнению с углеродом () электроннной пары O() на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду. (2) Металлическиме свойства - высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. К металлам относится 96 элементов из всех открытых.На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны). С кислородом реагируют все металлы, кроме золота, платины. С серой реагируют все металлы, кроме золота и платины Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют. При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей. (3) Все s-элементы I группы проявляют устойчивую степень окисления +1.Т.к. значения энергии ионизации низкие, проявляются сильные восстановительные свойства атомов. С увеличением порядкового номера усиливаются металлические свойства. В свободном состоянии s-элементы I и II группы-металлы серебристо-белого цвета. Щелочные металлы имеют рыхлую кристаллическую решетку, легкие, низкоплавкие, s-элементы химически активны. s-элементы I группы образуют с кислородом оксиды Э2О, пероксиды Э2О2, надпероксиды ЭО2(Э2О4) и озониды ЭО3. С ростом радиуса атомов при переходе от лития к цезию устойчивость пероксидов увеличивается, а оксидов – уменьшается. При взаимодействии с кислородом литий образует оксид: 4Li+O2 =2LiO2 натрий – пероксид:2Na+ O2 = Na2O2 элементы подгруппы калия – надпероксиды: K+ O2 =KO2 Озониды образуют только калий, рубидий, цезий: K+ O3 =KO3 4KOH+4O2 = KO3 + O2 +2H2O Оксиды натрия и элементов подгруппы калия получают из пероксидов: Na2O2 + 2Na=2Na2O. Биологическая роль: тело животных и человека состоит частично из этих атомов, которые осуществляют многие процессы в организме. (4) C[H+]=sqrt(Ka*Cm) =1.14*10-4 моль/л С[H+]=C[HS-]=1.14*10-4 моль/л 15билет Ковалентная связь. Метод валентных связей (МВС). Механизмы образования ковалентной связи. Кратные связи. Дативные связи. Равновесие между раствором и осадком малорастворимого сильного электролита. Константа растворимости (Ksp). Условия растворения и образования осадков. Бор. оксид бора, кислоты бора, бориды, бораны. Галогениды бора. Биологическая роль бора. (1) Метод валентных связей Впервые метод валентных связей был применен немецкими учеными в 1927 г. Гейтлером В. и Лондоном Ф. для рассмотрения образования молекулы Н2. Они рассмотрели систему из двух атомов водорода находящихся на большом расстоянии друг от друга. При этом электрон взаимодействовал только со своим ядром. При сближении атомов происходило притяжение ядер с электронами и отталкивание электронов и атомов. В результате взаимодействия ядер и электронов получается зависимость потенциальной энергии Е системы от расстояния r между ядрами этих атомов. При этом оказалось, что результаты зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадении спинов электронов кривая 2 сближения атомов приводит к непрерывному возрастанию энергии системы. Для сближения атомов требуется затрата энергии, такой процесс энергетически невыгоден и химическая связь между атомами не возникает. При противоположно направленных спинах (кривая 1) сближение атомов до расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т.е. находится в устойчивом состоянии; дальнейшее сближение атомов приводит к возрастанию энергии. Т.е. в случае противоположно направленных спинов электронов образуется молекула Н2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга (рис. 2) При образовании химической связи происходит перекрывание электронных облаков взаимодействующих атомов. Вследствие образования области с высокой плотностью электрического заряда в межъядерном пространстве происходит стягивание ядер атомов и образуется устойчивая молекула. Позднее метод ВС был распространен и на другие молекулы. Основные положения метода валентных связей 1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам. 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. 3. Характеристики химической связи определяются типом перекрывания АО. 4. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. Свойства ковалентной связи 1. Насыщаемость- способность атомов образовывать ограниченное число ковалентных связей. 2. Направленность ковалентной связи определяет пространственную структуру молекул. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах. 3. Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например, Н - Н, О = О, Cl - Cl, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома и в этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность (ЭО). Чем выше ЭО у атома, тем вероятнее смещение электронной пары в сторону ядра этого атома. Механизмы образования ковалентных связей. Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно акцепторный,дативный. При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими. По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. (2) В насыщенном р-ре сильного малорастворимого электролита устанавливается равновесие между осадком(тв.форма) и ионами электролита. СаСО3 = Са2+(р)+ СО32-(р). Кр (константа равновесия) =(а(Са2+(р))*а( СО32-(р))/а(СаСО3(т)). Где а(Са2+(р)) и а( СО32-(р) – активные концентрации ионов Са2+ и СО32-.т.к. а(СаСО3(т)) – постоянна, т.е. произведение Кр* а(СаСО3(т)) при данной температуре, величина постоянная. Ksр = а(Са2+(р))*а( СО32-(р)). Произведение растворимости –постоянная величина при постоянной температуре, характеризующая растворимость труднорастворимого электролита. Для труднорастворимого электролита АmBn. Ksр(АmBn) = [A]m *[B]n . [A]в степени m *[B] в степени n. Если в растворе произведение реальных концентраций ионов[A]m и [B]n (больше чем произведение растворимости при данной температуре то выпадет осадок). Чтобы растворить осадок нужно:1) уменьшить в его насыщенном р-ре концентрации соответствующих ионов, за счет вовлечения их в разные комплекс, либо путем изменения кислотности среды. 2)более полное связывание ионов. 3)за счет связывания ионов в слабый электролит. 4)за счет связывания ионов в малорастворимый комплекс. (3) В природе бор встречается в виде борной кислоты H3BO3 и солей. Так же бор содержится в морской воде и продуктах извержения вулканов. Для бора характерно sp2(BF3) и sp3(H[BF4]). Реакционная способность зависит от степени измельчения. В обычных условиях бор реагирует только с F2, при высоких температурах почти со всеми элементами. При 700С бор сгорает красноватым пламенем с образованием оксида. 4B+3O2= 2B2O3 Бор может вытеснять ряд элементов из их оксидов. 4B+3Co2= 2B2O3+3C. Концентрированная азотная кислота при нагревании медленно растворяет бор. B+3HNO3=H3BO3+3NO2 К раствору щелочей бор устойчив. При взаимодействии бора с Ме при нагревании образуются бориды, MB, MB2 и другие. Большинство боридов химически инертно. С углеродом образует карбид B4C, который один из самых твердых в-в. Бораны получают косвенно. 6MgB2+12HCl=6MgCl2+B4H10+H2+8B, в свободном состоянии выявлены B(n)H(n+4). и B(n)H(n+6). Они имеют очень токсичны, вызывают головную боль. Бораны- жидкие, кроме B2H6, очень нестойкие и реакционноспособные в-ва. Галогениды бора BГ3 получают при нагревании. 2B+3Г2=2BГ3. И вз-вия оксида бора с углем в присутствии галогена. 2B2O3+3C+6Г2=4BГ3+3CO2.В обыных условиях ВF3 –газ, BСl3 и BBr3 – жидкости, BI3 – кристалл. Все они галогенангидриды борной к-ты и дымят на воздухе. Галогениды брома(кроме F) необратимо разлагаются водой с образованием борной и HГ. BГ3+3Н2О=Н3BO3+3HГ. Галогениды бора участвуют в реакциях присоединения. Оксид бора, B2O3 – твердое труднокристаллическое в-во. При взаимодействии с водой получается ортоборная кислота.При нагревании реагирует с оксидами Me с образованием метаборатов. В2O3+CuO=Cu(BO2)2. H3BO3- борная кислота, очень слабая, умеренно растворима в воде.При нагревании разлагается постепенно отщепляя воду.(2раза). При нейтрализации получаются соли различных полиборных кислот(но не борной). При избытки щелочи – соли метаборной к-ты. H3BO3+NaOH=NaBO2+2H2O. При недостатке щелочи – соли тетраборной к-ты 4H3BO3+2NaOh=Na2B4O7+7H2O. При добавлении щелочи к тетраборатам получаются метабораты и вода. В свободном состоянии тетраборной к-ты нет.При подкислении растворов любых борных кислот получается борная к-та.Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO4. Бор нужен для жизнидеятельности растений. Без него они останавливаются в развитии. (4) C(Pb(NO3)2) =C1/z(Pb(NO3)2)/z= 0,0005 [Pb2+]=C(Pb(NO3)2)=0,0005 C(Na2SO4) = C1/z(Na2SO4)/z = 0,0005 [SO42-]=C(Na2SO4)=0,0005 [Pb2+]*[SO42-]=2,5*10-5 > Ksp => осадок образуется 16 билет Структура периодической системы Д.И.Менделеева: периоды, группы, семейства. Закономерности в изменении свойств атомов: радиус, энергия ионизации, энергия сродства к электрону, относительная электроотрицательность. Понятие о коллигативных свойствах растворов. Законы Рауля и Вант-Гоффа для неэлектролитов. Сера: кислоты серы, их строение, получение, свойства. |
