1 итоговая.. 1. Белки высокомолекулярные органические вещества
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
Кофакторы. Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. 1. Роль металлов в присоединении субстрата в активном центре фермента Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. Ионы металлов - стабилизаторы молекулы субстрата. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента. 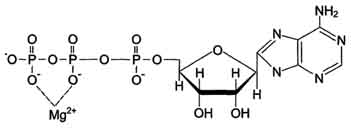 Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла. В качестве примера можно привести расположение субстратов в активном центре гексокиназы. Гексокиназа катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата: 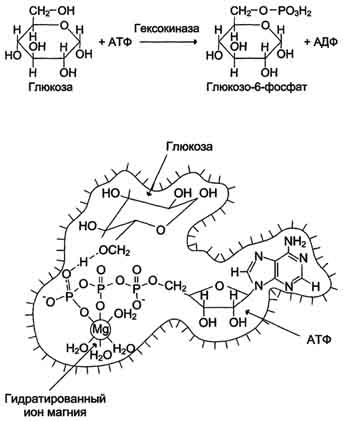 Ион Mg2+ участвует в присоединении и "правильной" ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу. Ионы металла - стабилизаторы активного центра фермента В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента.эти функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом: E-Me-S 2. Роль металлов в стабилизации третичной и четвертичной структуры фермента. Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, t и других незначительных изменениях внешнего окружения. Т.о, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы. Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+.Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn2+. Удаление Zn2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД. 3. Роль металлов в ферментативном Катализе. Участие в электрофильном катализе Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+. Ионы щёлочно-земельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза - цинксодержащий фермент, катализирующий реакцию образования угольной кислоты: СО + H2O ↔ H2CO3. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений. Участие в окислительно-восстановительных реакциях Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон: Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях. 4. Роль металлов в регуляции активности ферментов Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы C,катализирующего реакции фосфорилирования белков.Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов. Б. Коферметы. для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов. К коферментам относят следующие соединения: производные витаминов; гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов; нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ; фосфоаденозилфосфосульфат, участвующий в переносе сульфата; S-аденозилметионин (SAM) - донор метильной группы; глутатион, участвующий в окислительно-восстановительных реакциях. 35.Витамин РР (никотиновая кислота, никотинамид, витамин B3) 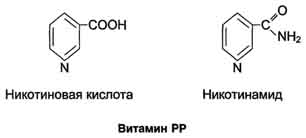 Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Витамин РР может образовываться из триптофана. Суточная потребность в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг. Биологические функции. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ.участвует в переносе водорода(электронов). NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы. NAD+ + АТФ → NADP+ + АДФ Недостаточность витамина РР приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред. Витамин В6(пиридоксин, пиридоксаль, Пиридоксамин) Все формы витамина В6 используются в организме для синтеза коферментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фосфорилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата. 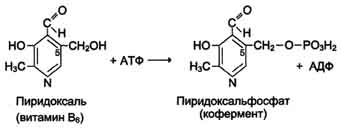 Пиридоксалевые ферменты играют ключевую роль в обмене аминокислот: катализируют реакции трансаминирования и декарбоксилирования аминокислот, участвуют в специфических реакциях метаболизма отдельных аминокислот: серина, треонина, триптофана, серосодержащих аминокислот, а также в синтезе гема. Клинические проявления недостаточности витамина. Авитаминоз В6 у детей проявляется повышенной возбудимостью ЦНС, периодическими судорогами, что связано, возможно, с недостаточным образованием тормозного медиатора ГАМК,специфическими дерматитами. У взрослых признаки гиповитаминоза В6 наблюдают при длительном лечении туберкулёза изониазидом (антагонист витамина В6). При этом возникают поражения нервной системы (полиневриты), дерматиты. Витамин В2 (рибофлавин). В основе структуры витамина В2 лежит структура изоаллоксазина, соединённого со спиртом рибитолом. 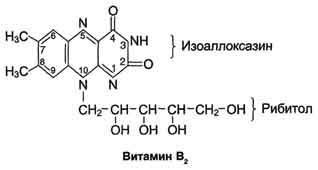 Главные источники витамина В2 - печень, почки, яйца, молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек получает витамин В2 как продукт жизнедеятельности кишечной микрофлоры. Суточная потребность в витамине В2 взрослого человека составляет 1,8-2,6 мг. Биологические функции. В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD.Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восст-х реакциях. Клинические проявления недостаточности рибофлавина- остановка роста у молодых организмов. Часто развиваются воспалительные процессы на слизистой оболочке ротовой полости, появляются длительно незаживающие трещины в углах рта, дерматит носогубной складки. Типично воспаление глаз: конъюнктивиты, васкуляризация роговицы, катаракта. Кроме того, при авитаминозе В2 развиваются общая мышечная слабость и слабость сердечной мышцы. 36 НАД ,надф(никотинамидадениндинуклеотид) Участвует в реакции дегидрирования,перенос H Витамин-предшественник-никотинамид (рр) 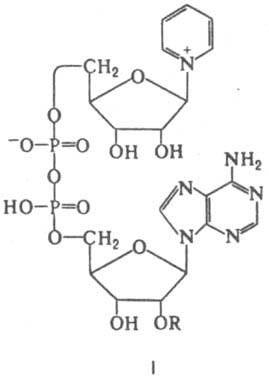 ФМН(флавинмононуклеотид) и ФАД (флавинадениндинуклеотид) Участвуют в реакции H, электронов Витамин-предшественник- рибофлавин (В2) 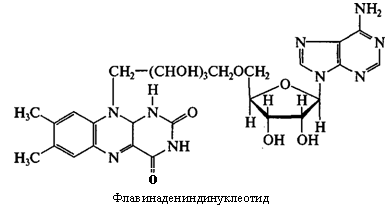 ТПФ(тиаминпирофосфат) Участвует в р-ции декарбоксилирования-альфа-кетакислоты Витамин-предшественник- тиамин (в1) 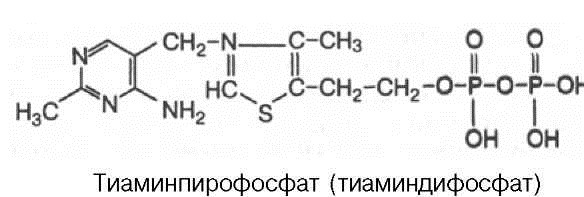 Биотин Связывание СО2, регуляция синтеза жиров Витамин в7 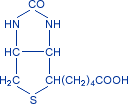 ТГФК Перенос одноуглеродных ферментов Витамин В12 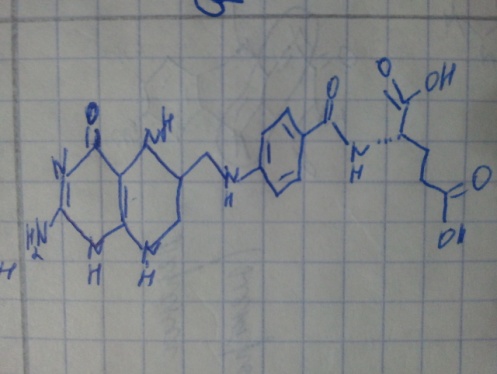 КоА Активация и перенос анильных гр. Формула общая HSKoA ПФ ПЕРЕНОС АМИНОГРУПП, декарбоксилирование Витамин В6 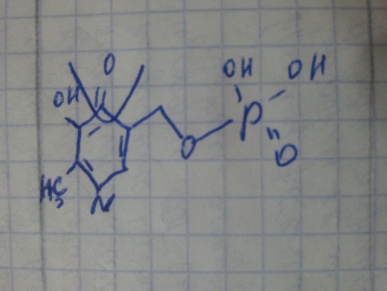 37 КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА Существует рабочее название - + «аза», например: пируваткарбоксилаза Тривиальное название, например: ренин, пепсин Номенклатира состоит из 4 чисел. Первое означает класс,второе-подкласс,3-подподкласс,4-порядковые норер. Существует 6 классов.
Название- «донор: акцептор-оксидоредуктаза» Подклассы: дегидрогеназа. Реакции отщепления H. Испол коферменты: над, надф,фад, фмн. Оксидаза. Акцептром служит молекул кислород. Оксигеназа. Атом кислорода присоединяется к субстрату.
Название- «донор:акцептор-транспортируемая гр.-трансфераза»
Название- «субстрат-гидролаза»
:название – «субстрат-отщепл гр или присоед гр»
38 Специфичность действия ферментов и ее вида Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться" (рис. 2-1). В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔ Е + Р, где Е - фермент (энзим), S - субстрат, Р - продукт. Данные обозначения общеприняты и происходят от английских слов enzyme, substrat, product. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра (рис. 2-2). 1. Субстратная специфичность Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
Абсолютная субстратная специфичность Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина: Другой пример фермента с абсолютной субстратной специфичностью - уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака. Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира (см. схему на с. 4). Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами. Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность. к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам. 2. Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов (см. схему ниже). |
