1 итоговая.. 1. Белки высокомолекулярные органические вещества
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
1.Белки́— высокомолекулярныеорганические вещества, состоящие из соединённых в цепочку пептидной связьюа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто -*ЪУЦЙ посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс. В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и ф-ми. Белки построены из 20 химически различных аминокислот, каждая из которых может занимать любое положение в полипептидной цепи. Кроме того, белки различаются количеством аминокислот, из которых они построены. Однако большинство таких белков в среде должны принимать множество конформаций с приблизительно одинаковой энергией, но разными химическими свойствами и функциями.в эволюциибыла отобрана лишь небольшая часть возможных вариантов белков, которые способны принимать единственную стабильную конформацию. первичная структура известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной из возможных конформаций, которая и определяет особенности функционирования данного белка. Возникновение новых белков часто связано с незначительными изменениями в структуре уже имеющихся белков.белок с полезными свойствами или основная структурная часть этого белка могут входить в состав других белков. Такие белки, имеющие схожую последовательность аминокислот и родственные функции, объединяют в семейства родственных белков. В основе структуры любого организма и всех протекающих в нем жизненных реакций лежат белки. Любые нарушения в этих белках приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций. Структурная. Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин(поверхностный, основной белок цитоскелета эритроцитов), гликофорин(интегральный, фиксирует спектрин на поверхности), К данной функции можно отнести участие в создании органелл – рибосомы. Ферментативная. Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью. Гормональная. Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон. Рецепторная. Эта ф-я закл в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная. Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин(транспорт железа) или через мембраны - Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки). Резервная. В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная. Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитная. Защитной функцией при инфекциях обладают иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны. 2) РАЗДЕЛЕНИЕ ИНДИВИДУАЛЬНЫХ БЕЛКОВ Изучение строения и свойств белков невозможно без их выделения из клетки и очистки от других белков и органических молекул. Стадии: 1. Разрушение клеток изучаемой ткани и получение гомогената. 2. Разделение гомогената на фракции центрифугированием, получение ядерной, митохондриальной, цитозольной или иной фракции, содержащей искомый белок.
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей . Высаливание. Различные белки выпадают в осадок при разной концентрации соли в растворе. Постепенно повышая ее концентрацию, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольшой концентрации солей. 5 Гель-фильтрация — метод молекулярного просеивания молекул через набухшие гранулы сефа-декса (трехмерные полисахаридные цепи декстра-на, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируются с колонки. Ультрацентрифугирование — метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжелые белки образуют фракции, расположенные ближе ко дну кюветы, более легкие — к поверхности. Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных нерастворимых полимеров. Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть возрастающими концентрациями NaCl; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, прикрепленный к ионогенным группам смолы. Аффинная хроматография — наиболее специфический метод выделения индивидуальных белков. К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок. Электрофорез белков Метод основан на том, что при определённом значении рН и ионной силы раствора бел- ки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки — к катоду (—). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду,в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам. Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, а,-глобулины, а2-глобулины, в-глобулины и у-глобулины Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе. 3) Хроматография. Принцип основан на способности веществ специфически адсорбироваться на адсорбенте, заключенном в колонке. Ионообменная хроматография метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий . В качестве неподвижной фазы используют ионообменники — полимерные органические вещества, содержащие заряженные функциональные группы. Различают положительно заряженные анио-нообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу , и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу содержащую анионные группы. Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионооб-менник. При пропускании раствора белка через колонку прочность связывания белка с анионо-обменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионообменнике, можно смыть буферными растворами с различной концентрацией соли, и разными значениями рН. Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли -СМЫВАются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок. Аффинная хроматография, или хроматография по сродству Это наиболее специфичный метод выделения индивидуальных белков, основанный на избирательном взаимодействии белков с лигандами, прикреплёнными (иммобилизированными) к твёрдому носителю. В качестве лиганда может быть использован субстрат или кофермент, если выделяют какой-либо фермент, антигены для выделения антител и т.д. Через колонку, заполненную иммобилизованным лигандом, пропускают раствор, содержащий смесь белков. К ли-ганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом (рис. 1-58). Белок, адсорбированный на колонке, можно снять, промыв её раствором с изменённым значением рН или изменённой ионной силой. В некоторых случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом. Разделение аминокислот с помощью ионообменной хроматографии Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с ка-тионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты S03), к которым присоединены ионы Na+ ( В катионообменник вносят смесь аминокислот в кислой среде (рН 3,0), где аминокислоты в основном представляют катионы, т.е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы. Чем больше суммарный заряд аминокислоты, тем прочнее её связь со смолой. Так, аминокислоты лизин, аргинин и гистидин наиболее прочно связываются с катионообменником, а аспарагиновая и глу-таминовая кислоты — наиболее слабо. Высвобождение аминокислот из колонки осуществляют вымыванием (элюированием) их буферным раствором с увеличивающейся ионной силой (т.е. с увеличением концентрации NaCl) и рН. При увеличении рН аминокислоты теряют протон, в результате уменьшается их положительный заряд, а следовательно и прочность связи с отрицательно заряженными частицами смолы. Каждая аминокислота выходит из колонки при определённом значении рН и ионной силы. Со-бирая с нижнего конца колонки раствор (элюат) в виде небольших порций, можно получить фракции, содержащие отдельные аминокислоты. 4):Азотометрические методы основаны на определении количества белкового азота, образующегося при разрушении аминокислот, входящих в состав белков.. В методе Кьельдаля, азот, содержащийся в составе белков, окисляют до иона аммония и его количество определяют титрованием точным раствором соляной кислоты. Кроме того, ион аммония может быть определен реактивом Несслера, манометрическим методом после превращения иона аммония в молекулярный азот под действием гипобромита или с помощью оптического теста Варбурга при участии фермента глутаматдегидрогеназы. Исходя из того, что белки из биологических объектов содержат в среднем 16 % азота, полученное в результате анализа количество азота умножают на коэффициент 6,25. Недостатком азотометрических методов является длительность и сложность процедуры, даже при том, что аммиак, образующийся в реакции, можно определять ферментативным методом. Автоматизация позволяет использовать этот метод в ряде случаев в качестве метода сравнения из-за его достаточной точности и воспроизводимости. Гравиметрические методы Гравиметрические (весовые) методы определения белка основаны на высушивании белков до постоянной массы и взвешивании на аналитических весах. Методы трудоемки и в настоящее время практически не используются для определения общего белка сыворотки. Гравиметрический метод продолжает использоваться в некоторых лабораториях для определения фибриногена в плазме крови. «Преципитационные» методы определения общего белка основаны на снижении растворимости белков и образовании суспензии взвешенных частиц под воздействием различных агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния либо по ослаблению светового потока образовавшейся суспензией (турбидиметрический метод анализа). Результаты данной группы методов зависят от множества факторов: скорости смешивания реактивов, температуры реакционной смеси, значения рН среды, присутствия посторонних соединений, способов фотометрии. Тщательное соблюдение условий реакции способствует образованию стабильной суспензии с постоянным размером взвешенных частиц и получению воспроизводимых результатов. «Преципитационные» методы для определения белка в сыворотке крови не получили признания и нашли применение при определении белка в моче, спинномозговой жидкости и многих индивидуальных белков с использованием специфических антител. Спектрофотометрические методы определения общего белка сыворотки крови основаны на измерении светопоглощения в ультрафиолетовой области. Растворы белка обладают поглощением при 270–290 и 200–225 нм. Поглощение при 270–290 нм определяется присутствием в молекуле белка ароматических аминокислот — тирозина, триптофана и фенилаланина. Поглощение при 200–225 нм практически в 20 раз выше, чем при 280 нм, и обусловлено главным образом пептидными связями. Точность и специфичность методов определения белка, основанных на поглощении при 270 –290 нм, невелика, поскольку содержание тирозина и триптофана может колебаться в различных белках сыворотки крови. Кроме того, присутствие в сыворотке свободных аминокислот — тирозина и триптофана, мочевой кислоты и билирубина, поглощающих при 280 нм, вносит определенную погрешность. В связи с этим данный метод не используют для прямого определения содержания общего белка в сыворотке. Напротив, поглощение в ультрафиолетовой области — 200 – 225 нм обусловлено в основном пептидными связями, в связи с чем величина поглощения различных белков сыворотки различается незначительно. В этом спектральном диапазоне закон Бера соблюдается при концентрации белка в сыворотке до 120 г/л. Определение общего белка сыворотки крови с помощью прямой фотометрии при 210 нм обеспечивает получение результатов, сравнимых с биуретовым методом и методом Кьельдаля. В то же время данный метод практически не применяется из-за необходимости использования кювет, не поглощающих при 210 нм, и монохроматора, что удорожает метод. Рефрактометрические методы определения общего белка сыворотки основаны на способности растворов белка к преломлению светового потока. показатель преломления воды равен 1,3332,. Калибровку прибора проводят сывороткой с известной концентрацией белка. Простота делает рефрактометрию удобным методом для определения содержания общего белка в сыворотке крови, хотя при ряде заболеваний, в частности, при сахарном диабете, хронической почечной недостаточности его использование может приводить к существенной ошибке. Колориметрические методы определения общего белка основаны на цветных реакциях белков с хромоген-образующими реактивами или на неспецифическом связывании красителя. Среди колориметрических методов определения концентрации общего белка сыворотки наиболее распространенным считается биуретовый метод, основанный на так называемой «цветной биуретовой реакции», в ходе которой белки реагируют в щелочной среде с сульфатом меди с образованием соединений, окрашенных в фиолетовый цвет, интенсивность окраски зависит от концентрации общего белка в сыворотке. Биуретовый метод определения общего белка в сыворотке крови был утвержден в качестве унифицированного Колориметрические методы определения общего белка сыворотки крови достаточно просты и относительно дешевы. К недостатку метода относится интерферирующее действие некоторых веществ (в том числе лекарств). 5) По форме молекул белки можно разделить на две большие группы — глобулярные (имеющие сферическую форму) и фибриллярные (удлиненной формы). К глобулярным относят белки, у котор.молекула имеет форму эллипса.их Большинство и. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков — рассмотренные выше миоглобин и гемоглобины. Фибриллярные белки имеют вытянутую, нитевидную структуру, К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин — белок свёртывающей системы крови. 1, Строение и функции коллагенов механические свойства связаны с их первичной и пространственной структурами. Молекулы коллагена состоят из трёх полипептидных цепей,. В состав коллагенов могут входить три одинаковые или разные цепи. каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11 % — аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, а ги-стидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры а-цепи коллагена содержится также— гидрокси-лизин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-X-Y, где X и Y могут быть любыми аминокислотами, но чаще в положении X стоит пролин, а в положении Y — гидроксипролин или гидроксилизин. Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя левозакрученную спиральную конформацию. На один виток спирали приходится 3 аминокислотных остатка, а не 3,6. Спираль пептидной цепи коллагена стабилизирована не за счёт водородных связей (так как пролин их не образует), а силами стерического отталкивания пирролидиновых колец в остат ках пролина. В результате расстояние межд аминокислотными остатками увеличивается, и она оказывается более развёр нутой Спирализованные полипептидные цепи, пе ревиваясь друг около друга, образуют трехце почечную правозакрученную суперспиральную молекулу «Жёсткие» аминокислоты — пролин и гидроксипролин — ограничивают вращение полипеп тидного стержня и увеличивают тем самым стабильность тройной спирали. Глицин, всегда находите в месте пересечения цепей; отсутствие радика ла позволяет цепям плотно прилегать А. Структура и функции миоглобина Миоглобин относят к классу гемсодержа-щих белков, т.е. он содержит простетическую группу — гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.Миоглобин содержится в красных мышцах и участвует в запасании кислорода. Апомиоглобин — белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 а-спи-ралей. а-Спирали содержат от 7 до 23 аминокислот. Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис располагающихся в активном центре. Белки — высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков — и от количества входящих в него протомеров методами определения молекулярной массы все еще остаются физико-химические методы наиболее часто используются методы седиментационного анализа, гель-хроматография и гель-электрофорез. методами седиментационного анализа проводят в ультрацентрифугах , в которых удается создать центробежные ускорения (g), превышающие в 200000 и более раз ускорение земного притяжения. Обычно вычисляют молекулярную массу по скорости седиментации молекул белка или седиментационному равновесию. По мере перемещения молекул от центра к периферии образуется резкая граница растворитель-белок (регистрируется автоматически Определение молекулярной массы белков методом ультрацентрифугирования требует много времени и сложной и аппаратуры. разработаны 2 простых метода (гель-хроматография и электрофорез. гель-хроматография, преимущество: не требуется выделять белок в чистом виде, так как примеси других белков не мешают определению, поскольку каждый из них проходит через колонку со свойственной ему скоростью, определяемой молекулярной массой. Это обстоятельство широко используется в энзимологии Электрофорез -прямая пропорциональная зависимость между молекулярной массой и подвижностью белков. 6) В составе белков в организме человека встречают только 20 а-аминокислот. 1. Общие структурные особенности аминокислот, входящих в состав белков Общая структурная особенность аминокислот — наличие амино- и карбоксильной групп, соединённых с одним и тем же а-углеродным атомом. R — радикал аминокислот — в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. 2. Классификация аминокислот по химическому строению радикалов По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические 3. Классификация аминокислот по растворимости их радикалов в воде Аминокислоты с неполярными радикалами К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Аминокислоты с полярными незаряженными радикалами серин, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, и цистеин Аминокислоты с полярными отрицательно заряженными радикалами аспарагиновую и глу-таминовую аминокислоты, Аминокислоты с полярными положительно заряженными радикалами имеют лизин и аргинин. Строение И СВОЙСТВА ПЕПТИДОВ Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между карбоксильной группой одной аминокислоты и а-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды 1. Строение пептида Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками.. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную -карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название «пептидный остов» ( Пептиды различаются по аминокислотному составу, количеству и порядку аминокислот. 2. Характеристика пептидной связи 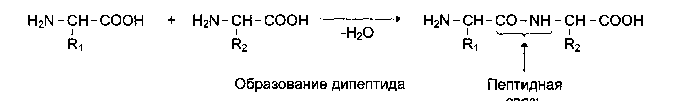 Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу Связь между углеродным атомом и аминогруппой или а-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е. -углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, В живых организмах пептидные связи в белках разрываются с помощью специальных про-теолитических ферментов Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию 7. Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Методы изучения первичной структуры белка. 1. Определение аминокислотного состава белка Первый этап в определении первичной структуры белков заключается в качественной и количественной оценке аминокислотного состава данного индивидуального белка. Кислотный гидролиз белка Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в течение 24 ч. В результате разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты Разделение аминокислот с помощью ионообменной хроматографииСмесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Количественный анализ полученных фракций.нагреваютотдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты. 2. Определение аминокислотной последовательности в белке Определение N-концевой аминокислоты в белке и последовательности аминокислот в олигопептидах Изучение первичной структуры белков имеет важное общебиологическое и медицинское значение. Изучая порядок чередования аминокислотных остатков в индивидуальных, можно выявить общие фундаментальные закономерности формирования пространственной структуры белков.многие генетические болезни - результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания. Установление первичной структуры белков включает 2 основных этапа: определение аминокислотного состава изучаемого белка; аминокислотной последовательности в белке. Например, при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (HbS) – такого гемоглобина, который в дезоксиформеполимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа, теряют эластичность и при прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу. Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур. 8. Вторичная структура белка –пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова.регулярные структуры двух типов: а-спираль и б-структура. Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.  α-Спираль пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп. Водородные связи ориентированы вдоль оси спирали. На один виток а-спирали приходится 3,6 аминокислотных остатка. В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате ?-спираль "стягивается" множеством водородных связей. связи относят к слабых, их количество обеспечивает максимально возможную стабильность ?-спирали. гидрофильность ?-спиралей уменьшается, а их гидрофобность увеличивается. ?-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования ?-спиралей полипептидная цепь укорачивается. Радикалы аминокислот находятся на наружной стороне ?-спирали и направлены от пептидного остова в сторонынекоторые из них могут нарушать формирование ?-спирали. К ним относят: пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролита, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и ?-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб; участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания; участки с близко расположенными объёмными радикалами, механически нарушающими формирование ?-спирали, например метионин, триптофан β-Складчатый слойСтруктура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, ?-Структура образует фигуру, подобную листу, сложенному "гармошкой" Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В ?-структурах водородные связи расположены перпендикулярно полипептидной цепи. Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная ?-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного ?-складчатого слоя. 9. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. В стабилизации третичной структуры белка принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. Связь с первичной структурой. Третичная структура в значительной степени предопределена первичной структурой. Усилия по предсказанию третичной структуры белка основываясь на первичной структуре известна как задача предсказания структуры белка. Однако, окружающая среда, в которой белок сворачивается существенно определяет конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом включают окружающую среду косвенно. Супервторичная структура белков. сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков.она формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания а-спиралей и б-структур часто обозначают как "структурные мотивы". 1. Супервторичная структура типа б-бочонка каждая б-структура расположена внутри и связана с а-спиральным участком полипептидной цепи, е Супервторичную структуру в виде-б-бочонка имеют некоторые ферменты. 2. Структурный мотив "а-спираль-поворот-а-спиралъ" Этот "структурный мотив" обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки - большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки. В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль - в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК 3. Супервторичная структурав виде "цинкового пальца" Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. "Цинковый палец" - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя - гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина 4. Супервторичная структура в виде "лейциновой застёжки-молнии" Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых "лейциновая застёжка-молния". 10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами. Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура - объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров. Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей. В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер. Для белков с четвертичной структурой характерно понятие субъединицы. Субъединица – это функционально активная часть молекулы белка. Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β - цепей. Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия. Активные центры возникают при образовании четвертичной структуры. В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность. Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения ,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода .Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой. Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров. Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода. |
