Коллоквиум по биохимии на тему метаболизм углеводов. Определение общего белка в сыворотке крови
 Скачать 93.54 Kb. Скачать 93.54 Kb.
|
определение общего белка в сыворотке крови биуретовым методом Принцип метода- основан на цветной реакции белка с биуретовым реактивом.(гидроксид меди2). Реакция протекает по пептидным связям с образованием окрашенного фиолетового комплекса. норма общего белка в сыворотке- 65-80 г/л ход работы: вносим рабочий реагент в каждую пробирку; вносим калибратор в контрольную пробирку; в опытные пробирки-сыворотку; инкубируем 15мин(t=18-25); на ФЭК измеряем оптическую плотность; расчет общего бека ведем по формуле: Собщ= Е0/Ек * Сст (Сст=70г/л) Снижение белка (гипопротеинемия) может быть вследствии вегетарианской диеты; увеличенной потере белка пациентом, когда выполняется курс диеты и голодания; патологии формирования белка у больного. Повышенное содержание белка (гиперпротеинемия) формируется по причине обезвоживания, то есть утраты части внутрисосудистой жидкости. определение Hb крови метгемоглобиновый метод принцип метода: Весь Нв крови переводится в метНв путем окисления трансформирующим реактивом. Содержание метНв измеряется фотометрически при 500нм. ход анализа: 0,02мл крови переливают к 5мл трансф. р-ра перемешивают чз 10мин,измеряют окраску на ФЭК при зеленом светофильтре против трансф. р-ра или воды. записывают величину оптической плотности расчет п оформуле: Нв= Еоб*150/0,3 (Еоб-величина оптической плотности;0,3-величина оптической плотности опытной пробирки стандартного р-ра Нв с концентрацией 150г/л) гемихромный метод принцип метода: Нв крови под действием ПАВ додецилсульфата натрия переходит в окисленную форму гемихром, интенсивность окраски которого пропорциональна окраски Нв в крови и измеряется фотомертически при 540нм. ход работы: к 5мл раб. реагента добавить 20 мкл своротки, взболтать инкубировать 20мин при Т=18-25 измерить оптическую плотность р-раЕ на ФЭК расчет по формуле: Снв= Еоп*Сст/Ек (Сст=120г/л) норма Нв (120) г/л м 130-140 I 130-160 I 140-180 ж 120-130 I 120-140 I 130-160 определение белковых фракций сыворотки крови используется зональный электрофорез с поддерживающей средой-носителем Принцип метода: под влиянием постоянного электрического поля белки сыворотки, имеющие отрицательный заряд, движутся по смоченной буферным раствором бумаге по направлению к положительному электроду со скоростью, зависящей от величины заряда и молекулярной массы частиц. Вследствие этого белки сыворотки крови разделяются на 5 фракций: альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины. Альбумины обладают выраженным отрицательным зарядом и небольшой молекулярной массой, поэтому они продвигаются в электрическом поле с наибольшей скоростью и дальше других фракций отстают от линии старта. С меньшей скоростью движутся альфа-1-, альфа-2- и бета-глобулины. Наименьшей скоростью продвижения отличаются гамма-глобулины, они практически остаются на линии старта, гамма-глобулины — крупные белковые молекулы, их заряд близок к нейтральному. Окрашенные пятна белковых фракций, полученные методом электрофореза на бумаге или других носителях, носят название электрофореграммы. Процентное содержание отдельных белковых фракций меняется при многих заболеваниях, хотя общее содержание белка в сыворотке крови может оставаться в пределах нормы (диспротеинемия) норма: - альбумина - 56,3-68,8 %, - альфа-1-глобулинов - 3-5,8 %, - альфа-2-глобулинов - 6,9-10,5%, - бета-глобулинов - 7,3-12,5 %, - гамма-глобулинов - 12,7-19,2 %. определение глюкозы в крови Для этого используют основных 4 метода - определение натощак в капиллярной крови, с помощью ТТГ, определение глитированного Hb, анализ мочи. ТТГ- выполняется с помощью сахарной нагрузки. При поступлении ГЛЮ она легко всасывается, ее уровень в крови увеличивается. В ответ у здорового человека поступает инсулин и через 2-2,5 ч ГЛЮ снижается до нормы. При дефиците инсулина такого снижения нет(гипергликемия). Метод ТТГ: Кровь берут 2 раза-натощак и чз 2ч после получения сахарной нагрузки(ГЛЮ-для взрослого 75г на 100мл,для детей 1,75г на кг массы тела). В пробах определяется содержание ГЛЮ определение глитированного Hb- В основе метода лежит выделение глюкозилированной фракции с помощью аффиной хроматографии. норма- 4,5-5,5% от общего Hb.При СД-повышается в зависимости от продолжительности предшествующей гипергликемии Обнаружение ГЛЮ в моче выполняется с помощью диагностических полосок(глюкотест).При наличии ГЛЮ в моче-изменяется окраска индикаторной зоны. Этим методом выявляют глюкозурию. ТТГ, метод сахарной нагрузки Позволяет установить инсулиновую недостаточность Метод выполняется с помощью сахарной нагрузки. При поступлении ГЛЮ она легко всасывается, ее уровень в крови увеличивается. В ответ у здорового человека поступает инсулин и через 2-2,5 ч ГЛЮ снижается до нормы. При дефиците инсулина такого снижения нет(гипергликемия). Метод ТТГ: Кровь берут 2 раза-натощак и чз 2ч после получения сахарной нагрузки(ГЛЮ-для взрослого 75г на 100мл,для детей 1,75г на кг массы тела). В пробах определяется содержание ГЛЮ
определение гли-HbA1 в крови В основе метода лежит выделение глюкозилированной фракции с помощью аффиной хроматографии. норма- 4,5-5,5% от общего Hb При СД-повышается в зависимости от продолжительности предшествующей гипергликемии определение общего холестерина в сыворотке крови (МЕТОД ИЛЬКЕ). Значение метода: Холестерин может накапливаться в крови в больших количествах при нарушении жирового обмена. Длительнаягиперхолестеринемия при измененных условиях растворимости холестерина приводит к развитию атеросклероза. Гиперхолестеринемия наблюдается при механической желтухе, нефрите и нефрозах, гипотериозе, авитаминозе группы «В». Очень высокое содержание холестерина в крови наблюдается при сахарном диабете, липоидном нефрозе. Гипохолестеринемияобнаружена при анемиях, лихорадочных состояниях, сыпном тифе, голодании, гипертиреозе, раковой кахексии, поражении ЦНС. Принцип метода: Холестерин в присутствии смеси ледяной уксусной кислоты, уксусного ангидрида и конц. серной кислоты в соотношении 1:5:1 (реактив Ильке) превращается в сульфокислоту холестерина зеленого цвета. Нормы— 3,0—6,0 ммоль/л (3,5-6,8) Повышение: - генетические особенности (семейные гиперлипопротеинемии) - заболевания печени - гипотиреоз (недостаточность функции щитовидной железы) - алкоголизм - ишемическая болезнь сердца (атеросклероз) - беременность - прием синтетических препаратов половых гормонов (контрацептивы) Снижение: - гипертиреоз (избыток функции щитовидной железы) - нарушение усвоения жиров определение холестерина ЛПВП,индекс атерогенности ЛПВП (хороший холестерин) – В составе липопротеинов Высокой Плотности (ЛПВП), холестерин удаляется из стенок сосудов и ЛПНП. В последствии ЛПВП, утилизируются в печени. ЛПВП выполняют защитную функцию и препятствуют развитию атеросклероза. Для достоверной диагностики нарушений обмена холестерина, достаточно определения Общего холестерина (ОХС) и ЛПВП (Липопротеинов Высокой Плотности). На основе этих данных рассчитывается Индекс Атерогенности - Основной показатель по которому можно достоверно судить о нарушении и определить прогноз. Индекс Атерогенности = ОХС – ЛПВП ЛПВП Норма ЛПВП0,9 –1,8 ммоль/л Индекс Атерогенности должен быть не более 3 Повышение: - патология печени (хронический гепатит, цирроз, алкоголизм и другие хронические интоксикации) Снижение: - декомпенсированный сахарный диабет - хроническая почечная недостаточность - ранний атеросклероз коронарных артерий определение мочевины в сыворотке крови, с помощью диагностической полоски Данные методы определения концентрации мочевины в сыворотке крови заключаются в использовании реакции между аммиаком и pH-индикатором. Этот подход использован в технологии «сухой химии» в виде тест-полосок с последующей визуальной оценкой результатов с помощью отражательной фотометрии. Образующийся на первом этапе аммиак диффундирует через полупроницаемый слой тест-полоски и реагирует с pH-индикатором, вызывая окрашивание сенсорной зоны. Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 3,5 — 7,5 ммоль/л (21-45 мг/дл). За сутки выделяется 15-36 г (250-600 ммоль/л). У женщин, по сравнению со взрослыми мужчинами, концентрация мочевины в сыворотке крови обычно ниже. У пожилых людей (старше 60 лет) наблюдается некоторое увеличение концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу. определение креатина в моче Креатинин образуется из креатинфосфата и является постоянной составной частью мочи. За сутки с мочой выделяется 1-2 г (8,8 – 17,6 ммоль/л) креатинина, что составляет 2-7% азота от всех азотсодержащих соединений мочи. Количество выделенного с мочой креатинина зависит от интенсивности процессов распада белков тканей организма и содержания креатинина в пище (его много в мясной пище). Повышенное содержание креатинина в моче наблюдается при острых инфекциях, лихорадочных состояниях, у больных сахарным диабетом. Моча здорового человека не содержит креатина, и выделение его с мочой свидетельствует о патологии поперечнополосатых мышц (миастения, мышечная дистрофия). Метод количественного определения креатинина в моче основан на цветной реакции Яффе с пикроновой кислотой с последующим определением интенсивности окраски на ФЭКе. Концентрацию креатинина в исследуемой моче находят по калибровочной кривой, выражающей зависимость интенсивности окраски стандартных растворов от их концентрации. Ход работы: В одну мерную колбу отмеривают 0,5 мл мочи, в другую – 0,5 мл дистиллированной воды (контрольная проба). В обе колбы добавляют по 3 мл насыщенного раствора пикриновой кислоты, смесь перемешивают, добавляют по 0,2 мл 10% NaOH и доводят объём дистиллированной воды до 100 мл. Перемешивают содержимое колб, выдерживают 10 мин при комнатной температуре и измеряют на ФЭКе оптическую плотность опытной пробы против контроля в кюветах с толщиной слоя 1 см со светофильтром (зеленый, длина волны 540 нм). Зная оптическую плотность опытного раствора, по калибровочному графику определяют содержание креатинина в пробе, взятой для анализа, и расчитывают количество креатинина, выделенного с мочой за сутки по формуле: K= (а * V(сут.) ) / V где а – содержание креатинина в пробе с мочой, найденное по калибровочному графику, ммоль; V – объём мочи, взятой для анализа, мл; V(сут.) – суточный объём мочи, мл. определение общего и прямого билирубина в сыворотке крови Билирубин образуется в организме в результате естественного распада гемоглобина эритроцитов в клетках РЭС (печень, селезенка). Билирубин относится к группе желчных пигментов и является токсическим веществом; он обезвреживается в клетках печени. Транспортируется билирубин к месту обезвреживания в комплексе с белком. В печени происходит процесс обезвреживания по схеме: Билирубин + УДФ-глюкуроновая кислота –(Глюкуронилтрансфераза) - Билирубин (моно- и диглюкуронид). Глюкурониды билирубина хорошо растворимы, они выводятся из печени по желчевыводящим путям. В сыворотке крови содержится 2 вида билирубина: нерастворимый (в виде комплекса с белками, обеспечивающий транспорт) и растворимый ( билирубиндиглюкуронид). Вместе обе формы составляют общий билирубин. Определение содержания билирубина в крови является важным диагностическим тестом. Обычно билирубин содержится в крови в небольших количествах – 0,2 – 1,0 мг/дл (3,4 – 17,0 мкмоль/л), причём 75% из них составляет билирубин, связанный с белками (нерастворимый). При различных заболеваниях печени и желтухах часто наблюдается гипербилирубинемия (превышает до 30-35 мг/дл). Метод Индрашека-Грофа. Согласно стандартной процедуре анализа набор рассчитан на 138 определений общего и 138 определений прямого билирубина. Принцип метода: Прямой (связанный, конъюгированный с глюкуроновой кислотой) билирубин непосредственно реагирует с диазотированной сульфаниловой кислотой, а общий билирубин определяется в присутствии кофеинового реагента с образованием окрашенного азосоединения. Интенсивность окраски реакционной среды пропорциональна концентрации билирубина и измеряется фотометрически при длине волны 535 (500-560) нм. Подготовка реагентов к Процедуре анализа и их стабильность Для исследования приготовьте диазореагент: Смешайте необходимые количества сульфаниловой кислоты и нитрита натрия в соотношении 40:1. Содержимое флакона с калибратором растворите в 2 мл дистиллированной воды. После полного растворения концентрация билирубина составляет 85,5 мкмоль/л.  Для определения прямого билирубина точно через 5 минут (при комнатной температуре) измерьте величину экстинкции опытной пробы против соответствующей контрольной пробы при длине волны 535 нм (500 – 560 нм). Для определения общего билирубина через 20 мин (при комнатной температуре) измерьте величину экстинкции опытной пробы против соответствующей контрольной пробы при длине волны 535 нм (500 – 560 нм). Интенсивность окраски стабильна не менее 1 часа в защищенном от света месте. Экстинкцию калибратора измерьте против дистиллированной воды через 20 мин. (при комнатной темпера туре) при длине волны 535 нм (500–560 нм). рАсчЕт Расчет концентрации билирубина в пробе (С) проведите по формуле: С = (Е пробы/Е калибр.) * 85,5 мкмоль/л. где: Е пробы – экстинкция опытной пробы, Е калибр. – экстинкция калибровочной пробы, 85,5 – концентрация билирубина в калибраторе, мкмоль/л. Нормальные показатели Общий билирубин – 8,5-20,5 мкмоль/л. Прямой билирубин – до 4,0 мкмоль/л. определение активности трансаминаз АСаТ и АЛаТ в сыворотке крови 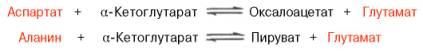 Аминотрансферазы — ферменты, катализирующие реакцию переноса аминогруппы (NH2-группы) вместе с протоном (ионом водорода) и парой электронов от аминокислот или аминов к кетокислотам или другим соединениям, содержащим в составе своей молекулы карбонильную группу (СО-группу). Биологическую роль А. чрезвычайно велика, т.к. они участвуют в трансаминировании — процессе, имеющем важнейшее значение для энергетического) и азотистого обмена. Установлено, что любые состояния, требующие срочной мобилизации компонентов белка для покрытия энергетических нужд организма (недостаточное или несбалансированное питание, все виды стресса и т.п.), связаны с адаптивным, гормонально-стимулируемым биосинтезом определенных А., прежде всего А., участвующих в глюконеогенезе (аланин- и аспартат-аминотрансфераз, аминотрансфераз ароматических аминокислот). Генетически обусловленная недостаточность некоторых А. лежит в основе патогенеза ряда наследственных болезней. Так, своеобразная форма прогрессирующей кольцевидной дистрофии сосудистой оболочки и сетчатки (хориоретинопатия) вызывается недостаточностью орнитин-оксокислота — аминотрансферазы. Наследственный дефект или подавление при гиповитаминозе В6 аминобутират-аминотрансферазы (трансаминазы g-аминомасляной кислоты) является одной из основных причин нарушения деятельности ц.н.с. при этой патологии. Содержание некоторых аминотрансфераз в крови является важным диагностическим признаком ряда заболеваний. Наибольшее клинико-диагностическое значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ). Повышение активности этих А. в крови позволяет распознавать патологические состояния, сопровождающиеся некрозом тканей. Так, при инфаркте миокарда активность АсАТ в крови резко возрастает (в 5—10 раз по сравнению с нормой) через 4—6 ч после начала заболевания, а затем постепенно снижается, достигая нормы примерно через 5 дней (в среднем на 3—7-й день). Повторное повышение активности АсАТ в крови говорит о продолжающемся процессе некротического распада ткани миокарда. При разрушении мышечной ткани (например, вследствие травмы) в крови возрастает активность как АсАТ, так и АлАТ. При вирусном гепатите (см. Гепатиты вирусные) активность АсАТ и АлАТ в сыворотке крови увеличивается, тогда как при механической желтухе, например при желчнокаменной болезни, активность этих А. в сыворотке крови остается в пределах нормы. Т.о., определение в крови активности АсАТ и АлАТ может использоваться наряду с клиническими признаками для дифференциальной диагностики вирусного гепатита и желчнокаменной болезни. Особенно информативно определение активности АлАТ для ранней диагностики гепатита, поскольку активность АлАТ в сыворотке крови начинает увеличиваться уже в продромальной стадии болезни, когда другие ее признаки еще не определились. Отношение активности АсАТ/АлАТ (коэффициент де Ритиса) в это время становится меньше 1. При тяжелом поражении печени отношение активностей этих ферментов меняется. В СССР определение активностей АсАТ и АлАТ осуществляют с помощью так называемого оптимизированного оптического теста, основанного на различии спектров поглощения окисленной и восстановленной форм кофермента НАД при длине волны 340 нм. Активность АсАТ в негемолизированной сыворотке крови определяют с использованием субстратно-буферного раствора, содержащего 0,25 моль/л L-аспарагиновой кислоты в 0,1 моль/л фосфатном буфере (рН 7,4). Используемый для определения активности АлАТ субстратно-буферный раствор содержит 0,63 моль/л L-аланина в 0,1 моль/л фосфатном буфере (рН 7,4). В норме активность АсАТ и АлАТ при 30 колеблется в пределах от 30 до 420 нмоль/(с×л), или от 2 до 25 ME. Международная единица (ME) соответствует 1 мкмоль/(мин×л), или 16,67 нмоль/(с×л). Унифицированным методом определения АсАТ и АлАТ в СССР признан также динитрофенилгидразиновый метод Райтмана — Френкеля, основанный на том, что продукты реакций, катализируемых АсАт и АлАТ (щавелевоуксусная и пировиноградная кислоты соответственно), при взаимодействии с 2,4-динитрофенил-гидразином в щелочной среде образуют окрашенные гидразоны. Интенсивность окраски, измеренная при длине волны 500—560 нм (зеленый светофильтр) в кювете с толщиной слоя 1 см, пропорциональна активности фермента. Нормальные величины активности АсАТ и АлАТ в крови, определенные методом Райтмана — Френкеля, равны 28—190 нмоль/(с×л), или 0,1—0,68 мкмоль/(ч×мл) при 37°. открытие белка в моче, количественное определение белка в моче Метод исследования: Качественные методы для обнаружения белка в моче основаны на способности белков к денатурации под влиянием различных физических и химических факторов. К качественным методам определения белка в моче относятся: кольцевая проба Геллера, проба с 15–20% сульфосалициловой кислотой, проба с кипячением. Методы качественного определения белка в моче не позволяет получать надежные и воспроизводимые результаты. Полуколичественные методы в настоящее время реализованы преимущественно методами сухой химии в форме диагностических полосок (тест-полосок) с оценкой результата визуально или с помощью анализаторов мочи. Для полуколичественного определения белка в моче в качестве индикатора чаще всего используется краситель бромфеноловый синий, обладающий большей чувствительностью по отношению к альбумину по сравнению с другими белками – глобулинами, мукопротеинами, гемоглобином и белком Бенс-Джонсона. Это свойство полосок делает их пригодными к обнаружению селективной протеинурии, когда практически весь белок представлен альбумином, но обуславливает получение ложноотрицательных результатов при других видах протеинурии. Количественные методы определения общего белка в моче включают турбидиметрические и нефелометрические, а также колориметрические. Турбидиметрические и нефелометрические методы основаны на снижении растворимости белков мочи вследствие образования суспензии взвешенных частиц под воздействием преципитирующих агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния (нефелометрия), либо по ослаблению светового потока образовавшейся суспензией (турбидиметрия). Колориметрические методы основаны на специфических реакциях белков с хромогенами, интенсивность образуемой окраски пропорциональна концентрации исследуемого вещества. При получении повышенных значений белка в моче с использованием качественных или полуколичественных методов для определения тяжести и установления механизма возникновения протеинурии целесообразно не только определить его количественное содержание, но и оценить изменения белкового спектра мочи, используя метод электрофореза или определить концентрацию отдельных белков мочи иммунохимическими методами. Методы, основанные на связывании белка с бромфеноловым синим Практически одновременно с применением кбГ для определения белка в биологических жидкостях было предложено использовать краситель бромфеноловый синий (бФс) [15–17] раствор бФс в кислой среде имеет желтый цвет и максимум поглощения при 440 нм. При связывании красителя с белками катионная форма красителя изменяется на анионную, имеющую синюю окраску, а максимум поглощения сдвигается до 597 нм. Реакция связывания бФс с белками происходит при рн 3,0 в течение 1 мин, стабильность окраски 8 ч. Данный метод имеет меньшую чувствительность, чем кбГ. Характеристики метода: чувствительность – 30–70 мг/л, линейная область определения – до 1 г/л, коэффициент вариации результатов измерения не превышает 5%; стандартное отношение объема мочи и раствора бФс составляет 1:5. Метод прост, краситель бФс доступен и недорог, поэтому может широко применяться в клинических лабораториях [18–21]. однако ни одна из известных нам зарубежных фирм не производит аттестацию белка в контрольных растворах мочи методом бФс. Это обусловлено тем, что бФс связывается преимущественно с альбумином, а не глобулинами и другими белками [20–23], поэтому определение белка в моче, содержащей сложную смесь белков, данным методом не обеспечивает необходимую точность анализа. традиционное применение альбумина в качестве калибратора для расчета концентрации белка не способствует получению правильных результатов при анализе проб мочи. Это наглядно продемонстрировано в результате экспериментов по определению общего белка методом бФс в растворах, содержащих искусственные смеси альбумина и глобулинов с концентрацией белка 1 г/л (табл. 1). как следует из данной таблицы, при использовании альбумина в качестве калибратора выявление глобулинов не превышает 30%. в растворах, содержащих альбумин с глобулином, заниженным оказывается показатель общего белка. Применение калибратора, содержащего альбумин с глобулином, несколько повышает правильность определения, но, тем не менее, она остается неудовлетворительной. низкое отношение объема реагента и образца, равное 5 (1,0:0,2), усиливает влияние матрикса мочи и интерференцию различных соединений, искажая результаты анализа. а отсутствие контрольных растворов мочи, белок в которых аттестован данным методом,не позволяет оценить правильность определения белка данным методом. таким образом, наборы реагентов, основанные на связывании белка с бФс, пригодны только для определения альбумина, а не общего белка. 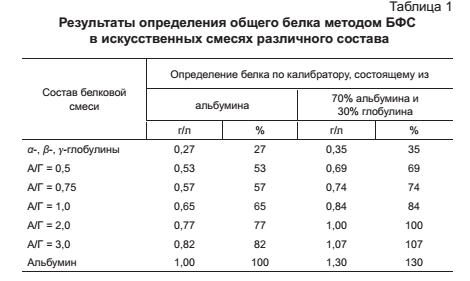 бензидиновая проба на кровь Качественное определение геминовой группировки гемоглобина. Принцип метода: реакция обусловлена способностью гемоглобина катализировать окисление бензидина перекисью водорода. Бензидин -> парахинондиимин. Жидкость приобретает сине-зел. окраску, которая при стоянии становится красно-бурой. Реакция служит для обнаружения минимальных количеств крови в биологических жидкостях. Так же применяется в судебной экспертизе для обнаружения следов крови на различных поверхностях в различные периоды времени. Ход работы: 1 пробирка – 1 см кубический воды + 5 капель бензидина + 5 капель 3% перекиси водорода. 2 пробирка – 1 см кубический раствора с кровью + 5 капель бензидина + 5 капель перекиси. Наблюдаем: в пробирке с водой – цвет хаки В пробирке с кровью – сине-зеленый. экспресс-анализ мочи (определение глюкозы,ацетона,белка,pH,стеркобилиногена) Полоски гептоФАН испульзуют для обнаружения патологических веществ и количественной оценки содержания их в моче. С помощью этих полосок можно определить пш мочи, содержание белка, глюкозы, билирубина, кетоновых тел, крови, уробилиногена. ПШ – основан тест на изменении цвета смешанного кислот основного индикатора с переходом от оранжевой окраски через желтую, зеленую до синей в диапозоне ПШ. Значение ПШ можно определить с точностью до 0,5 ед ПШ. Белок – тест основан на изменении цвета кислотно-основного индикатора под влиянием белков. Проба наиболее чувствительна к альбумину. Менее к глобулинам, мукопротеинам, гемоглобину. Белок в моче (альбумины) обнаруживаются при нефритах, нефрозах и острых инфекционных заболеваниях. Глюкоза – тест основа на ферментативной (глюкозооксидаза/пероксидаза) реакции. Тест типичен для глюкозы, другие сахара не взаимодействуют. Появляется при СД. Уробилиноген и билирубин – тест основан на реакции азосочетания со стабилизированным реактивом (триазен). Билирубин и другие желчные пигменты появляются в моче при желтухе. Кетоны – тест основан на нитропруссидной реакции. Проба более чувствительна к ацетоуксусной кислоте, чем к ацетону. С бэтагидроксимасляной кислотой проба не реагирует. Кетоновые тела появляются в моче при СД и голодании. Кровь – тест основан на способности гемоглобина катализировать окисление индикатора ортотолуидина органическим гидропероксидом, содержащимся в зоне индикации. На этикетке нанесены две шкалы сравнения: одна для определения интактных эритроцитов (шкала с синими точками), другая – свободного гемоглобина (равномерно окрашенная цветная шкала). Кровь появляется в моче (гематурия) при нарушении целостности кровеносных сосудов мочевых путей. При тяжелых инфекционных заболеваниях, отравлениях и ожогах происходят разрушение эритроцитов, переход гемоглобина в плазму, а затем появление его в моче (гемоглобинурия). Проведение анализа: для анализа используют свежую патологическую мочу. 1-из патрона вынимают полоску, не касаясь зон индикации. 2-полоску опускают в исследуемую мочу на 1-2 с так, чтобы все зоны были смочены. Капли мочи с полоски удаляют, проведя полоской по краю пробирки. Полоску оставляют в горизонтальном положении. 3-приблизительно через 60 с сравнивают окраску зон индикации с соответствующей цветной шкалой для компонентов мочи на наружной поверхности патрона и находят соответствующее по окраске пятно. Записывают содержание компонентов мочи. |
