контрольная. 1. Биотехнология и медицина. 2
 Скачать 77.46 Kb. Скачать 77.46 Kb.
|
Содержание1. Биотехнология и медицина. 2 2. Системы теплообмена, пеногашения и стерилизации биореакторов. Аппараты периодического и непрерывного действия. 5 3.Промышленное производство белка одноклеточных организмов (БОО и БВК). Основные константы при непрырывном культивировании микроорганизмов. 8 4. Производство кормовых липидов. 14 5. Охарактеризовать действие комплексных ферментных аппаратов, применяемых на стадиях осахаривания и брожения при производстве этилового спирта. 15 Список использованных источников 25 1. Биотехнология и медицина.Медицинские биотехнологии подразделяются на диагностические и лечебные. Диагностические медицинские биотехнологии подразделяются на химические (определение диагностических веществ и параметров их обмена) и физические (определение физических полей организма). Определение физических полей человеческого организма имеет большое диагностическое значение. Физическая диагностика дешевле и быстрее, чем химическая, поэтому ее роль в будущем будет возрастать. Раньше диагностические химические биотехнологии сводились к определению в тканях и биологических жидкостях веществ, имеющих диагностическое значение. Назовем этот подход статическим. В настоящее время диагностика использует определение скоростей образования и распада, представляющих интерес веществ, а также определение активности ферментов, осуществляющих соответственно синтез и деградацию этих веществ. Назовем этот подход динамическим. И, наконец диагностика стала оценивать влияние на метаболизм диагностических веществ определенных функциональных воздействий. Такой подход можно назвать функциональным. Он позволяет выявить резервные возможности организма. Наиболее актуальными проблемами современной медицины являются борьба с сердечно-сосудистыми заболеваниями (прежде всего с атеросклерозом), с онкологическими заболеваниями, с аллергиями, старением и с вирусными инфекциями (в том числе со СПИДом)[2]. По мнению ряда специалистов, решение проблемы онкологических заболеваний будет достигнуто с помощью иммунологических методов, позволяющих избирательно уничтожать опухолевые клетки. Решение проблемы рака должно повысить среднюю продолжительность жизни. Решение проблем аллергических заболеваний определяется развитием иммунологии и прогрессом в изучении такой фундаментальной проблемы медицины, как воспаление. Химиотерапия и антибиотики, позволяющие эффективно бороться с бактериальной инфекцией, не эффективны в отношении вирусов. Предполагается, что существенный прогресс в деле борьбы с вирусными инфекциями будет, достигнут за счет развития молекулярной биологии вирусов, в частности изучения взаимодействия вирусов со специфическими для них клеточными рецепторами. Расшифровка генома человека и успехи в клонировании животных открывают ошеломляющие перспективы в медицине. Использование метода клонирования человека может привести к созданию банка "запасных частей" для конкретных людей и обеспечить весьма значительное продление их жизни. Однако против этого выдвигаются возражения морального порядка. Представляется, что дилемма будет разрешена с созданием технологий клонирования тканей и органов. Еще одну революцию в медицине вызывает изучение так называемых стволовых клеток, т.е. клеток, которые являются предшественниками других типов клеток, включая нервные. Стволовые клетки могут давать начало любым клеткам организма - и кожным, и нервным, и клеткам крови. Стволовые клетки способны превращаться в клетки всех типов тканей: клетки крови, внутренних органов, мышечных и костных тканей, кожного покрова, нейроны и др. Также они принимают непосредственное участие в регенеративных процессах организма и могут замедлять процесс старения. Использование стволовых клеток - это в перспективе решение проблемы регенерации, т.е. радикального лечения инсульта, инфаркта, восстановления утраченных конечностей и т.п., а также весьма существенное продление жизни. Представляется, что сейчас лидерами медицинской науки являются медицинская генетика и иммунология. Медицинская генетика может не только предотвращать появление на свет генетически неполноценных детей путем генетического консультирования их родителей и диагностировать генетические заболевания. Ее перспектива-это пересадка генов и управление их активностью. Иммунология позволяет создавать новые подходы к лечению иммунологических заболеваний (в том числе иммунодефицитов, аутоиммунных заболеваний и аллергии), инфекционных и онкологических заболеваний. Помимо широкого применения в сельском хозяйстве, на основе генной инженерии возникла целая отрасль фармацевтической промышленности, называемая “индустрией ДНК” и представляющая собой одну из современных ветвей биотехнологии. Более четверти всех лекарств, используемых сейчас в мире, содержат ингредиенты из растений. Генно-модифицированные растения являются дешевым и безопасным источником для получения полностью функциональных лекарственных белков (антител, вакцин, ферментов и др.) как для человека, так и для животных. Примерами применения генной инженерии в медицине являются также производство человеческого инсулина, производство эритропоэтина (гормона, стимулирующего образование эритроцитов в костном мозге. Разработка методов генной инженерии привела к тому "биотехнологическому буму", свидетелями которого мы являемся. Генетическая паспортизация позволяет прогнозировать и уменьшать риски сердечно-сосудистых и онкологических заболеваний, исследовать и предотвращать нейродегенеративные заболевания и процессы старения, анализировать нейро-физиологические особенности личности на молекулярном уровне), диагностирование генетических заболеваний, создание ДНК-вакцин, генотерапия различных заболеваний и т.д. 2. Системы теплообмена, пеногашения и стерилизации биореакторов. Аппараты периодического и непрерывного действия.Теплообмен в биореакторах осуществляется с помощью труб с охлаждающим или нагревающим агентом, которые оплетают аппарат и образуют так называемую рубашку реактора. Иногда эта система труб располагается непосредственно в полости ферментера. Нагревающими агентами в промышленных биореакторах служат горячая вода или пар, в лабораторных ферментерах чаще используется электрический подогрев[3]. Система пеногашения биореактора – это средство борьбы с избыточным пенообразованием. Существуют химические, механические, акустические и другие виды пеногашения. Наиболее часто применяют химические и механические способы. К химическим средствам пеногашения относятся поверхностно активные вещества, которые, внедряясь в стенки пузырей, становятся центрами их неустойчивости. Эффективными пеногаситслями служат растительные масла и животные жиры. Недостатком этих пеногасителей является то, что при их утилизации микробными клетками сами по себе способствуют пенообразованию. Механические пеногасители представляют собой различные устройства, сбивающие пену: диски, лопасти, барабаны, располагающиеся в верхней части реактора. Более сложными приспособлениями являются сепараторы пены, которые одновременно служат для сбора биомассы, содержащейся в пенном слое. Устройства и режим стерилизации определяется конструкцией биореактора, вспомогательного оборудования, используемых питательных сред и т. п. Наибольшее значение имеют термический метод стерилизации оборудования и сред и фильтрационный способ, применяемый для удаления микроорганизмов из подаваемогов ферментеры воздуха или другого газа. Периодический процесс состоит из следующих этапов: 1) стерилизация сред, биореактора и вспомогательного оборудования; 2) загрузка аппарата питательной средой; 3) внесение посевного материала (клеток, спор); 4) рост культуры, который может совпадать во времени со следующим этапом или предшествовать ему; 5) синтез целевого продукта; 6) отделение и очистка готового продукта; 7) мойка биореактора и его подготовка к новому циклу. Этап роста культуры включает все основные фазы роста (см. § 5). Биотехнологически ценные продукты синтезируются в экспоненциальную фазу (нуклеотиды, многие ферменты, витамины) или в стационарную фазу роста (антибиотики, красящие вещества и др.). Впервые изученное В.Н. Шапошниковым ацетонобутиловое брожение является классическим примером переключения культуры с синтеза одного продукта на синтез другого. Продуцент, анаэробная бактерия Clostridium acetobutylicum, образует вначале органические кислоты (в большей степени масляную). Это ведет к постепенному снижению рН среды культивирования. Когда рН достигает порогового значения, клетки бактерии переключаются на синтез нейтральных продуктов – ацетона и бутанола. Аналогичная двухфазность в образовании продуктов характерна для многих других организмов. Периодическое культивирование с подпиткой: в процессе культивирования в аппарат добавляют питательные вещества через определенные промежутки времени порциями или непрерывно «по каплям». Иногда дополнительно вносят биообъект. Отъемно-доливочное (или полунепрерывное)культивирование: часть объема из биореактора время от времени изымается при добавлении эквивалентного объема среды. В результате происходит регулярное омолаживание культуры и задержка ее перехода к фазе отмирания. Непрерывные процессы. В непрерывных процессах биообъект постоянно поддерживается в экспоненциальной фазе роста. Для этого обеспечивается непрерывный приток свежей питательной среды в биореактор и отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Фундаментальным принципом непрерывных процессов служит равновесие между приростом биомассы за счет деления клеток и их убылью в результате разбавления свежей средой. 3.Промышленное производство белка одноклеточных организмов (БОО и БВК). Основные константы при непрырывном культивировании микроорганизмов.Понятие БОО появилось в литературе в 60-х гг. и обозначает инактивированную массу бактерий, дрожжей, грибов, водорослей (БВК - белково-витаминный концентрат). Это высококачественный продукт, т. к. содержание белка может достигать 60% от сухой массы. При этом такой продукт содержит определенное количество углеводов, витаминов, микро- и макроэлементов. Отсутствие посевных площадей. Процесс не зависит от погоды, климата, поддается точному планированию и автоматизации. Получаемые продукты стандартны, возможна утилизация промышленных отходов. Открывателем БОО был Пастер. На солях аммония и органических соединения. Затем стали использовать прессованные дрожжи. Во время I и II Мировой войн, дрожжи использовали как пищевую добавку. В 1935 г. в СССР был открыт 1-й завод по получению БОО из кукурузных кочерыжек. В 60-е гг. начали использовать парафины нефти. Среди бактерий используется ок. 30 видов[4]. Получают путем глубинного культивирования в хемостатах и ферментерах. После проведения полного цикла ферментации белок имеет вид слабоокрашенного порошка, хлопьев. В зависимости от субстрата белок имеет разные названия: Паприн – дрожжи на парафинах нефти; Эприн – дрожжи на этаноле; Меприн – дрожжи на метаноле; Требования к белку: перевариваемость, питательность, экономическая эффективность при получении. В отношении экономической эффективности учитывается доступность сырья. Это означает возможность замены одних субстратов другими. БОО не должны содержать патогенных м/о, канцерогены, токсины, ионы тяжелых Ме. Одной из самых основных характеристик БОО явл. сбалансированность его состава. Для оценки этого показателя СКОР – ВОЗ рекомендует использовать как эталон белок куриного яйца и молока человека. При определении СКОР учитывается содержание незаменимых аминокислот, по отношению к общему содержанию каждого из них. Незаменимая аминокислота, которая встречается в наименьшем количестве называется 1-я незаменимая аминокислота (лимитирующая). Отношение процентного содержания этой аминокислоты в эталонном белке и исследуемом и называется СКОР. Получаемые БОО делят на 3 гр. по возможности использования. Белки технические (используются как добавки в корм пушных зверей, для приготовления микробиологических сред); Кормовые (в с/х); Пищевые – для человека – микопротеин – продуценты грибы рода Fruzarium, выращиваются на глюкозе и аммиаке, как источник C, N. После проведения ферментации культуральная жидкость подвергается вакуумной фильтрации и мицелий который образуется, высушивается и добавляется в пищу. Процессы культивирования разделяют на периодические и непрерывные. При периодическом режиме в культиватор одновременно закладывают все необходимое для роста микроорганизмов (субстраты) и некоторую “затравку” биомассы, после чего популяция микроорганизмов растет и развивается по своим законам. В некоторый момент времени производится изъятие биомассы. Затем процесс повторяется. Таким образом, снятие урожая производится периодически, и каждый раз популяция проходит через все стадии роста. Непрерывные культуры микроорганизмов ‑ это культуры, в которые все время добавляется питательная среды, а часть содержимого, в том числе живые организмы ‑ биомасса ‑ постоянно удаляется. Эти условия имитируют естественные проточные системы. Однако в отличие от естественных систем, условия среды и развития микроорганизмов в установках непрерывного культивирования в лабораториях и на промышленных предприятиях находятся под контролем и могут быть стабилизированы. Это позволяет проводить эксперименты с культурами микроорганизмов по изучению популяционных законов развития видов и их сообществ, наблюдать процессы микроэволюции. Для микроорганизмов, особенно автотрофных бактерий и дрожжей, условия выращивания довольно просты. Их выращивают в жидкой среде, представляющей собой раствор солей и простых органических соединений. Культуру содержат при постоянной температуре и перемешивают, причем из резервуара в нее постоянно поступает стерильная среда. (Рис.1) 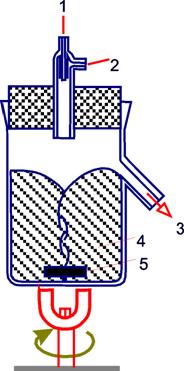 Рис.1. 1 – регулятор 2 – поступление субстрата, 3 – отток (вымывание) смеси субстрата и биомассы, 4 – культура внутри культиватора, 5 – мешалка При построении моделей в микробиологии в качестве равноправных переменных используют как концентрации микроорганихзмов, так и концентрации различных растворимых органических и неорганических веществ: субстратов, ферментов, продуктов. В микробиологии общепринят эмпирический подход к построению моделей. Из всех факторов, влияющих на рост клетки, выбирают лимитирующий, и опытным путем находят зависимость скорости роста от его концентрации. Особый класс составляют задачи, где в процессе роста происходит смена лимитирования. В общем виде кинетика концентрации клеток в непрерывной культуре описывается уравнением: Здесь x – концентрация клеток в культиваторе; µ ‑ функция, описывающая размножение популяции. Она может зависеть от концентрации клеток x, концентрации субстрата (обычно обозначается S), температуры, рН среды и прочих факторов; n - скорость вымывания. Без учета вымывания клеток рост биомассы описывается уравнением: При неограниченных ресурсах питательных веществ величина µпостоянна, и уравнение (2) описывает экспоненциальный рост популяции клеток. Если же какие-либо причины начинают лимитировать рост, величина µ будет уменьшаться. Для микробиологических систем обычно величина, лимитирующая рост, это ‑ концентрация субстрата. Наиболее распространенная форма записи, учитывающая насыщение скорости роста культуры по питательному субстрату, предложена Моно: Здесь mm -максимальная скорость роста микроорганизмов при данных условиях; KS- константа, численно равная концентрации субстрата, при которой скорость роста культуры равна половине максимальной. График функции величины скорости роста от концентрации субстрата приведен на рис. 2 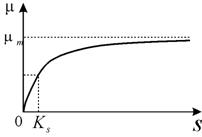
Вид уравнения Моно аналогичен формуле Михаэлиса-Ментен из ферментативной кинетики. И это не только формальное сходство. В основе жизнедеятельности любой клетки лежат ферментативные процессы. Скорость роста биомассы в конечном счете определяется скоростью переработки лимитирующего субстрата ферментом узкого места в метаболической сети. Пусть концентрация фермента на единицу биомассы равна E0. Тогда по закону Михаэлиса, скорость переработки субстрата единицей биомассы определяется формулой: Здесь Km- константа Михаэлиса,k - константа скорости реакции. Вся биомасса концентрации x обладает количеством фермента E0x, Следовательно, суммарная скорость убыли субстрата равна 4. Производство кормовых липидов.Основной источник незаменимых жирных кислот для сельскохозяйственных животных – различные растительные продукты, входящие в состав кормов. Однако в растительных кормах содержится мало липидов или они имеют неблагоприятный состав жирных кислот, что ухудшает питательную ценность кормов. В целях балансирования кормовых рационов сельскохозяйственных животных по содержанию незаменимых жирных кислот осуществляется поиск новых источников биологически полноценных липидов, которые можно было бы использовать в качестве высококонцентрированных кормовых добавок. Наиболее перспективными промышленными продуцентами липидов, близкими по составу к растительным жирам и пригодными для использования в кормовых целях, являются дрожжи и микроскопические грибы, которые накапливают внутриклеточные липиды. Однако известны виды, способные выделять липиды в культуральную жидкость. В клетках этих микроорганизмов обычно содержится от 25 до 70% липидов в расчёте на сухую массу, которые на 40-90% представлены триацилглицеринами и на 5-50% - фосфолипидами. В них также содержится много стероидных веществ (до 1-1,5% на сухую массу), представленных главным образом эргостерином, из которого в организме животных образуется витамин D2. Много липидов (50-60% от сухой массы) способны накапливать некоторые штаммы дрожжей Phodotorula, Lipomyces.Клетки дрожжей рода Candida синтезируют меньше липидов (20-40%), однако отличаются высокой скоростью роста и способностью хорошо утилизировать разнообразные источники сырья. Микроскопические грибы могут синтезировать до 40-50% высокоценных липидов, сходных по составу жирных кислот с растительными Из-за образования в клетках микроорганизмов активных комплексов гидролитических ферментов они способны утилизировать в качестве источников углерода различные субстраты – гидролизаты растительных отходов, послеспиртовую барду, молочную сыворотку, мелассу, отходы зерноперерабатывающей промышленности и др[1]. В качестве источника азота в питательную среду добавляют дрожжевой или кукурузный экстракт, соли аммония, мочевину, но при этом строго контролируют соотношение углерода и азота, так как при избытке азота снижается образование липидов в клетках микроорганизмов. Этапы технологии производства липидов на питательной среде включает: 1.Начальный период интенсивного роста микроорганизмов и сравнительно небольшое накопление липидов; 2.Усиление синтеза липидов в начале стационарной фазы развития микроорганизмов; 3.При выращивании продуцентов кормовых липидов поддерживается температура 20-30°С, так как при более высокой температуре снижается выход липидов, а в липидах уменьшается доля полиненасыщенных жирных кислот; 4.В процессе ферментации требуется поддерживать режим интенсивной аэрации, так как для окисления углеродных субстратов необходим кислород. Он также необходим для синтеза ненасыщенных жирных кислот, поэтому улучшение аэрации стимулирует увеличение выхода незаменимых жирных кислот; 5.По окончании ферментации микробная масса отделяется от остатков субстрата и высушивается по такой же технологии, как кормовые дрожжи. Для улучшения физических свойств к высушенному продукту добавляют отруби или кукурузную муку. 5. Охарактеризовать действие комплексных ферментных аппаратов, применяемых на стадиях осахаривания и брожения при производстве этилового спирта.Производство спирта основано на конверсии сбраживаемых органических соединений в этанол с помощью культур дрожжей, реже- грибов и бактерий. В России. этанол производится из зернового сырья и картофеля, а в качестве возбудителей брожения используются дрожжи- сахаромицeты. Для того чтобы увеличить выход спирта, следует решить две задачи: первая- полностью гидролизовать крахмал и некрахмальные полисахариды в сбраживаемые сахара; вторая - обеспечить дрожжи питательными элементами, необходимыми для быстрого размножения и синтеза ферментов. Осахаривание крахмала осуществляют использованием солода и микробных ферментных препаратов - б -амилазы и глюкоaмилазы. Применение a-aмилазы на стадиях разваривания и осахаривания позволяет снизить вязкость замесов, достичь высокой полноты клейстеризации крахмальных гранул, предотвратить ретpадацию крахмала, препятствующую его осахариванию. Для разжижения крахмала целесообразно применять препараты термостабильной а-амилазы, которые выделяют из культуры В. licheniforms (импортные-«Термамил», «Така-Терм», «Зимаджунт», отечественный -«Амиололихeтерм»). Различные штаммы бактерии licheniformis продуцируют амилазу с оптимумом действия в интервале от 76 до 95 °С . В средах с высокой концентрацией крахмала, в присутствии микродобавок соли СаCl2, «Термамил» стабилен в течение 3 ч при 100 °С. С помощью термостабильных амилaз можно осуществлять непрерывный процесс клейстеризации-расположения вплоть до температуры полной желатинизации крахмальных гранул. Совмещение разжижения и разваривания существенно повышает эффективность процесса. Непрерывный гидрoлиз клейстеризующегося крахмала, переход продуктов реакции в раствор способствуют более быстрому набуханию крахмала во внутренних областях частиц сырья. За счет этого может быть сокращена продолжительность процесса, а его максимальная температура понижена до 110-1150С(температуры полной желатинизации крахмальных гранул). Использование термостабильной амилазы существенно снижает расход фермента на единицу сырья. При замене «Амилoсубтилина ГЗx» на «Амилолихeтерм гЗx» дозировку амилазы можно уменьшить в 1,5 раза без снижения выхода спирта. Оптимальная доза «Амилолихeтерма» составила 1 ед./г крахмала: 03-- на стадии разжижения и 0.7- на стадии осахаривания (в сочетании с 6 ед./г глюкоaмлазы). Оптимальная доза «Амилосубтилина»- 1,5 ед./r крахмала (соответственно по стадиям 0.5 и 1,0 ед./г). Ферментные препараты с относительно низкой оптимальной температурой действия целесообразно использовать на стадии осахаривания. Это относится к препаратам с основной активностью a-aмилазы (Aмилoсубтилин», «Амиолоризин, солод) и препаратам rпокоaмилазы. Амилолитический комплекс солода и грибная а-aмилаза более глубоко расщепляют крахмал, чем бактериальнaя а-амилаза, но полное осахаривание достигается только с помощью rлюкоaмилазы. Применение микробной глюкоaмилазы увеличивает степень сбраживания на13-15% по сравнению с вариантом осахаривания солодом. В качестве препаратов глюкоaмилазы обычно применяют «Глюкавaморин Гх» или «Амилоглюкаваморин Гх»- культуральную жидкость гриба Asp. awamori. получаемую в ферментных цехах сnиртзаводов. Onтимум действия «Глюкаваморина» (pH 4-5.5) соответствует активной кислотности бражки (pH 4,2-5,2). Это важно, поскольку на стадии осахаривания сырья, в закрытой системе, где из сферы реакции не выводится глюкоза, процесс гидролиза крахмала проходит неполностью. Он продолжается в процессе брожения, по мере потребления глюкозы дрожжами, что сдвигает равновесие реакции гидролиза, катализируемой амилазой. Общая продолжительность брожения зависит от дозировки глюкоaмилазы: продолжительность при 6 ед./г крахмала сырья брожение длится 72 при повышении дозы до 15 ед./г крахмала процесс заканчивается за 48 ч. Применение микробной глюкоaмилазы дает возможность использовать солод того же вида зерна, что и в сырье (хотя это не допускается регламентом). Это показано в производственных опытах, проведенных на двух спиртзаводах, где осахаривание ячменного замеса проводили ячменным солодом и «глюкавамopином гх» (7,5% солода и 5 ед. rпокоамилaзы/г крахмала или 5% солода и 4 ед. глюкоaмилазы/r крахмала). При осахаривании зерновых замесов сочетанием солода и глюкоaмилазы соотношение этих компонентов влияет на органолептические свойства конечного продукта. Из 30% ячменя и 70% пшеницы, разваренной при 142-145 °С, спирт смеси наилучшего качества будет получен при осахаривании 7,5% ячменного солода (в виде солодового молока) и «Глюкавамopина гх» в дозе гюкоaмилазы 3 ед/r крахмала. Для замеса из ячменя оптимальный состав oсахаривающей смеси - 5% солода и 4 ед гюкоaмилазы/г крахмала. В опытах использовали солод с активностью a-aмилазы 25-30 ед/r по капельному методу. Принимая во внимание колебания активности солода и качества сырья, необходимo проводить контрольные опыты по выбору наилучших осахаривающих композиций. При приготовлении сусла в аппаратах гидродинамической обработки замесы нагревают лишь до 75-95 оC, что позволяет сохранить в недеградированном состоянии моносахара, аминокислоты, пептиды, органические кислоты, витамины и некоторую часть ферментативной активности. При низкотемпературной обработке замеса крахмал не может быть полностью клейстeризован, часть еrо остается «сырым». В этих условиях необходимо использовать ферментативные комплексы, способные воздействовать на сырой крахмал. а-Амилаза некоторых штаммов В. subtilis гидролизует сырой крахмал на 28- 39%, в зависимости от источника крахмала. В сочетании с пюкoамиaзoй такая a-aмилаза гидролизует неклейстеризованный картофельный крахмал на 95%. Целесообразно исследовать осахаривающую способность комплексов a-амилазы и глюкоaмилазы из различных источников в отношении сырого крахмала, для реализации в низкотемпературной технологии спирта. Существенным резервом сбраживаемых углеводов являются некрахмальные полисахариды --uеллюлоза, B-1,3-1,4-rлюкан, кcилоглюкан и другие разновидности гемицеллюлоз, в состав которых входит глюкоза. За счет сбраживания глюкозы некрахмальных полисахаридов выход спирта из зернового сырья может быть повышен на 10-12%. Гидролиз целлюлозы и гемицеллюлоз не только дает непосредственно сбраживаемую глюкозу, но и повышает доступность крахмала ферментативному гидролизу. Особено важно гидролизовать В-1,3-1,4-глюкан - существенный элемент клеточных стенок эндосперма злаков (у ячменя и овса глюкан составляет 75% массы клеточных стенок эндосперма). В свою очередь, гидролиз крахмала повышает доступность целлюлозы, и в присутствии амилолитических ферментов степень расщепления целюлозы несколько повышается. Поэтому цитолитические ферментативные препараты целесообразно применять на стадии осахаривания замесов, совместно с a-aмилазой и глюкоaмилазой. При испытании способности отечественных ферментных пpenаратов гидролизовать целлюлозу и reмицеллюлозу фракций зерна установили, что оптимальная дозировка целлюлазы составляет 14-16 ед/r субстрата, rидролиз при 60 оС заканчивается за 2-4 ч расщеплением около 50% целлюлозы. Эффекты, даже для фракции крупного помола, невелики, но в технологии спирта, достигшей определенной стабильности показателей, они значительны. при различной абсолютной крахмалистости фракций выход спирта на единицу крахмала во всех вариантах практически одинаков -62,5-65,3 мл/100 г крахмала. Существенного повышения выхода, которое можно было ожидать в крупной и средней фракциях за счет гидролиза некрахмальных полисахаридов, не произошло. Это свидетельствует о неполном гидролизе фракций целлюлозы и гемицеллюлозы. При обработке целлюлозoсодержащей фракции ячменя выход сnирта увеличился на 38-67%, пшеницы на 23% (контролем служили те же фракции зерна, обработанные без добавки цитолитических ферментов). Максимальный выход спирта в первом случае получен с «Ксилoглюканофоeтидином», во втором - с «Целлофторином». Более низкий эффект при обработке грубой фракции пшеницы объясняется тем, что в стенках эндосперма этого злака преобладает не глюкан, а арабиноглюкуроноксилан, расщепление которого дает незначительное количество сбраживаемых углеводов. Кроме того, в варианте ячменного сырья эффект обусловлен не только непосредственным увеличением количества сбраживаемых сахаров, но и снижением вязкости сусла и, соответственно, интенсификацией всех массообменных процессов, связанных с жизнедеятельностью дрожжей и продолжающимся в ходе брожения гидролизом полимерных субстратов. При сбраживании сырья с высоким содержанием В-гюканов (ржи, ячменя) рекомендуют применять препараты В-глюкaназы не только для осахаривания, но и для разжижения замеса, при общем расходе в смесителе и осахаривателе от 3 до 6 ед. В-rлюканазы/r сырья. Интенсивное сбраживание сырья дрожжами возможно лишь при создании условий для их активного размножения. Лимитирующим фактором роста на гидролизатах сырья, полученных с применением ферментов карбогидразного действия, является низкое содержание свободных аминокислот. С целью обогащения сусла аминокислотами используют ферментные препараты грибного происхождения, имеющие высокую экзопeптидазную активность. Ферментативный комплекс препаратов из культур различных штаммов Asp. oryzaе («Проторизин», «Амилоpизин», «Амилoпроторизин) включает, наряду с эндопептидазами (сериновой каробоксильной и металлопротеиназой), экзопemтидазы- лейцинаминопeптидaзу и карбоксипептидазу. Этот комплекс обеспечивает более глубокий гидролиз белка, чем комплекс бактериального препарата «Протосубтилина», основная активность которого определяется металопротеиназой . При обработке осахаренного сусла и ячменной болтушки пpeпаратами грибного и бактериального происхождения, при дозировке этих препаратов по протеолитической активности 5 ед./г белка, очевидно преимущество грибных препаратов. Наиболее полно расщепляется белок в картофельном сусле: при действии грибных препаратов на 75,7-85,7%, при действии «Протосубтилина» 47,7%. В ячменном сусле доля свободнных аминокислот от их суммы составила соответственно 5.3-7 и 3,9%. Прирост свободных аминокислот происходит в основном за счет глутаминовой, аспарагиновой кислот и пролина. Обработка пшеничного замеса на стадии осахаривания амилолитическими ферментами совместно с «Проторизином Г10х» (5 ед./г белка) увеличивает накопление биомассы дрожжей в 2 раза, сокращая продолжительность главного брожения с 32-36 ч до 18-20 ч, а продолжительность дображивания- с 36-42 ч, до 20-24 ч. Интенсивное сбраживание сахаров сопровождается повышением степени гидролиза крахмала глюкоaмилазой. Наличие в среде свободных аминокислот, их прямое в включение в клетки дрожжей снижает затраты глюкозы на энерrетический и конструктивный метаболизм. Более экономичное использование глюкозы увеличивает выход спирта на 2,8 %. Параллельно снижается количество побочных продуктов брожения на 19%, а в пересчете на клетку - в 2,4 раза. При дозировке глюкоaмилазы 6 eд/г крахмала и протеазы 1 крахмала (или 5 ед./г белка) брожение заканчивалось за 42-46 ч, при повышении дозировок соответственно до 15 и 1,6 ед./г крахмала продолжительность брожения сокращалась до 28 ч. Дрожжи, выращенные на среде с богатым азотистым питанием, имеют повышенную осмофильность и толерантность к продуктам брожения, что позволяет сбраживать за 72 ч сусло с содержанием СВ 22% вместо обычных 16%, получая соответствующие технологические показатели. Крахмалсодержанее сырье является основным в производстве этанола. Наряду с ним могут использоваться другие виды углеводного сырья. Некоторые виды дрожжей родов Candida и Kluwerоmyces обладают способностью сбраживать лактозу в этанол, что связано наличием В-галактозидазной активности. При исследовании способности различных штаммов этих родов дрожжей к образованию этанола при ферментации на молочной сыворотке выбран штамм К. marxianus var lactis SK. Перспективным видом сырья, способным в значительной мере заменить крахмалсодержащее сырье, является целлюлоза. В настоящее время целлюлозо-содержащее сырье используют для выработки технического этанола (знергоносителя). Сырьем для получения этанола может служить измельченная древесина быстрорастущих пород деревьев (тополя, осины, ивы и др.), обработанная методом парового взрыва. Паровой взрыв- это кратковременное (1-10 мин) выдерживание увлажненного сырья, пропитанного сернистым газом, при температуре от 120 до 250 °С, с последующим резким сбросом давления. Результатом кратковременного гидролиза в кислой среде и механического разрушения при сбросе давления становится дезацетилирование и расщcпление гемицеллюлоз, переходящих в раствор, выплавление части лигнина и ослабление лигноуглеводных связей. Взорванная лигнoцеллюлоза имеет развитую поверхность и хорошо гидролизуется. Препятствуют сбраживанию гидрoлизатов побочные продукты деструкции древес (ацетат, фурфурол и его производные, n-оксибензойная кислота и др.), которые могут быть удалены промыванием сырья горячей водой. Разваривание зерна происходит с целью разрушения их клеточных стенок. В результате этого крахмал высвобождается и переходит в растворимую форму. В таком состоянии он намного легче осахаривается ферментами. Зерно обрабатывается паром при избыточном давлении 500 кПа. Когда разваренная масса выходит из варочного аппарата, сниженное давление приводит к образованию пара (из содержащейся в клетках воды). Подобное увеличение в объеме разрывает клеточные стенки и превращает зерно в однородную массу. На сегодняшний день разваривание крахмалосодержащего сырья производят одним из трех способов: периодическим, полунепрерывным или непрерывным. Наибольшую популярность получил непрерывный метод. Температура разваривания составляет 172°С, а продолжительность варки около 4 минут. Для получения более качественного результата исходное сырье рекомендуется измельчать. Сам процесс разваривания включает операции: · Строгая дозировка зерна и воды; · Нагрев замеса до температуры варения; · Выдержка массы при заданной температуре. Измельченное зерно следует смешать с водой в количестве 3 литра на 1 кг. зерна. Зерновой замес нагревается паром (75°С) и подается насосом в контактное отверстие установки. Именно здесь происходит мгновенный нагрев кашицы до температуры 100°С. После этого подогретый замес помещается в варочный аппарат. В процессе осахаривания в охлажденную массу добавляют солодовое молоко для расщепления крахмала. Активное химическое взаимодействие приводит к тому, что продукт становится абсолютно пригодным для дальнейшего процесса сбраживания. В результате получается сусло, которое содержит 18% сухого сахара с кислотностью 0,3 град. Когда из массы делается проба на йод, то окрас сусла должен оставаться неизменным. Сбраживание сусла начинается при введении в осахаренную массу производственных дрожжей. Мальтоза расщепляется до глюкозы, которая в свою очередь сбраживается в спирт и диоксид углерода. Также начинают образовываться вторичные продукты брожения (эфирные кислоты и т.д.). Данный процесс должен проходить в закрытой бродильной установке, которая предотвратит потери спирта и выделение диоксида углерода в производственный цех. Выделяющийся в процессе брожения диоксид углерода и пары спирта из бродильной установки поступают в специальные отсеки, где происходит отделение водно-спиртовой жидкости и диоксида углерода. Содержание этилового спирта в бражке должно равняться до 9,5 об.%. Далее приступают к отгонке спирта из бражки и его ректификации. Спирт начинает выделяться из бражки в результате кипения при разных температурах. Сам механизм перегонки основан на следующей закономерности: спирту и воде свойственны разные температуры кипения (вода - 100 градусов, спирт - 78°С). Выделенный пар начинает конденсироваться и собираться в отдельную емкость. Очистку спирта от примесей производят на ректификационной установке[5]. Подогревание браги до 90°С пары начинают подниматься по колоне в конденсатор, где они полностью охлаждаются. После этого чистый спирт поступает в специализированную колонну, имея крепость 50-55 об.% Производство этилового спирта из этилена растет с каждым годом и в настоящее время достигло больших масштабов. Синтетический спирт значительно дешевле спирта, полученного из пищевого сырья. Производство этилового спирта путем сернокислотной гидратации началось лишь после 1930 г. В Советском Союзе исследования в области промышленного применения этого способа производились М. А. Далиным с сотрудниками, и в 1936 г. в Баку была построена первая установка для производства этилового спирта из этилена нефтезаводских газов. Производство этилового спирта путем прямой гидратации этилена, полученного при пиролизе этана, должно быть предусмотрено дальнейшим развитием химической промышленности в Грозном. Список использованных источников1. Баракова Н.В. Анализ сырья, приготовление осахаренного сусла, зрелой бражки и этилового спирта: Учеб.-метод. пособие. – СПб.: НИУ ИТМО, 2013. – 37 с. 2. Егорова Т.А., Клунова С.М., Живухина Е.А. Основы битехнологии, М.: Академия, 2005, 208 с. 3. Кафаров В. В., Винаров А. Ю., Гордеев Л. С. Моделирование и системный анализ биохимических производств.—М.: Леей, нром-сть, 1985.— 280 с. 4. Математическое моделирование микробиологических процессов [Текст] : [Сборник статей] / Редколлегия: проф. А. М. Безбородов (отв. ред.) [и др.] ; АН СССР. Науч. центр биол. исследований. Ин-т биохимии и физиологии микроорганизмов. - Пущино-на-Оке : [б. и.], 1973. - 271 с 5. Рогов И.А. Пищевая биотехнология. Кн.1: Основы пищевой биотехнологии: учебник / И.А.Рогов, Л.В.Антипова, Г.П.Шуваева. - М.: КолосС, 2004. - 439 с |
