2 модуль биохимия. бх 2 модуль. 1. Что такое ферменты и какую роль они выполняют в организме
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
|
3. Напишите формулу кофермента дегидрогеназ, в состав которых входит витамин ниацин 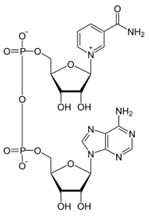 НАД НАД4.Каково количество комплексов тканевого дыхания и где они локализованы? I комплекс (НАДН-КоQН2-редуктаза) – принимает электроны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов. II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2. Убихинон легко перемещается по мембране и передает электроны на III комплекс. III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД (цепь тканевого дыхания). IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи. Существует 2 разновидности ЦТД: Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса. На картинке: схема строения дыхательной цепи во внутренней мембране митохондрий человека 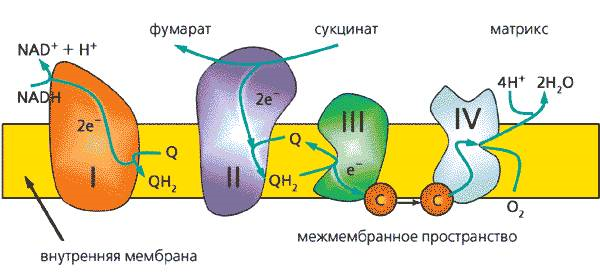 5. Что такое активаторы и ингибиторы ферментов? Приведите примеры этих веществ для альфа-амилазы слюны. Ингибиторы – соединения, тормозящие каталитический процесс, активаторы – вещества, которые этот процесс ускоряют. Активаторами альфа-амилазы являются катионы кальция и анионы хлора. Ингибитор-метформин?? Билет № 7 1.Зависимость активации ферментов от среды. рН среды а-амилазы. 2.четвертая структура ферментов.Тип катализирующей реакции. 3.Ферменты и витамины. написать формулу ФМН. Какой витамин входит в ФМН. 4.Цитохромы в ОВР. 5.Качественные определения активации ферментов. 1. Почему активность ферментов зависит от реакции среды? Укажите оптимальное значение рН среды для действия альфа-амилазы слюны и в каком опыте это можно видеть. опыт5.1.5 2 .Четвертый класс ферментов и реакции, которые они катализируют. Лиазы - отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей (C—C, C—O, C—N, C—S и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур. 3.Какова связь между ферментами и витаминами? Напишите формулу ФМН и укажите, какой витамин входит в её состав. Витамины или же их метаболиты играют роль коферментов. Коферменты являются производным витаминов,поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов. Витамин:рибофлавин. 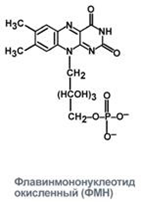 4. Какую роль в окислительно-восстановительных процессах выполняют катализаторы цитохромной системы?(вероятно) -В их составе (в составе гема) ,атом железа служит переносчиком электронов ,получая их от одного вещества и передавая другим( при этом железо попеременно становится 2х или 3хвалентным) 5. Каков принцип качественного определения активности ферментов? Рекомендовано измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающейконцентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента. Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярнойактивности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессереакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярнойактивностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента). Одна молекула каталазы эритроцитовспособна, например, расщепить в 1 с 44000 молекул перекиси водорода. 8 билет. 1.Зависимость активности ферментов от температуры. Примеры. 2.5 класс ферментов. Какие реакции катализирует. 3.Связь между ферментами и витаминами. Какой витамин входит в ФАД. 4.Убихинон. Функции и строение. 5.Какие принципы определения активности ферментов. 1.Зависимость активности фермента от температуры среды. Приведите примеры. При повышении температуры на каждые 10 градусов ,скорость увеличивается примерно вдвое( правила Вант-Гоффа) Однако для ферментативной реакции это правило справедливо лишь в области низких температур -до 50-60 градусов.При более высоких температурах ускоряется денатурация фермента,что означает уменьшение его количества ;соответственно снижается и скорость реакции. При 80-90°С большинство ферментов денатурируются практически мгновенно.Количественное определение ферментов рекомендуется проводить при 25°С 2. Пятый класс ферментов и реакции, которые они катализируют. Изомеразы - ферменты, катализирующие структурные превращения изомеров. Могут катализировать внутримолекулярные ОВР, осуществляя взаимные превращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы. Являются сложными ферментами. К их коферментам относятся пиридоксалевые,дезоксиаденозинкобаламин,пептидныегруппы,фосфаты моносахаридов и др 3.Какова связь между ферментами и витаминами? Напишите формулу ФАД и укажите, какой витамин входит в её состав. Витамины или же их метаболиты играют роль коферментов.например,коферментом фермента карбоксилазы является витамин тиаминпирофосфат. Коферменты являются производным витаминов,поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов. В состав фада входит витамин в2(рибофлавин) 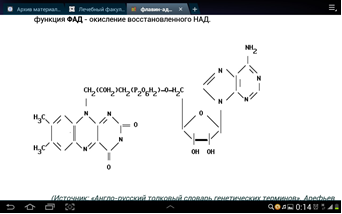 4Каково строение и функции КоQ (убихинона)? 1)перенос электронов через мембрану митохондрий(самая основная функция) 2)участвует в овр организма в качестве кофермента,а также играет важную роль в процессах энергообразования в организме 3)нормализует уровень холестерина,влияет на липидный обмен 4)поддерживает работу скелетной мускулатуры,участвует в процессах сокращения сердечной мышцы 5)способствует образованию эритроцитов;необходим для развития эмбриона 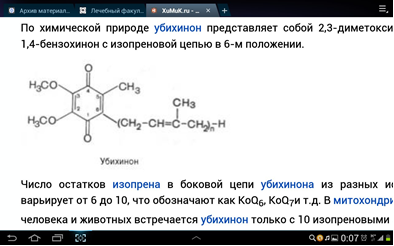 5.Принципы качественного и количественного определения ферментов. Определение количественного содержания ферментов в биологических объектах представляет известные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции в определенных, согласованных условиях измерения. При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом скорость катализируемой реакции пропорциональна концентрации фермента. О скорости ферментативнойреакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции. Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин). В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат. Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающейконцентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента. Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярнойактивности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессереакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярнойактивностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента). Одна молекула каталазы эритроцитовспособна, например, расщепить в 1 с 44000 молекул перекиси водорода. 9 билет 1) зависимость активности фермента от его конц-ии и конц-ии субстрата 2) изоферменты, примеры 3) формула над, витамин в над, связь между витаминами и ферментами 4) схема комплексов тканевого дыхания 5) принцип количеств.определения активности амилазы и в чем выражается 1.Зависимость активности фермента от его концентрации и концентрации субстрата. При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается. Зависимость от концентрации фермента При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта. 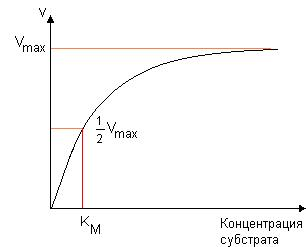 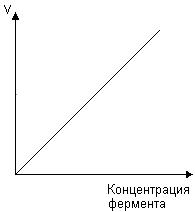 2.Дайте определение изоферментам и приведите примеры. Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Примеры изоферментов: глюкокиназа и гексокиназа. 3. Какова связь между ферментами и витаминами? Напишите формулу НАД и укажите, какой витамин входит в её состав. Витамины или же их метаболиты играют роль коферментов.например,коферментом фермента карбоксилазы является витамин тиаминпирофосфат. Коферменты являются производным витаминов,поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов.  Витамин РР (никотиновая кислота) Витамин РР (никотиновая кислота)4. Дайте схему расположения комплексов тканевого дыхания.  5.Что лежит в основе количественного определения активности альфа-амилазы слюны по Вольгемуту и в чем она выражается? Вольгемута метод — определение активности амилазы (диастазы) в биологических жидкостях (слюне, моче, крови и др.). Активность фермента измеряется амилазными единицами, т. е. числом миллилитров 0,1% раствора крахмала, расщепленного в течение 30 мин. при t° 45 9 1 мл исследуемого раствора. Например, в норме активность амилазы в моче равна 16—64. Повышенные значения наблюдаются при панкреатите, заболеваниях желчных путей и др., пониженные значения вплоть до нуля — при почечной недостаточности 10 билет 1. кинетика ферм реакций.константа михаэлиса 2. активатор и ингибитор. аллостерический тип регуляции. пример 3. окисл и восстан формы ФАД 4. судьба протонов и электронов, вышедших из матрикса в межмембранное пространство 5. принцип количественного определения активности каталазы. единица измерения 1.Кинетика ферментативных реакций. Чему равна численная величина константы Михаэлиса? Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента. Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени: V= D[S]/t = D[P]/t. Ферментативный процесс можно выразить следующим уравнением:  где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции. Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm. В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. 2.Активаторы и ингибиторы активности ферментов. Аллостерическая регуляция активности ферментов. Приведите примеры. Вещества, которые оказывают влияние на активность ферментов, называют эффекторами. Это могут быть ингибиторы – соединения, тормозящие каталитический процесс, или активаторы – вещества, которые этот процесс ускоряют. Например, ингибиторы амилаз успешно применяются для лечения заболеваний, связанных с повышенной активностью этих ферментов – диабета, ожирения, кариеса. Используемые в военном деле нервно-паралитические газы представляют собой специфические ингибиторы ферментов. Аллостерическая регуляция Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором. Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах. Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную.Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата. |
