коллоквиум по биохимии, 2 курс. 1. Цикл лимонной кислотыцентральный процесс энергетического обмена. Регулирование скорости цикла лимонной кислоты
 Скачать 109.65 Kb. Скачать 109.65 Kb.
|
часть глюкозы также превращается в жиры. Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
В первом и во втором случае жиры в составе липопротеинов гидролизуются ЛП—липазой и в клетку поступают жирные кислоты, которые затем используются для синтеза ТАГ. Перед включением в ТАГ жирные кислоты сначала активируются путем образования тиоэфиров кофермента А, а затем взаимодействуют с глицеролфосфатом. Так как глицерол не может быть фосфорилирован в адипоцитах (в этих клетках отсутствует глицеролкиназа), то глицеролфосфат образуется при восстановлении диоксиацетонфосфата. Следовательно, синтез ТАГ может протекать только в присутствии глюкозы, из которой в процессе гликолиза образуется диаксиацетонфосфат. Инсулин стимулирует синтез ТАГ, потому что в его присутствии повышается проницаемость мембран клеток жировой ткани для глюкозы. Мобилизацию (липолиз) депонированных ТАГ катализирует тканевая липаза. В результате жиры распадаются на глицерин и свободные жирные килоты. Адреналин и глюкагон активируют внутриклеточную липазу. Действие этих гормонов опосредовано аденилатциклазным каскадом реакций, начиная с активации аденилатциклазы и заканчивая фосфорилированием липазы, которая при этом переходит в активную форму и расщепляет эфирные связи в ТАГ. Глицерол как растворимое в плазме вещество транспортируется в печень, где используется в реакциях глюконеогенеза. Жирные кислоты транспортируются кровью в виде комплексов с сывороточными альбуминами в разные органы и ткани, где включаются в процесс окисления. Окисление жирных кислот Окисление жирных кислот состоит из двух этапов:
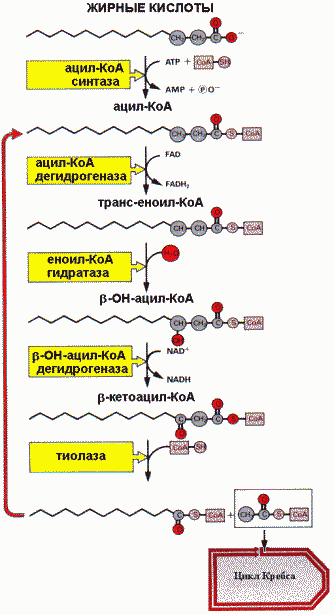
Оба этапа сопряжены с дыхательной цепью. B —окисление происходит в митохондриях клетки, а жирная кислота поступает из кровотока в цитозоль, где активируется путем конденсации с коферментом А, образуя тиоэфир.
Для того чтобы пройти через митохондриальную мембрану, жирной кислоте необходим специальный переносчик — карнитин. Поэтому сначала ацильная группа переносится с ацил—СоА на карнитин. Ацил—карнитин пересекает мембрану и отдает свой ацильный фрагмент снова на кофермент А. Ферментом этой обратимой реакции служит ацил—карнитинтрансфераза. Результатом четырех последующих реакций b —окисления является отщепление двухуглеродного фрагмента и перенос его на кофермент А с образованием ацетил—СоА, который затем может включаться в цитратный цикл для полного окисления. Укороченная ацильная цепь вторично входит в цикл b —окисления. Конечным итогом повторяющихся циклов b —окисления будет окисление всей ацильной цепи до ацетил—СоА. Энергетика окисления жирных кислот За один цикл b —окисления образуется 1 молекула ацетил—СоА, окисление которого в цитратном цикле обеспечивает синтез 12 моль АТР. Кроме того, образуется 1 моль FADH2 и 1 моль NADH, при окислении которых в дыхательной цепи синтезируется соответственно 2 и 3 моль АТР (в сумме 5). Таким образом, при окислении, например, пальмитиновой кислоты (С16) происходит 7 циклов b —окисления, в результате которых образуется 8 моль ацетил—СоА, 7 моль FADH2 и 7 моль NADH+Н+. Следовательно, выход АТР составляет 35 АТР в результате b —окисления и 96 АТР в результате цитратного цикла, что соответствует в сумме 131 моль АТР. Образование кетоновых тел в печени (кетогенез) b —окисление жирных кислот в печени ведет к образованию восстановленных коферментов, которые используются для энергетических нужд клеток печени. Основным путем дальнейшего использования ацетил—СоА, образованного при b—окислении в печени, является синтез кетоновых тел, который происходит следующим образом: двухуглеродные молекулы конденсируются друг с другом с образованием в дальнейших реакциях ацетоацетата и b —гидроксибутирата. Эти две кислоты называются кетоновыми телами. Кетоновые тела диффундируют в кровь и используются внепеченочными тканями в качестве источников энергии. В норме концентрация кетоновых тел в крови 2 мг/дл. Ферменты, катализирующие синтез кетоновых тел, находятся в митохондриях. В определенных метаболических условиях, когда в печени происходит интенсивное окисление жирных кислот, образуется значительное количество кетоновых тел. Это происходит в состояниях, связанных с затруднениями в использовании углеводов, когда основным источником энергии для организма являются жирные кислоты (длительная мышечная работа, голодание, сахарный диабет). Скорость синтеза кетоновых тел может превышать потребление их тканями и вести к накоплению. Значительное увеличение концентрации кетоновых тел создает опасную ситуацию, которую называют кетоацидозом (кетозом). При патологическом кетоацидозе ацетоацетат неферментативно декарбоксилируется, что сопровождается образованием ацетона, поэтому для кетоза характерен запах ацетона в выдыхаемом воздухе. Биосинтез жирных кислот Процесс осуществляется в различных частях клетки. В цитоплазме синтезируются насыщенные жирные кислоты с углеродной цепью до С16 (пальмитат). В митохондриях происходит дальнейшее наращивание цепи, а в ретикулуме насыщенные жирные кислоты превращаются в ненасыщенные, и также происходит удлинение цепи. Основным продуктом системы синтеза, содержащимся в цитозоле, является пальмитиновая кислота. Субстратом для синтеза жирной кислоты служит ацетил—СоА, образующийся из глюкозы в результате окисления пирувата. Использование пирувата в синтезе пальмитата включает следующие метаболические пути: окисление глюкозы в процессе гликолиза до пирувата в цитозоле, затем окислительное декарбоксилирование пирувата в митохондриях и последующая конденсация ацетил—СоА с оксалоацетатом с образованием цитрата. Далее цитрат перемещается в цитозоль, где распадается на ацетил—СоА и оксалоацетат. Первая реакцияв биосинтезе жирной кислоты — это карбоксилирование ацетил—СоА и превращение его в малонил—СоА. Реакция катализируется ацетил—СоА—карбоксилазой, коферментом которой является биотин. Затем следуют повторяющиеся циклы из шести реакций. Катализирует весь процесс пальмитилсинтетаза — полифункциональный белок — фермент, имеющий одну полипептидную цепь, упакованную в два домена. Оба домена имеют в своем составе активные центры, способные поочередно катализировать реакции каждого цикла. Ацильные группы связываются с одним из доменов, содержащим пантотеновую кислоту, а малонильные — с остатком цистеина другого домена. После инициации процесса путем реакции конденсации с образованием b —кетоацил—фермента, растущая цепь жирной кислоты удерживается тиоэфирной связью с одним из доменов пальмитилсинтетазы. Ковалентно связанный субстрат поочередно попадает в активные центры фермента, где подвергается соответствующим превращениям. Очередной цикл синтеза начинается с присоединения новой молекулы малонил—СоА к одной из SH—групп активных центров доменов. Каждый цикл из шести реакций увеличивает длину цепи на два углеродных атома. Когда цепь достигает длины 16 углеродных атомов, тиоэфирная связь гидролизуется и пальмитат освобождается. Необходимый для восстановительных реакций NADPHобразуется при окислении глюкозы по пентозофосфатному пути. Большинство жирных кислот имеют более длинную, чем пальмитат, углеводородную цепь, которая может содержать ненасыщенные связи. Следовательно, биосинтез большинства жирных кислот требует участия ферментов элонгациии десатурации. Активность этих ферментов связана с эндоплазматическим ретикулумом, но иногда может протекать и в митохондриях. Кроме аллостерической регуляции существует гормональный контроль активности ацетил—СоА—карбоксилазы. Адреналин и глюкагон путем увеличения концентрации сАМР и активности протеинкиназы фосфорилируют ацетил—СоА—карбоксилазу и переводят ее в неактивное состояние. Эти гормоны также путем фосфорилирования переводят липазу в жировой ткани в активное состояние. Холестерин— жироподобное органическое вещество из группы стеринов животного происхождения. Его молекулярная формула — С27Н46О. С химической точки зрения, это ненасыщенный спирт. Холестерин имеет сложное гетероциклическое стероидное ядро. Углеродный скелет холестерина состоит из четырех колец: три кольца содержат по 6 атомов углерода и одно — 5 атомов. От него отходит длинная боковая цепь (рисунок приведен ниже). Молекулы холестерина гидрофобны. Характерное химическое свойство — способность к образованию молекулярных комплексов со многими солями, кислотами, аминами, белками и др. Большая часть холестерина в тканях животных присутствует в виде эфиров жирных кислот. Обмен холестерина На первом этапе этого процесса из трех молекул ацетата и коэнзима А синтезируется 3-гидрокси-3-метилглютарил коэнзим А (ГМГ-КоА). Далее в результате воздействия фермента ГМГ-КоА-редуктазы образуется мевалоновая кислота, которая примерно через 20 последующих этапов превращается в холестерин. Несмотря на всю сложность и многоэтапность этих процессов, ключевым ферментом, определяющим скорость синтеза холестерина, выступает именно ГМГ-КоА-редуктаза. Работу этого фермента и подавляют статины — широко пропагандируемые гиполипидемические (снижающие уровень холестерина) препараты, о которых речь пойдет позже. Механизм холестеринового гомеостаза сложен. Внутриклеточное содержание холестерина регулируется двумя механизмами. Первый из них контролирует продукцию холестерина по механизму отрицательной обратной связи. Второй механизм контроля уровня холестерина в клетке связан с регуляцией его транспорта через клеточную мембрану из межклеточного пространства. Этот транспорт осуществляется при участии рецепторов липопротеидов низкой плотности (ЛПНП). В обмене холестерина принимают участие десятки ферментов, и мутация в каждом из кодирующих их генов может привести к нарушению работы всей системы. Известны, например, так называемые семейные — передающиеся по наследству — формы гиперхолестеринемии (избытка холестерина). Эти нарушения липидного обмена связаны с мутацией генов, кодирующих рецептор липопротеидов низкой плотности. Если мутантный ген присутствует только в одной из пары хромосом, возникает так называемая гетерозиготная форма наследственной гиперхолестеринемии (в Америке и Европе она встречается у одного из 500 человек), если мутантных генов два — гомозиготная (встречается у одного человека из миллиона). В обоих случаях страдают рецепторы к ЛПНП, расположенные на поверхности гепатоцитов — клеток печени. Эти рецепторы играют важную роль в метаболизме холестерина, так как именно ЛПНП являются одним из его переносчиков. Обменом холестерина при наследственной семейной гиперхолестеринемии — генетическом заболевании, наследуемом по доминантному типу и характеризующимся чрезвычайно высоким уровнем в крови ЛПНП и отложением холестерина в тканях, — занимались Майкл Браун и Джозеф Голдстайн. В 1985 году им была присуждена Нобелевская премия в области физиологии и медицины за выдающиеся открытия, касающиеся обмена холестерина и лечения нарушений уровня холестерина в крови. Будучи гидрофобным соединением, холестерин нерастворим в воде и плазме крови. Он может переноситься с током крови только в составе так называемых транспортных форм — липопротеидов (белково-липидных комплексов), которые представляют собой сферические частицы, имеющие электрический заряд (рис. 1). Наружный (гидрофильный) слой образуют белки-апопротеины (или просто «апо»), а ядро составляют триглицериды (попросту говоря, жиры) и холестерин (гидрофобный слой). Получаются липосомы — мембранные микрокапсулы, которые могут путешествовать по кровеносным сосудам, перенося в себе холестерин (в одной капсуле может находиться до 1500 молекул холестерина). Выделяют пять основных классов липопротеидов, отличающихся по размеру, плотности, подвижности при электрофорезе, содержанию холестерина и триглицеридов и составу апопротеидов:
Остановимся на краткой характеристике классов липопротеидов, их метаболизме и роли в обмене холестерина (рис. 2). Это послужит лучшему понимаю их роли в патогенезе атеросклероза и может быть веским аргументом в реабилитации холестерина. ХМ — самые крупные липопротеидные частицы — транспортируют экзогенные (пищевые) жиры и холестерин из кишечника в печень и периферические ткани. Они образуются в эндоплазматическом ретикулуме кишечника, секретируются в лимфу и затем через грудной проток попадают в кровь. Период полужизни ХМ составляет 5–20 минут. Плотность — менее 0,95 г/мл, диаметр частицы — 800–5000 ангстрем. ЛПОНП (их называют также пре-бета-липопротеидами) являются транспортной формой эндогенных триглицеридов, на их долю приходится около 50–70% массы всех липопротеидных частиц. Печень может секретировать как крупные, так и мелкие липопротеиды, богатые триглицеридами, с плотностью от ЛППП (их плотность — менее 1,006 г/мл, диаметр частицы — 300–800 ангстрем) до ЛПОНП (1,006–1,019 г/мл, 250–350 ангстрем). ЛПНП (их называют также бета-липопротеидами) являются основным переносчиком эндогенного холестерина в крови (около 70% общего холестерина плазмы). Плотность — 1,019–0,063 г/мл, диаметр частицы — 180–280 ангстрем. Липидное ядро ЛПНП почти полностью состоит из эфиров холестерина. Период полужизни ЛПНП в крови — 2,5 дня. За это время до 75% из них захватывается клетками печени, а остальные 25% попадают в другие органы. Для того чтобы холестерин попал в печень, ее клетки должны «выхватить» ЛПНП из кровяного русла. Для этого на поверхности каждой частицы находятся сигнальные апобелки, а на поверхности клетки-захватчицы — соответствующие им рецепторы. Общее количество рецепторов ЛПНП на поверхности одной клетки может достигать 40 000 и более. Рецепторы имеют высокое сродство к ЛПНП и прочно связывают их даже при концентрации 1 молекула на 1 млрд молекул воды. Метаболизм ЛПНП идет двумя путями. Первый путь — связывание с апо-В/Е-рецепторами печени, клеток надпочечников и периферических клеток, включая гладкомышечные клетки и фибробласты. В норме рецептор-опосредованным путем из кровеносного русла удаляется около 75% ЛПНП. После проникновения в клетку частицы ЛПНП распадаются и высвобождают свободный холестерин. При избытке внутриклеточного холестерина он через взаимодействие с геном рецептора ЛПНП подавляет синтез рецепторов к ЛПНП и, наоборот, при низком уровне внутриклеточного холестерина синтез рецепторов к ЛПНП возрастает. Альтернативный путь метаболизма частиц ЛПНП — окисление. Перекисно-модифицированные ЛПНП слабо распознаются апо-В/Е-рецепторами, но быстро распознаются и захватываются так называемыми скэвенджерами (англ. scavenger — мусорщик) — рецепторами макрофагов. Этот путь катаболизма (распада) ЛПНП, в отличие от рецептор-зависимого пути, не подавляется при увеличении количества внутриклеточного холестерина. Продолжение этого процесса приводит к превращению макрофагов в переполненные эфирами холестерина пенистые клетки — компоненты жировых пятен. Последние являются предшественниками атеросклеротической бляшки, и за это липопротеиды низкой плотности считают «плохими» липопротеидами. ЛПВП — самые мелкие липопротеидные частицы (плотность — 1,125–1,21 г/мл, диаметр частицы — 50-90 ангстрем). Их также называют альфа-липопротеидами. На их долю приходится 20-30% общего холестерина крови, но из всех липопротеидов именно эти частицы содержат наибольшее количество фосфолипидов и белка. Основная функция ЛПВП — обеспечение обратного транспорта холестерина, то есть возвращение холестерина из периферических тканей в печень для дальнейшего распада. Липопротеиды различаются по участию в атерогенезе — то есть по степени причастности к возникновению атеросклероза. Атерогенность липопротеидов частично зависит от размера частиц. Самые мелкие липопротеиды, такие как ЛПВП, легко проникают в стенку сосуда, но так же легко ее покидают, не вызывая образования атеросклеротической бляшки. За это их и называют «хорошими» липопротеидами. ЛПНП, липопротеиды промежуточной плотности и мелкие ЛПОНП достаточно малы, и в случае окисления легко задерживаются в сосудистой стенке. ЛПНП — наиболее атерогенные липопротеиды крови. Вопрос 17. Строение, синтез и биологическое значение холестерола. Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень. В печени синтезируется более 50% холестерола, в тонком кишечнике - 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг (рис. 8-65). Холестерол выполняет много функций: входит в состав всех мембран клеток и влияет на их свойства, служит исходным субстратом в синтезе жёлчных кислот и стероидных гормонов. Предшественники в метаболическом пути синтеза холестерола превращаются также в убихинон - компонент дыхательной цепи и долихол, участвующий в синтезе гликопротеинов. Холестерол за счёт своей гидроксильной группы может образовывать эфиры с жирными кислотами. Этерифицированный холестерол преобладает в крови и запасается в небольших количествах в некоторых типах клеток, использующих его как субстрат для синтеза других веществ. Холестерол и его эфиры - гидрофобные молекулы, поэтому они транспортируются кровью только в составе разных типов ЛП. Обмен холестерола чрезвычайно сложен - только для его синтеза необходимо осуществление около 100 последовательных реакций. Всего в обмене холестерола участвует около 300 разных белков. Нарушения обмена холестерола приводят к одному из наиболее распространённых заболеваний - атеросклерозу. Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения. Атеросклероз - "полигенное заболевание", т.е. в его развитии участвуют многие факторы, важнейшие из которых наследственные. Накопление холестерола в организме приводит к развитию и другого распространённого заболевания - желчнокаменной болезни. Сложный путь синтеза холестерола можно разделить на 3 этапа (рис. 8-66). Первый этап заканчивается образованием мевалоната (мевалоновой кислоты). Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА. Фермент щдроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза кетоновых тел (см. рис. 8-33). Однако реакции синтеза кетоновых тел происходят в митохондриях печени, а реакции синтеза холестерола - в цитозоле клеток. Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза - гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль. Образование сквалена На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат - изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц - геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата - соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена - углеводорода линейной структуры, состоящего из 30 углеродных атомов. Образование холестерола На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов. |