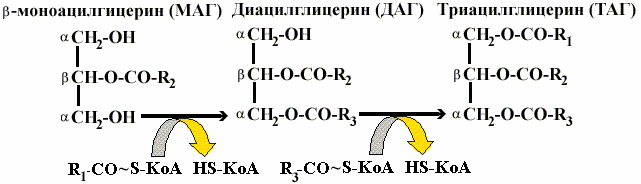коллоквиум по биохимии, 2 курс. 1. Цикл лимонной кислотыцентральный процесс энергетического обмена. Регулирование скорости цикла лимонной кислоты
 Скачать 109.65 Kb. Скачать 109.65 Kb.
|
|
1.Цикл лимонной кислоты-центральный процесс энергетического обмена. 2. Регулирование скорости цикла лимонной кислоты Ци́кл трикарбо́новых кисло́т (цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО–) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 NADH, 1 FADH2 и 1 ГТФ (или АТФ).Электроны, находящиеся на NADH и FADH2, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ. Функция цикла лимонной кислоты - обеспечение энергией, дыхательный контроль, осуществляемый при функционировании дыхательной цепи и окислительного фосфорилирования, является определяющим фактором при регуляции активности рассматриваемого цикла. Активность этого цикла непосредственно связана с поступлением окисленных кофакторов дегидрогеназ (например,NAD ), которое в свою очередь зависит от доступности ADP и, в конечном счете, от скорости потребления ATP . Свойства ряда ферментов этого цикла указывают на то, что кроме общей регуляции существует также регуляция на уровне самого цикла. В клетках головного мозга , в которых ацетил-CoA образуется в основном из углеводов , регуляция цикла лимонной кислоты может происходить на стадии, катализируемой пируватдегидрогеназой . В самом цикле регуляция может осуществляться путем аллостерического ингибирования цитратсинтазы при действии ATPили ацил-CoA-производных длинноцепочечных жирных кислот . В цитратном цикле ацетильные остатки (CH3CO—) окисляются до диоксида углерода (CO2). Полученные при этом восстановительные эквиваленты переносятся на НАД+ или убихинон и включаются в дыхательную цепь. Цикл проходит на матриксе митохондрий. Внутренняя мембрана митохондрий непроницаема для анионов и катионов, в том числе и для промежуточных продуктов цитратного цикла, которые могут быть перенесены через мембрану только при участии специальных белков. Поэтому ферменты цитратного цикла имеют больше возможностей для взаимодействия с продуктами предыдущих реакций, чем в случае свободного удаления этих продуктов из митохондрий. Регуляция цитратного цикла. В большинстве случаев скорость реакций в метаболических циклах определяется их начальными реакциями. В ЦТК важнейшая регуляторная реакция - образование цитрата из оксалоацетата и ацетил-КоА, катализируемая цитратсинтазой. Эта реакция ускоряется при повышении концентрации оксалоацетата - субстрата реакции и тормозится продуктом реакции - цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления маната в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ, сукцинил-КоА и длинноцепочечных жирных кислот. Митохондриальная NAD-зависимая изоцитратдегидрогеназа аллостерически активируется ADP и ингибируется ATP и NADH. Альфа-кетоглутаратдегидрогеназный комплекс регулируется, по-видимому, аналогично пируватдегидрогеназе. Сукцинатдегидрогеназа ингибируется оксалоацетат ом, а образование оксалоацетата в малатдегидрогеназной реакции зависит от соотношения [NADH]/[NAD+] . Поскольку величина Km цитратсинтазы для оксалоацетата такого же порядка, что и величина внутримитохондриальной концентрации оксалоацетата, концентрация последнего, по-видимому, играет определенную роль в регуляции скорости образования цитрат а. В норме скорости гликолиза и цикла трикарбоновых кислот тесно связаны, так что в пируват превращается лишь такое количество глюкозы, которое обеспечит цикл достаточным количеством «топлива» — ацетильными группами ацетил-СоА. Концентрации пирувата, лактата и ацетил-СоА в норме поддерживаются постоянными. Скорость гликолиза связана со скоростью цикла трикарбоновых кислот не только через ингибирование гликолиза высокими уровнями ATP и NADH, которое характерно и для гликолиза, и для дыхательного этапа окисления глюкозы, но также и концентрацией цитрата. Цитрат, первый продукт цикла трикарбоновых кислот, является важным аллостерическим ингибитором фосфофруктокиназы-1, гликолитического фермента. 3-4 вопрос Ацетил-кофермент А, ацетил-коэнзим А, сокращённо ацетил-КоА — важное соединение в обмене веществ, используемое во многих биохимических реакциях. Его главная функция — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии. По своей химической структуре ацетил-КоА — тиоэфир между коферментом А (тиолом) и уксусной кислотой (носителем ацильной группы). Ацетил-КоА образуется во время второго шага кислородного клеточного дыхания, декарбоксилирования пирувата, который происходит в матриксе митохондрии. Ацетил-КоА затем поступает в цикл трикарбоновых кислот. Ацетил-КоА — важный компонент биологического синтеза нейротрансмиттера ацетилхолина. Холин, в соединении с ацетил-КоА, катализируется ферментом холинацетилтрансферазой, чтобы образовать ацетилхолин и коэнзим А. Дегидрогеназ пирувата и реакции пируват формиат лиазы Кислородное преобразование пирувата в ацетил-КоА называют реакцией дегидрогеназа пирувата. Она катализируется пируватдегидрогеназным комплексом. Другие преобразования между пируватом и ацетил-КоА возможны. Например, пируват формиат лиазы преобразуют пируват в ацетил-КоА и муравьиную кислоту. Метаболизм жирных кислот У животных ацетил-КоА является основой баланса между углеводным обменом и жировым обменом. Обычно ацетил-КоА из метаболизма жирных кислот поступает в цикл трикарбоновых кислот, содействуя энергетическому обеспечению клеток. В печени, когда уровень циркуляции жирных кислот высок, производство ацетил-КоА от разрыва жиров превышает энергетические потребности клетки. Чтобы использовать энергию, доступную из лишних ацетил-КоА, создаются кетоновые тела, которые затем могут циркулировать в крови. В некоторых обстоятельствах это может привести к высокому уровню кетоновых тел в крови, состоянию, называемому кетозом, которое отличается от кетоацидоза, опасного состояния, способного повлиять на диабетиков. У растений синтез новых жирных кислот происходит в пластидах. Многие семена запасают большие количества масел в семенах, чтобы поддерживать прорастание и ранний рост саженцов, пока они не перешли на питание от фотосинтеза. Жирные кислоты включены в липиды мембраны, главнейший компонент большинства мембран. 9. Биохимические механизмы поддержания нормального уровня глюкозы при голодании При голодании уровень глюкозы поддерживается преимущественно двумя методами: глюконеогенезом и гликогенолизом. Гликогенолиз — биохимический процесс расщепления гликогена до глюкозы. Фосфорилаза переводит гликоген в активную форму, гликоген распадается с образование глюкозо-1-фосфата, затем он преобразуется в глюкозо-6-фосфат, а тот в свою очередь в глюкозу. Глюконеогенез — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений. Этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Глюконеогенез идет обратными стадиями гликолиза, кроме трех необратимых: превращение пирувата в фосфоенолпируват образование фруктозо-6-фосфата из фруктозо-1,6-бифосфата дефосфорилирование глюкозо-6-фосфата с образованием глюкозы Когда период голодания затягивается и содержание инсулина падает, глюконеогенез в печени становится единственным источником поддержания эугликемии, поскольку все запасы гликогена в печени уже израсходованы. Одновременно из жировой ткани метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел. Если голодание продолжается дни и недели, включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании наблюдаются крайне низкие концентрации инсулина в крови. 10. Биологическое значение пентозного пути окисления углеводов. Пентозофосфатный путь служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной. В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом: 3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат. Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле. Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках. Пентозофосфатный путь называют также апотомическим путём, так как в его реакциях происходит укорочение углеродной цепи гексозы на один атом, который включается в молекулу СО2. Биологическое значение: 1. он является главным источником НАДФН для синтеза жирных кислот, холестерола, стероидных гормонов, микросомального окисления; в эритроцитах НАДФН используется для восстановления глутатиона – вещества, препятствующего пероксидному гемолизу; 2. он является главным источником пентоз для синтеза нуклеотидов, нуклеиновых кислот, коферментов (АТФ, НАД, НАДФ, КоА-SН и др.). 11. Нарушения углеводного обмена. При некоторых состояниях можно наблюдать повышение содержания глюкозы в крови – гипергликемию, а также понижение концентрации глюкозы – гипогликемию. Гипергликемия является довольно частым симптомом различных заболеваний, прежде всего связанных с поражением эндокринной системы. В регуляции гликолиза и глюконеогенеза большую роль играет инсулин. При недостаточности содержания инсулина возникает заболевание, которое носит название «сахарный диабет»: повышается концентрация глюкозы в крови (гипергликемия), появляется глюкоза в моче (глюкозурия) и уменьшается содержаниегликогена в печени. Мышечная ткань при этом утрачивает способность утилизировать глюкозу крови. В печени при общем снижении интенсивности биосинтетических процессов: биосинтеза белков, синтеза жирных кислот из продуктов распада глюкозы – наблюдается усиленный синтез ферментов глюконеогенеза. Гипогликемию можно наблюдать при гипотиреозе. Резкое снижение уровня глюкозы в крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации. Обычно присутствие глюкозы в моче (глюкозурия) является результатом нарушения углеводного обмена вследствие патологических изменений в поджелудочной железе (сахарный диабет, острый панкреатит и т.д.). Реже встречается глюкозурия почечного происхождения, связанная с недостаточностью резорбции глюкозы в почечных канальцах. Ряд наследственных болезней связан с нарушением обмена гликогена. Эти болезни получили название гликогенозов. Они возникают в связи с дефицитом или полным отсутствием ферментов, катализирующих процессы распада или синтеза гликогена, и характеризуются избыточным его накоплением в различных органах и тканях. 14. Строение и Функции клеточных мембран, их участие в метаболизме Биологические мембраны – сложные надмолекулярные структуры, окружающие все живые клетки и образующие в них замкнутые, специализированные компартменты – органеллы. Строение: Все мембраны по своей организации и составу обнаруживают ряд общих свойств. Они:
Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойство мамфифильности (содержат как гидрофильные, так и гидрофобные функциональные группы). В липидном биослое гидрофобные участки молекул взаимодействуют между собой, а гидрофильные участки обращены в окружающую водную среду. Молекула липида состоит из двух частей: диполь- ной головки и углеводородного хвоста Функции: Механическое разделение. Транспортная функция. Селективный барьер.Мембрана защищает клетку от проникновения нежелательных частиц и веществ. Рецепция.Через мембрану происходит распознавание других клеток, веществ. Распространение нервного импульса.В мембране локализованы основные биоэлектрические процессы. Реализуется генерация электрического потенциала. Посредством мембраны происходит распространение нервного импульса. Матрица.Мембрана является матрицей (основой) для удержания белков, ферментов. Существует несколько механизмов транспорта веществ через мембрану. Диффузия —проникновение веществ через мембрану по градиенту концентрации {из области, где их концентрация выше, в область, где их концентрация ниже). Диффузный транспорт веществ (воды, ионов) осуществляется при участии белков мембраны, в которых имеются молекулярные поры, либо при участии липидной фазы (для жирорастворимых веществ). Активный транспорт сопряжен с затратами энергии и служит для переноса веществ против их градиента концентрации. Он осуществляется специальными белками-переносчиками, образующими так называемые ионные насосы. Наиболее изученным является Na-/ К--насос в клетках животных, активно выкачивающих ионы Na+ наружу, поглощая при этом ионы К-. Благодаря этому в клетке поддерживается большая концентрация К- и меньшая Na+ по сравнению с окружающей средой. На этот процесс затрачивается энергия АТФ. В результате активного транспорта с помощью мембранного насоса в клетке происходит также регуляция концентрации Mg2-и Са2+. В процессе активного транспорта ионов в клетку через цито-плазматическую мембрану проникают различные сахара, нукле-отиды, аминокислоты. Макромолекулы белков, нуклеиновых кислот, полисахаридов, липопротеидные комплексы и др. сквозь клеточные мембраны не проходят, в отличие от ионов и мономеров. Транспорт макромолекул, их комплексов и частиц внутрь клетки происходит совершенно иным путем — посредством эндоцитоза. При эндоци-тозе {эндо... — внутрь) определенный участок плазмалеммы захватывает и как бы обволакивает внеклеточный материал, заключая его в мембранную вакуоль, возникшую вследствие впя-чивания мембраны. В дальнейшем такая вакуоль соединяется с лизосомой, ферменты которой расщепляют макромолекулы до мономеров. Процесс, обратный эндоцитозу, — экзоцитоз (экзо... — наружу). Благодаря ему клетка выводит внутриклеточные продукты или непереваренные остатки, заключенные в вакуоли или пу- зырьки. Пузырек подходит к цитоплазматической мембране, сливается с ней, а его содержимое выделяется в окружающую среду. Гак выводятся пищеварительные ферменты, гормоны, гемицел-люлоза и др. Вопрос 16 Липидный обмен— или метаболизм липидов, представляет собой сложный биохимический и физиологический процесс происходящий в клетках живых организмов. Липидный обмен включает в себя следующие процессы:
Биологические функции липидов определяются прежде всего тем, что они являются источниками энергии. Эту функцию выполняют жирные кислоты, освобождающиеся после распада жиров. Фосфолипиды, гликолипиды и холестерин участвуют в образовании клеточных мембран. Производные некоторых полиненасыщенных жирных кислот (простагландины) выполняют регуляторную функцию, эти жирные кислоты представляют собой незаменимые пищевые факторы. Холестерин является структурным компонентом мембран, а также предшественником желчных кислот и стероидных гормонов.
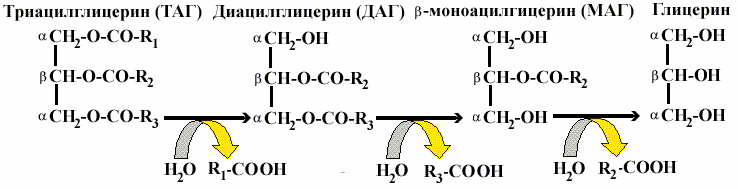
Расщепление липидов происходит в 12—перстной кишке, куда поступают липаза с соком поджелудочной железы и конъюгированные желчные кислоты в составе желчи. Эмульгирование жира — обязательное условие для переваривания, так как делает гидрофобный субстрат более доступным для действия гидролитических ферментов — липаз. Эмульгирование происходит при участии желчных кислот, которые из—за своей амфифильности, окружают каплю жира и снижают поверхностное натяжение, что приводит к дроблению капли. Гидролиз жира осуществляется при участии панкреатической липазы, которая, сорбируясь на поверхности капель жира, расщепляет эфирные связи в триацилглицеринах (ТАГ). Жирные кислоты отщепляются прежде всего из a —положения. В результате образуется — диацилглицерин, затем b —моноацилглицерин, который является основным продуктом гидролиза:
Всасывание происходит также при участии желчных кислот, которые образуют вместе с моноацилглицеринами, холестерином и жирными кислотами смешанные мицеллы — растворимые комплексы, обеспечивающие переход продуктов гидролиза в клетки слизистой кишечника. Желчные кислоты с током крови доставляются в печень, затем снова секретируются желчью в кишечник, то есть повторно используются, циркулируя по кругу: печень — кишечник — печень. Однако в течение суток примерно 0,3 г желчных кислот не всасываются, а выводятся с калом. Потери восполняются за счет синтеза в печени из холестерина. Нарушение желчеобразования или поступления желчи в кишечник приводит к нарушению расщепления жиров и их выделению в составе кала — стеаторрея . Ресинтез триацилглицеринов из продуктов расщепления происходит в клетках слизистой кишечника:
Транспорт ресинтезированного жира через лимфатическую систему и кровоток возможен только после включения его в состав липопротеинов. В кишечнике образуются два типа липопротеинов: хиломикроны — ХМ и в небольшом количестве липопротеины очень низкой плотности — ЛОНП. В составе хиломикронов экзогенные жиры доставляются в органы и ткани. Липопротеинлипаза (ЛП—липаза) — фермент, обеспечивающий потребление экзогенных жиров тканями. ЛП—липаза, располагающаяся в эндотелии сосудов, взаимодействует с хиломикронами кровотока и гидролизует триацилглирины на глицерин и жирные кислоты, которые поступают в клетку. По мере извлечения ТАГ из хиломикронов последние превращаются в остаточные хиломикроны и затем поступают в печень. Потребность в жирах составляет 50—100 г. в сутки — в зависимости от характера питания и энергетических затрат. Депонирование и мобилизация жиров Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры — наиболее долговременные и более эффективные источники энергии . При голодании запасы жира у человека истощаются за 5—7 недель, тогда как гликоген полностью расходуется примерно за сутки. Если поступление жира превышает потребности организма в энергии , то жир депонируется в адипоцитах — специализированных клетках жировой ткани. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то |