|
|
колоквиум бх 1. 1. Ионная связь
Билет №21.
1.Ионная связь...
Ионная связь - возникает между положительно и отрицательно заряженными группировками (дополнительные карбоксильные и аминогруппы), которые встречаются в радикалах лизина, аргинина, гистидина, аспарагиновой и глугаминовой кислот.
2.Методы отделения (очистки)...
От массы:
А) Гель-фильрация или метод молекулярных сит. Суть метода: хроматографическая колонка заполняется гранулами пористого вещества (агароза). Образуются «поры», в которую легко проникают вода и низкомолекулярные вещества. Далее на хроматографическую колонку наносят смесь белков, которую вымывают, пропуская через колонку растворитель. Более мелкие молекулы
диффундируют внугрь «пор» и задерживаются там, а более же крупные же белки, из-за их размера, не попадают в «поры». Поэтому с жидкостью, сначала выходят более крупные, а затем все более мелкие белки. Полученную жидкость собирают.
Б) Ультрацетрифугирование. Суть метода: на поверхность буфера, помещенную в кювету, наносят тонкий слой смеси белков. Кювету помещают в раствор ультрацентрифуги. При вращении в течение 10-12 часов более крупные молекулы оседают. В результате происходит расслоение смеси белков фракции с разной молекулярной массой. После расслоения дно кюветы прокалывают иглой и капелькам собирают содержимое.
В) Электрофорез белков в полиакриламидном геле. Электрофорез белков используют для разделения белков в зависимости от их суммарного заряда. При этом используют различные носители, на который наносят раствор белка и помещают в электрическое поле. Скорость движения на носителе будет зависеть от суммарного заряда белка, но если полиакриламидный гель, то скорость движения будет зависеть и от массы
От заряда:
А) Электрофорез белков. Суть метода: при определенном значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др.
Б) Ионообменная хроматография. Метод основан на разделении белков, различающихся суммарным зарядом при определенных значениях рН и ионной силы раствора. Через хроматографическую колонку, заполненную твердым пористым заряженным материалом, пропускают раствор белков. В зависимости от того, какой заряд имеет белок, материал может быть, заряжен отрицательно или положительно.
Чем больше заряд положительно заряженного белка, тем сильнее он будет связываться с катионообменником. После его нужно смыть буферными растворами.
3. Энергия активации...
Разность между средним энергетическим уровнем молекул и энергетическим уровнем реакции называется энергией активации. Чем больше эта энергия активации, тем медленнее идет химическая реакция.
Как ускорить химическую реакцию? Повысить среднего энергетического уровня молекул (повышение температуры, давления и т.д.), но это нереально. Невозможен и другой путь - уменьшение энергии активации путем снижения энергетического уровня реакции, т.к. эта величина является постоянной характеристикой данной реакции.
Энергетический итог реакции разность между энергетическим уровнем исходных веществ и энергетическим уровнем продуктов реакции.
4. Автономная регуляция...
Автономная саморегуляция - это регуляция, которая происходит благодаря только самим участникам реакции, т.е. за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только работает, но еще и сам себя регулирует.
Билет №20.
1.Варианты вторичной структуры белка...
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
А) Альфа-спираль -Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти расположены параллельно и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру.
Б) Бета-складчатая структура (структура складчатого листа). Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи.
В) Нерегулярная структура - расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
2. Гемоглобин. Многие глобулярные белки обладают четвертичной структурой. При этом каждая субъединица сохраняет черты своей третичной структуры. Соединяются они между собой слабыми связями, а иногда - и дисульфидными. В качестве примера может служить гемоглобин. Его молекула построена из четырех субъединиц. Каждая из них очень напоминает молекулу миоглобина. Вместе с тем, есть и существенные различия в первичной структуре. В соответствии с ними, разные варианты субъединиц обозначают буквами греческого алфавита.
3. Зависимость скорости от pH среды...
Влияние рН на функционирование ферментов очень значительно. Подкисление или подщелачивание среды усиливает диссоциацию основных или кислотных групп белковой молекулы, вызывая изменения ее конформации. В случае фермента это приводит уменьшению каталитической эффективности. Вблизи оптимума рН эти изменения обратимы. Однако чрезмерные изменения рН приводят к необратимой потере активности фермента вследствие его денатурации.
4. Мультиферментные системы...
В большинстве случаев биохимический процесс катализируется не одним ферментом, а целой совокупностью ферментов, каждый из которых катализирует свой этап. Совокупность ферментов, катализирующих свою реакции единого процесса, называется мультиферментной системой.
Как правило, эти ферменты подвергаются воздействию со стороны аллостерических эффекторов. В таких мультиферментных системах аллостерическими эффекторами бывают часто не только продукт или субстрат данной реакции, но и другие метаболиты конечные продукты. Если конечный продукт оказывает активирующее действие, то этот механизм называется положительной обратной связью и процесс протекает взрывообразно - до полного исчерпания субстрата в системе. Если конечный продукт - ингибитор лимитирующего фермента - то говорят об отрицательной обратной связи. Если лимитирующий фермент является одновременно и регуляторным, то его называют ключевым ферментом мультиферментной цепи.
Билет №19.
1.Кодируемые аминокислоты...
В природе встречается около 150 аминокислот. Для построения
белков используются только 20 из них, хотя в метаболизме организма человека участвует большее количество аминокислот. Эти 20 аминокислот имеют несколько общих признаков строения. Они называются кодируемыми.
Основные различия в строении белковых молекул:
А) По количеству аминокислот
Б) По соотношению количества различных аминокислот.
В) Различная последовательность чередования аминокислот.
Г) Количество полипептидных цепей в различных белках может варьировать от 1 до 12, но если больше единицы, то обычно четное (2, 4, 6 и т.п.).
Д) По наличию небелкового компонента, который называется «простетическая группа». Если ее нет, то это - простой белок, если есть - сложный белок.
2. Гидратная оболочка белка...
Гидратная оболочка - это слой молекул воды на поверхности белковой молекулы. Поверхность болыиинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами.
Чем более гидрофильна белковая молекула, т.е. чем больше в ее составе аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка.
Вода гидратной оболочки обладает особыми свойствами: она как бы принадлежит белку, и поэтому в ней не растворяются различные соли и другие гидрофильные вещества. Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
3. Этапы ферментативного катализа...
1 этап. Адсорбция субстрата. Происходит на активном адсобированном центре с образованием обратимого E-S комплекса (фермент-субстратного). Типы связей-слабые, поэтому процесс обратим. Характеризуется константой Михаэлиса . Биолог.смысл- отражает сродство фермента к субстрату. Физический смысл- концентрация субстрата, при котороый достигается половина Vмакс. Если к+1 больше то сродство больше, если к-1 больше, то сродство меньше Чем меньше Км тем больше сродство.
2 этап. Ковалетное преобразование субстрата. На каталитическом центре.Этап необратим, так как сильные ковалентные связи( но для обратимых реакций обратим). Это лимитирующий этап(медленнее всего)- от его скорости зависит скорость других этапов. Характерезиется V макс. Достигается если все активные центры фрментов будут заняты субстратом.
3 этап. Отсоединение готового продукта. На каталитическоц центре фермента. Этап необратим, но для обратимых реакций обратим.
4. Обратимые Конкурентные ингибиторы
По строению похожи на субстрат. Присоединяются к адсорбционному центру, но так как не являются субстратом, не могут переходить на каталитический центр. Сродство маленькое, поэтому КМ высокое. V макс не изменна. При повышении количества субстрата дейтсвие ингибитора уменьшается. Пример: аллопуринол(ингибитор ксантиноксидазы). По строению похож на мочевую кислоту. При повышении моч.кислоты ---подагра. Аллопуринол снижает содержание мочевой кислоты.
Билет №8.
1.Дисульфидная связь...
Цистеин - аминокислота, которая в радикале имеет SH-группу, за счет которой и образуются дисульфидные связи. Дисульфидная связь - это ковалентная связь. Однако биологически она гораздо менее устойчива, чем пептидная связь. Это объясняется тем, что в организме интенсивно протекают окислительно-восстановительные процессы. Дисульфидная связь может возникать между разными участками одной и той же полипептидной цепи, тогда она удерживает эту цепь в изогнутом состоянии. Если дисульфидная связь возникает между двумя полипептидами. то она объединяет их в ОДНУ молекулу.
2. Вторичная структура белка...
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
А) Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка.
Эти водородные связи расположены параллельно оси спирали и
многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
Б) Бета-складчатая структура (структура складчатого листа). Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи.
В) Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
3. Понятие об изоферментах...
Изоферменты- это фермнты, катализирующие одну и ту же реакцию, но имеющие разные свойства и организацию в организме.Определение активности изоферментов лежит в основе диагностики различных патологий.
Так, креатинкиназа скелетных мышц имеет 3 вида формы. ММ форма(мышечная), ВВ форма(церебральная), МВ форма(смешанная=сердечная).
4. Неспецифические ингибиторы ферментов, привести примеры.
Различные неспецифические, физические, физико-химические воздействия, вызванные денатурацией белка-фермента. они реагируют с любыми свободными SH-группами белков(ацетат йода)
Билет №8 (2013).
1.Принципы...
Основные различия в строении белковых молекул:
А) По количеству аминокислот
Б) По соотношению количества различных аминокислот.
В) Различная последовательность чередования аминокислот.
Г) Количество полипептидных цепей в различных белках может варьировать от 1 до 12, но если больше единицы, то обычно четное (2, 4, 6 и т.п.).
Д) По наличию небелкового компонента, который называется «простетическая группа». Если ее нет, то это - простой белок, если есть - сложный белок.
2. Вторичная структура белка...
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
А) Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка.
Эти водородные связи расположены параллельно оси спирали и
многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
Б) Бета-складчатая структура (структура складчатого листа). Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи.
В) Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
3. Понятие об изоферментах...
Изоферменты- это фермнты, катализирующие одну и ту же реакцию, но имеющие разные свойства и организацию в организме.Определение активности изоферментов лежит в основе диагностики различных патологий.
Так, креатинкиназа скелетных мышц имеет 3 вида формы. ММ форма(мышечная), ВВ форма(церебральная), МВ форма(смешанная=сердечная).
4. Аллостерический центр фермента...
Аллостерическими центрами называют такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр. облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами или аллостерическими ингибиторами данного фермента. Аллостерические центры найдены не у всех ферментов. Они есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ.
Билет №7.
1.Электролитическая диссоциация...
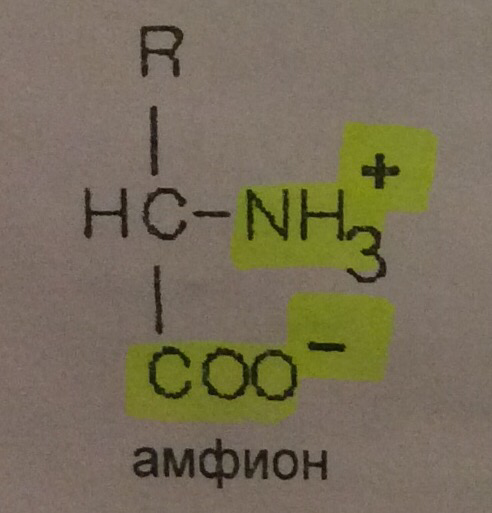
Способность к электролитической диссоциации. Аминокислоты существуют в водном растворе в виде амфионов (биполярных ионов). В целом такая молекула при нейтральном значении рН (pH = 7) электронейтральна.
2. Третичная структура белков...
особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. В формировании третичной структуры участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа третичной структуры:
А) В фибриллярных белках (коллаген)- третичная структура представлена либо тройной альфа-спиралью либо бетаскладчатыми структурами.
Б) В глобулярных белках (эластин)- всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
3. Понятие о коферментах и их роль.
Кофермент – это небелковая часть фемрента, которая участвует в построении каталитического центра. Поступают из внешней среды(витамины). Кофермент – отделяемая часть, которая присоеднияется в апоферменту слабыми типами связей. Пример: витамин а- кофермент ретиналь – зрительный процесс, биотин-биотицин-перенос кислорода, фолиевая кислота-тетрагидрофолат-перенос одноуглеродных групп.
4. Зависимость скорости...

Зависимость скорости ферментативной реакции от концентрации фермента при постоянной и довольно большой концентрации субстратаимеет такой вид:
Отклонение от линейного характера графика при очень высокой конуетрации фермента лимитируется нехваткой субстрата, т.е. снижается поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо в том диапазоне, в котором эта кривая линейна. Линейность этого графика позволяет выразить его одной цифрой - тангенс угла наклона к оси абсцисс. Этот тангенс представляет собой величину активности фермента. Именно работа (эффективность) каждого фермента количественно характеризуется величиной его активности, т.е. величиной скорости ферментативной реакции в расчете на единицу количества фермента. Из линейности следует, что можно по скорости реакции судить о количестве фермента.
Билет №7(2013).
1.Четвертичная структура...
Встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Каждая такая цепь называется субъединицей данной молекулы (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками. В состав белковой молекулы могут входить одинаковые или разные субъединицы. Например, молекула гемоглобина «А» состоит из двух субъединиц одного типа и двух субъединиц другого типа, то есть является тетрамером. Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда еще и дисульфидными связями.
2.Методы разделения...
От массы:
А) Гель-фильрация или метод молекулярных сит. Суть метода: хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза).
При этом в структуре данного вещества, образуются «поры», в которую легко проникают вода и низкомолекулярные вещества. В зависимости от условий можно формировать «поры» разной величины.
Далее на хроматографическую колонку наносят смесь белков, которую вымывают, пропуская через колонку растворитель. Более мелкие молекулы
диффундируют внугрь «пор» и задерживаются там на некоторое время, а
более же крупные же белки, из-за их размера, не попадают в «поры» и не
задерживаются. Поэтому с промывной жидкостью, сначала выходят более
крупные, а затем все более мелкие белки. Жидкость, полученную после пропускания через колонку растворителя, собирают небольшими порциями.
В каждой порции содержатся белки определенной массы.
Б) Ультрацетрифугирование. Суть метода: на поверхность буфера, помещенную в кювету, наносят тонкий слой смеси белков. Кювету помещают в раствор ультрацентрифуги. При вращении в течение 10-12 часов более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой. После расслоения белковых фракций дно кюветы прокалывают иглой и капелькам собирают содержимое небольшими порциями.
В) Электрофорез белков в полиакриламидном геле. Электрофорез белков используют для разделения белков в зависимости от их суммарного заряда. При этом используют различные носители, на который наносят раствор белка и помещают в электрическое поле. Скорость движения на носителе будет зависеть от суммарного заряда белка, но если в качестве носителя использовать полиакриламидный гель, то скорость
движения также будет зависеть и от массы белковой молекулы.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге.
3. Виды специфичности...
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ
СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ.
Это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного центра.
Различают 3 типа субстратной специфичности:
А) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного субстрата.
Б) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
В) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения
определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все Аминокислоты L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностыо
одновременно.
4. Механизмы автономной...
Автономная саморегуляция - это регуляция, которая происходит благодаря только самим участникам реакции, т.е. за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только работает, но еще и сам себя регулирует.
Механизмы автономной саморегуляции :
А) Механизмы, основанные на кинетических свойствах фермента, характеризуемых Км и Vmax
Б) Второй принцип связан с аллостерическими свойствами фермента, то есть со способностью фермента угнетаться или активироваться под действием субстрата и/или продуктов.
Билет №3.
1.Краткая характеристика...
2. Зависимость заряда...
ИЭТ - это значение рН среды, при котором молекула амфотерного вещества (например, аминокислоты) находится в электронейтральном состоянии.
3. Необратимые ингибиторы – связываются сильными ковалентными связями, неотделимы от фермента. Пример – фосфорганические соединения ингибируют ацетилхолин эстеразу( синаптические щели накапливают ацетилхолин). Симптомы – слезы, слюноотделение. 2 пример – ацетилсалициловая кислота ингибирует циклокосигеназу. Этот фермент образует их арахид.кислоты простогланду.
4. Уровни регуляции...
Существуют различные механизмы регуляции процессов, протекающих в
организме.
3 уровня регуляции:
А) Самый молодой уровень филогенетически - НЕЙРОГУМОРАЛЬНАЯ регуляция (с
участием центральной нервной системы, классических гормонов и гормонов местного
действия).
Б) РЕГУЛЯЦИЯ НА ГЕНЕТИЧЕСКОМ УРОВНЕ - изменение скорости биосинтеза
белка.
В) Филогенетически наиболее старый уровень - АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ
ФЕРМЕНТОВ. АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ - это регуляция, которая происходит благодаря только самим участникам реакции, то есть за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только
работает, но еще и сам себя регулирует.
Билет №2.
1.Классификация аминокислот.
Существуют три типа классификации:
I. Физико-химическая классификация - основана на различиях в физико-химических свойствах аминокислот.
А) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где равномерно распределена электронная плотность и нет никаких зарядов и полюсов. В их составе могут присутвовать и электроотрицательные элементы, но все они находятся в углеводородном окружении.
Б) Гидрофильные (полярные) аминокислоты.
Радикалы таких аминокислот содержат в своем составе полярные группировки: -OH, -SH и амидные группы.
В) Отрицательно заряженные аминокислоты.
Г) Положительно заряженные аминокислоты.
II. Биологическая классификация
А) Незаменимые аминокислоты- должны обязательно поступать с пищей. Их 8 и еще 2 аминокислоты относятся к частично незаменимым.
Незаменимые:
1. метионин,
2. треонин,
3. лизин,
4. лейцин,
5. изолейцин,
6. валин,
7. триптофан,
8. фенилаланин.
Частично незаменимые:
9. аргинин
10.гистидин
Б) Заменимые (могут синтезироваться в организме человека). Их
десять:
1. глутаминовая кислота,
2. глутамин,
3. пролин,
4. аланин,
5. аспарагиновая кислота,
6. аспарагин,
7. тирозин,
8. цистеин,
9. серии
10. глицин
III. Химическая классификация - в соответствии с химической структурой радикала аминокислоты (алифатические, ароматические).
2. Денатурация...
Денатурация - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной ,третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур.
Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза.
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Физические факторы:
1. Высокие температуры.
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
4. Ультразвук
5. Механическое воздействие (например, вибрация)
Химические факторы:
1. Концентрированные кислоты и щелочи.
2.Соли тяжелых металлов (например, CuS04) .
3.Органические растворители (этиловый спирт, ацетон)
4.Растительные алкалоиды.
4.Мочевина в высоких концентрациях
3. Строение активного центра ферментов.
Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активный центр фермента. В его пределах различают адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки. Каждый из них обозначают термином аллостерическии центр.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента.
Адсорбционный центр - это участок активного центра фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этои молекулы каталитическому центру.
4. Зависимость...
З

ависимость скорости ферментативной реакции от концентрации субстрата. Чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость не линейная, а гиперболическая:
Билет 1.
Первичная структура белка - последовательность аминокислотных фрагментов, прочно соединенных пептидными связями.
Вторичная структура - это пространственная организация полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
Альфа-спираль-. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка.
Бета-складчатая структура . Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны.
3) Нерегулярная структура - расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
ТРЕТИЧНАЯ СТРУКТУРА
особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У разных белков третичной структуры различна. В формировании третичной структуры участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа третичной структуры:
1) В фибриллярных белках (например, коллаген, эластин) - тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами.
2) В глобулярных белках, всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Каждая такая цепь называется СУБЪЕДИНИЦЕЙ данной молекулы (или ПРОТОМЕРОМ). Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда еще и дисульфидными связями.
2. Простетические группы белков - небелковый (неаминокислотный) компонент сложных белков, необходимый для биологической активности белка. Простетическая группа может быть как органическим соединением, так и неорганическим (ионом металла). Простетические группы тесно связаны с белками, обычно ковалентными связями.

3. Влияние температуры на скорость ферментативной реакции характеризуется куполообразным графиком. Вершина купола соответствует диапазону температур, оптимальному для данного фермента. У теплокровных животных температурным оптимум большинства ферментов находится в пределах 3545°С. Для ферментов растений он обычно смещен в зону 25-20°С или даже ниже. Ширина купола бывает разной. Она зависит от устойчивости фермента к тепловой денатурации. При повышении температуры за пределы оптимальной происходит более или менее плавное снижение скорости ферментативной реакции, а в определенной зоне (разной для разных ферментов) наступает полная денатурация белка и, следовательно, необратимая утрата каталитической функции. Снижение температуры от оптимальной до нулевой также сопровождается постепенным замедлением ферментативной реакции, но оно носит обратимый характер: последующее согревание ведет к полному восстановлению свойств фермента.
4. Единица активности фермента – количество фермента, которое в стандартных условиях катализирует превращение 1 мкмоль субстрата в 1 мин (1 МЕ = 1 мкмоль/мин). • 1 КАТАЛ – количество фермента, способное в течение 1 с обеспечить превращение 1 моля субстрата в стандартных условиях. 1 КАТАЛ = 6 · 107 МЕ. • Удельная активность – число единиц ферментативной активности, приходящееся на 1 мг белка (1 мкмоль/мг белка · мин). • Молекулярная активность – число молей субстрата, которые подвергаются превращению молекулой фермента за 1 мин. • Активность каталитического центра – число молекул субстрата, которые претерпевают превращение за 1 мин в расчете на 1 каталитический центр. • Число оборотов фермента – число молекул субстрата, претерпевающих превращение за 1 мин в расчете на 1 активный центр или 1 активную молекулу фермента. Для большинства ферментов число оборотов составляет 1-10 тысяч в мин. |
|
|
 Скачать 3.45 Mb.
Скачать 3.45 Mb.




