бх экз. 1. Клеточный метаболизм, его биологическая роль. Вторичный метаболизм
 Скачать 1.85 Mb. Скачать 1.85 Mb.
|
|
Часть синтезируемых белков работает вне клетки и переносится через кл мембраны с пом особ низкомолек пептидов, содерж 15-30 гидрофобных АК. Это позвол проникать им через двуслойню липидную мембрану. Такие белки назыв сигнальными. Они расп первыми с N-конца полипептида и образуют канал в мембране, через который протягивают пептид. В процессе прохождения через мембрану или сразу после этого сигнальная последовательность отщепл, а зрелый белок покидает клетку. 32. Индукция и репрессия синтеза белков. Конструктивные и индуцируемые ферменты. Жив кл имеют точно запрограммир м-мы регуляции синтеза белков. В клетке в определенный момент присутствуют только определенное число молекул белка, необхдля протек метабол процессов. ДНК кишеч палоч содерж примерно 3000 блеков. Эти белки содерж в кл в разн кол-вах. Например, бета-галактозидаза втр в количестве 5 млн и ее кол-во резко возр, если изменяется состав питательной среды, на кот выращ кишеч палочка – если ее пересадят на лакотозосодерж среду. Благод регул синтеза в кл любого типа созд прав набор ферментов обесп протек биохим процессов. Ферменты в кл дел на 2 вида: конститутивные и индуцибельные. Конститутивные ферм сод в постоян кол-ве вне зависимости от метабол сост кл (напр, ферменты гликолиза). Индуцибельные ферменты – их конц измен в зависимости от состояния кл (бета-галактозидаза не будет образовываться, если пересадить кишеч пал на среду с глюкозой). В этом примере лактоза явл в-вом, которое индуцирует синтез фермента – вещество индуктор. Те в-ва, кот оказ противопол действ, угнетая синтез, назыв реперссоры. Теория индукции и репрессии лежуит в осн гипотезы регул синтеза белка, предлож Жакобом и Моно. Теория сводится к включению генов. Эту теор доказывали на опыте с бактериями, хотя у эукариот имеется, вероятно, более сложный м-м регул синтеза белка. 33. Гипотеза Жакоба и Моно. Жакоб и Моно в основу своей теор положили взаимосвязь явлений индукции и репрессии. Согл их теор, в б/с белка участв 3 вида генов: 1)структурные 2)ген-регулятор и 3)ген-оператор. Трукт.гены опред первич стр-ру снтез-го белка. Они явл основой для синтеза м-рнк, кот затем поступ на рибосому и служ марицей для синетза белка. Стр.гены непосредств контролир-ся определ участком, кот назыв ге-оператор. Ген оператор слежуит пусковым м-мом для функционирования структурных генов. Он располаг на крайнем отрезке структурного гена. Считывание генетич кода начин с промотора – участка ДНК, кот явл точкой инициации для синтезир м-РНК. Кодированный одним ператором одиночный ген или группа структурных генов образует оперон. Д-ть оперона нах-ся под рег гена-регулятора. Ген-регулятор и ген-оператор пространственно разъединены и связь м/д ними осущ с пом белка-репрессора, кот синтезируется на гене-регуляторе. Репрессор имеет сродство к гену-оператору и обратимо соед с ним в комплекс. Это ведет к блокир синтеза м-рнк и, следовательно, к бокир синтеза белка. Однако репрессор м связ с низкомолек в-вами индукторами. Когда индуктор связ с репрессором, ген-оператор осовобождается и начинается синтез м-рнк и белка. То есть биосинтез м-рнк, контролирующий синтез белка, зависит от функционального состояния белка-репрессора. За свою теор Ж и М удост нобелевки в обл молекулярной биол. 35. Энергетические затраты биосинтеза белка. Биосинтез белка представляет цепь синтетических реакций: 1) синтез и-РНК; 2) соединение аминокислот с т-РНК; 3) "сборку белка". Все эти реакции требуют энергетических затрат. Наиболее энергозатратным процессом при синтезе белка обычно считается трансляция. Большая часть клеточного пула гуанозинтрифосфата используется для полимеризации аминокислот, тогда как значительно меньшее количество энергии используется на другие процессы, включая транскрипцию и сворачивание белков. При аминоацилировании тРНК затрачивается энергия одной связи молекулы АТФ, при кодонзависимом связывании аминоацил-тРНК - энергия одной связи молекулы ГТФ, при перемещении рибосомы на один триплет - энергия одной связи еще одной молекулы ГТФ. В итоге на присоединение аминокислоты к полипептидной цепи затрачивается около 100 кДж/моль. При гидролизе же пептидной связи высвобождается лишь 2 кДж/моль. Таким образом, при биосинтезе большая часть энергии безвозвратно теряется (рассеивается в виде тепла). 36. Биосинтез аминокислот и белков для практических целей. Индустриальное производство белков осуществляется сейчас тремя способами: производство кормовых дрожжей, приготовление белково-витаминных концентратов и выделение белков из непищевого сырья растительного происхождения. Производство кормовых дрожжей, содержащих более 50% белка и богатых витаминами и микроэлементами, организуют на отходах деревообрабатывающей, целлюлозно-бумажной, сахароваренной и спиртовой промышленности (опилки, барда и т. п.), а также на отходах переработки растительного сырья (солома, кукурузные початки и др.). Белково-витаминный концентрат производят из нефтяного сырья. Впервые такое производство в небольших масштабах было развернуто во Франции, причем его продукцию использовали не только в животноводстве, но и в пищевой промышленности. В нашей стране вошли в строй Светлоярский, Кстовский, Томский, Новополоцкий, Киришинский и Кременчугский заводы по производству белково-витаминного концентрата. Однако в процессе их эксплуатации возникли экологические проблемы, решение которых наталкивается как на технические трудности, так и на эмоциональное противостояние населения. На промышленную основу за рубежом поставлено выделение белков из непищевого растительного сырья: листьев древесных растений, несъедобных бобов и семян и т. п. Из такого белка готовят искусственное мясо, искусственные колбасы и другие пищевые суррогаты, получающие все большее распространение в качестве дешевых заменителей натуральных продуктов. У нас разработан метод выделения пищевого белка из хлопковых семян. Отличным источником кормового белка является одноклеточная водоросль хлорелла, производство которой развивается во всех странах мира, в том числе в нашей стране, Болгарии, Японии, ФРГ и др. Применение кормового белка и белково-витаминных концентратов в животноводстве исключительно эффективно: улучшается использование белков основной диеты, возрастают привесы и увеличивается скорость роста молодняка, снижается расход кормов на единицу продукции, резко повышается эффективность производства. Поэтому перед молодой отраслью — промышленным производством белков — открываются большие перспективы. Создаются мощные, предприятия по микробиологическому синтезу белка на базе этилового спирта и природного газа с производительностью 300—500 тыс. т продукции в год. Разрабатывается также регламент промышленного выращивания водородных бактерий, биомасса которых исключительно богата белком — содержание его достигает 70%. Проблема обеспечения человечества белком решается и в более глобальном масштабе. Микробный синтез АК. Специфические ферменты, регулирующие биосинтез аминокислот, широко распространены у бактерий. Первое место здесь по праву занимает Япония, где лишь глутаминовой кислоты изготавливается свыше 100 тысяч тонн в год Энзиматический синтез. По данному способу процесс получения аминокислот заключается в синтезе предшественника аминокислоты и последующей его трансформации в целевую аминокислоту с использованием выделенных ферментов или микроорганизмов. Ферментативный синтез. Данный способ получения аминокислот основан на способности микроорганизмов синтезировать все L-аминокислоты, а в определенных условиях — обеспечивать их «сверхсинтез». Основное отличие микробиологической ферментации от энзиматической заключается в использовании не отдельных выделенных, а всех ферментов микроорганизмов. Большинство микроорганизмов и зеленые растения способны синтезировать de novo все двадцать аминокислот, из которых строятся белки. Углеродные скелеты аминокислот образуются из промежуточных продуктов обмена. Аминогруппы вводятся путем прямого аминирования или трансаминирования. 37. Распад полисахаридов, ферменты его катализирующие. Поли- и олигосахариды распадаются на простые соединения двумя путями: гидролизом и фосфоролизом. Гидролиз (или расщепление макромолекулы в присутсвии воды) крахмала ускоряется специфическими ферментами — амилазами, относящимися к классу гидролаз. В зависимости от характера фермента гидролитический разрыв эфирных связей между остатками a-D-глюкопиранозы в молекуле крахмала может происходить до глюкозы, мальтозы или олигосахаридов. В природе найдено несколько амилаз: a-амилаза, b-амилаза, g-амилаза (глюкоамилаза) и амило-1,6-глюкозидаза. a-Амилаза (a-1,4-глюкан-4-глюканогидролаза) ускоряет гидролиз внутренних a-1,4-гликозидных связей в молекуле крахмала. В качестве основного конечного продукта гидролиза крахмала при участии a-амилазы образуется мальтоза в a-форме. a-Амилаза найдена у всех видов растений и животных. b-Амилаза (a-1,4-глюкан-мальтогидролаза) ускоряет гидролиз a-1,4-гликозидных связей, начиная с невосстанавливающего конца молекулы крахмала, последовательно отщепляя остатки мальтозы. Мальтоза, освобождающаяся при гидролизе крахмала под действием b-амилазы, получается в b-форме. Образование последней происходит в момент гидролиза a-гликозидной связи вследствие изменения пространственной конфигурации образующегося гликозидного гидроксила при первом углеродном атоме остатка глюкозы. b-Амилаза найдена лишь у высших растений. g-Амилаза (a-1,4-глюкан-глюкогидролаза, глюкоамилаза) ускоряет гидролиз a-1,4-гликозидных связей в молекуле крахмала или олигосахаридов, последовательно отщепляя остатки глюкозы от невосстанавливающего конца молекулы. Амило-1,6-глюкозидаза (амило-6-глюканогидролаза) ускоряет реакцию гидролиза 1,6-связей в молекуле крахмала (амилопектина), т.е. в точках разветвления полиглюкозидной цепи, и образует олигосахариды с тем или иным числом остатков a-D-глюкозы и зависимости от длины отщепляемой боковой цепи. Фермент характерен для животных тканей, но встречается также у растений и микроорганизмов. Характерной особенностью всех амилаз является отсутствие абсолютной специфичности действия. Они ускоряют гидролиз различных соединений: амилозы, амилопектина, гликогена и олигосахаридов. Аналогично крахмалу и гликогену гидролизуются и другие природные полисахариды: целлюлоза — при участии фермента целлюлазы, хитин — хитиназы, гепарин — гепариназы и др. Дисахариды, возникающие в ряде случаев при гидролизе полисахаридов (например, мальтоза и целлобиоза) или существующие в организме в свободном виде (лактоза, сахароза, трегалоза и др.), гидролизуются при каталитическом воздействии a- и b-гликозидаз до индивидуальных моносахаридов. Другой путь распада полисахаридов и олигосахаридов — фосфоролиз — наиболее характерен для гликогена. Реакция фосфоролиза заключается в присоединении фосфорной кислоты по месту разрыва гликозидной связи между остатками моносахаридов в молекулах олиго- или полисахаридов. Реакции фосфоролиза ускоряются специфическими ферментами — фосфорилазами (гликозилтрансферазами), причем фосфоролитическому расщеплению подвергаются лишь 1,4-гликозидные связи. Поэтому в случае фосфоролиза, например, амидопектина распад прекращается в точках разветвления молекулы, где имеются 1,6-связи. Дальнейший фосфоролиз будет происходить лишь после расщепления 1,6-связей в остаточном декстрине при посредстве амило-1,6-гликозидазы. Таким образом, при распаде олиго- и полисахаридов возникают свободные моносахариды или их фосфорные эфиры. В дальнейшем обмене моносахаридов участвуют только их фосфорные эфиры, свободные же монозы фосфорилируются, превращаясь в фосфорные эфиры, представляющие собой гораздо более реакционноспособные соединения по сравнению со свободными моносахаридами. Фосфорилирование моносахаридов осуществляется при их взаимодействии с АТФ и ускоряется ферментами — фосфотрансферазами, носящими название киназ. Фосфорилирование глюкозы, например, идет по схеме: глюкокиназа Глюкоза + АТФ ¾¾¾¾¾¾® Глюкозо-6-фосфат + АДФ. Глюкозо-6-фосфат образуется в организме разными путями, в том числе при фосфорилировании глюкозы, и, за счет изомеризации (при участии фермента фосфоглюкомутазы) глюкозо-1-фосфата, который образуется в свою очередь в процессе фосфоролиза олиго- и полисахаридов. Глюкозо-6-фосфат подвергается разнообразным превращениям. В процессе его окислительного распада запасается энергия в мак-роэргических связях АТФ. Кроме того, многие из промежуточных продуктов, образующихся при обмене глюкозо-6-фосфата, используются для синтеза аминокислот, нуклеотидов, глицерина, высших жирных кислот и т. п. Катаболизм глюкозо-6-фосфата осуществляется преимущественно двумя путями: дихотомическим (гликолиз), когда на определенной стадии молекула распадается пополам, и апотомическим (пентозофосфатный путь), когда молекула теряет первый углеродный атом. 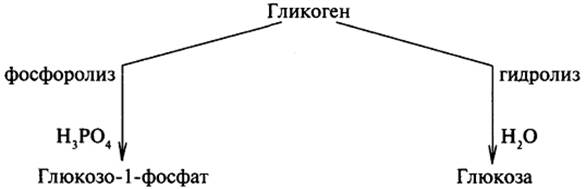 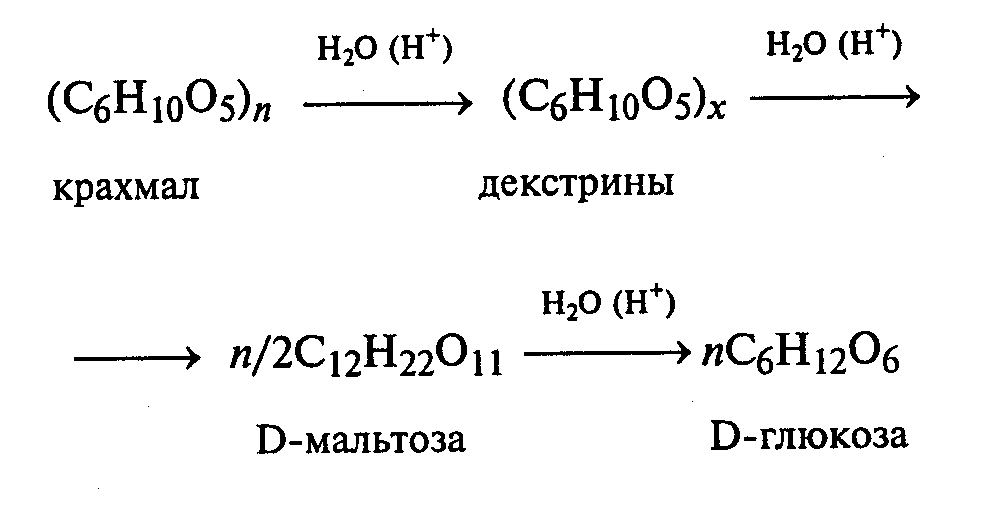 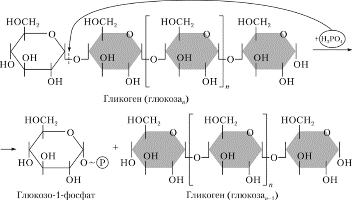 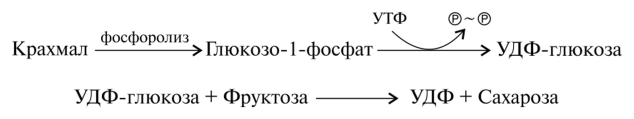 38. Распад дисахаридов. Гликозидазы действуют на дисахариды – мальтозу, лактозу, сахарозу, трегалозу и др., расщепляя их на индивидуальные моносахариды. Различают a- и b-гликозидазы, которые ускоряют реакции гидролиза соответственно a- и b-глюкозидов. Необходимо также отметить, что гликозидазы, кроме гидролазной активности, обладают также гликозилтрансферазным действием и ускоряют процессы переноса гликозильных остатков на те или иные субстраты. Аналогично крахмалу и гликогену ферментативному гидролизу подвергаются также и другие полисахариды: целлюлоза – под действием фермента целлюлазы, инулин – инулиназы, хитин – хитиназы и т.д. 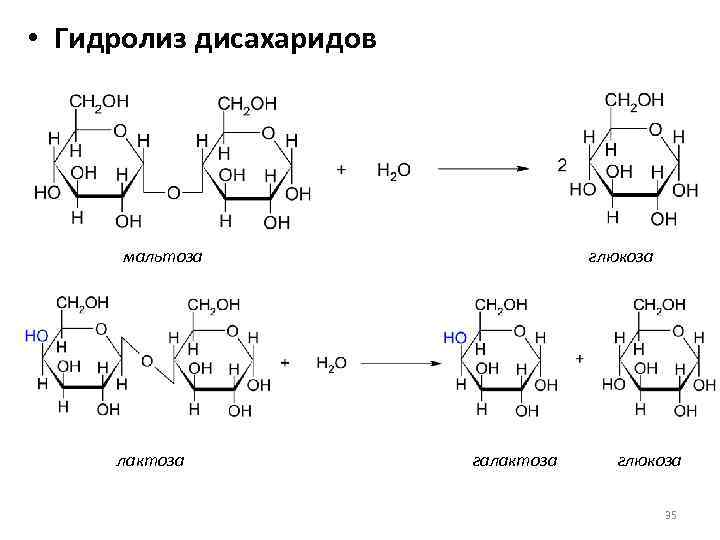 46. Синтез дисахаридов. Молекула сахарозы (свекловичный) состоит из шестичленного остатка а–глюкозы в пиранозной форме и пятичленного остатка б–фруктозы в фуранозной форме, соединенных через гликозидный гидроксил глюкозы: РИС 1 Молекула мальтозы (солодовый) состоит из двух остатков а-глюкозы в пиранозной форме, соединенных через 1– и 4–й атомы углерода: РИС 2 Молекула лактозы состоит из остатков б-галактозы и глюкозы в пиранозной форме, соединенных через атомы 1 и 4: РИС 3 Молекула трегалозы (грибной сахар) состоит из двух остатков а-глюкозы, связанных гликозидной связью через атомы 1 и 1 : РИС 4 Сахароза синтезируется из UDР-глюкозы и фруктозо-6-фосфата, которые образуются из триозофосфатов в цитозоле растительной клетки. 1. Глюкоза + АТР → глюкозо-6-фосфат + АДР (трансфераза) 2. Глюкозо-6-фосфат → глюкозо-1-фосфат (оксиизомераза) 3. УТР + глюкозо-1-фосфат → УДР-глюкоза + 2 Н3РО4 4. Фруктоза + АТР → фруктозо-6-фосфат + АДР 5. УДР-глюкоза + фруктозо-6-фосфат → УДР + сахароза-6-фосфат (сахарозосинтетаза) 6. Сахароза-6-фосфат → сахароза + Н3РО4 (фосфотаза) Аналогично проходит биосинтез лактозы. 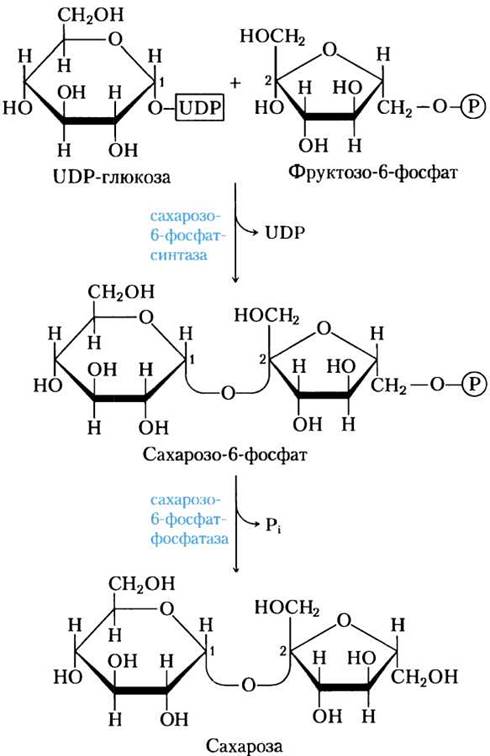  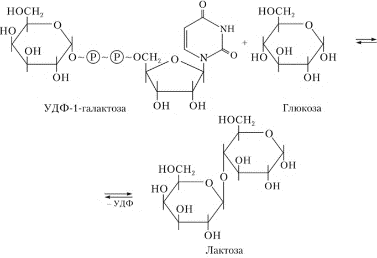 49. Синтез полисахаридов. Полисахариды синтезируются из моносахаридов с соблюдением ряда закономерностей. Во-первых, моносахаридные единицы активируются первоначально путем фосфорилирования, катализируемого киназой. Затем моносахаридное звено акцептируется одним из нуклеозиддифосфатов, а образующийся сахаронуклеотид выполняет роль переносчика гликозильного остатка (нуклеотидной «ручки») на удлиняющуюся цепь полисахарида. Биосинтез гликогена. Предшественниками для биосинтеза гликогена могут служить как свободная глюкоза, так и глюкозо-6-фосфат. В первом случае глюкоза фосфорилируется киназой с образованием глюкозо-1-фосфата, во втором — глюкозо-6-фосфат изомеризуется с участием фосфоглюкомутазы в глюкозо-1-фосфат. Следующую стадию (образование сахаронуклеотида) катализирует пирофосфорилаза. На следующем этапе гликозильная группа UDP-глюкозы переносится на концевую часть цепи гликогена (у нередуцирующего конца) и формируется очередная a(1→4)-гликозидная связь между первым атомом углерода добавляемого остатка глюкозы и кислородом гидроксила у четвертого атома углерода концевого остатка глюкозы цепи. Данную реакцию катализирует гликогенсинтетаза. С помощью этого фермента происходит постепенное удлинение линейных цепей гликогена, однако не может осуществиться образование точек ветвления, характерных для молекул гликогена (рис. 14.3). Функцию образования «ветвей» гликогена катализирует другой фермент —трансгликозилаза. После того как линейная цепь гликогена достигнет длины примерно в 10 остатков глюкозы, трансгликозилаза атакует гликозидную связь в каком-либо месте цепи и переносит концевой олигосахаридный фрагмент, содержащий 6—7 гликозильных звеньев, на свободную 6-гидроксильную группу остатка глюкозы той же или другой цепи. Так катализируется образование a(1→6)-гликозидной связи, и в молекуле гликогена появляется точка ветвления (рис. 14.4). Аналогичным образом в клетках растений осуществляется синтез крахмала. Синтез гликогена протекает в клетках печени и мышц животных и человека. Этот процесс ограничен возможностями ферментов в этих тканях и прекращается после синтеза гликогена в количестве 5—6% массы печени и 1—2% массы мышц. Поскольку общая масса мышечной ткани больше массы печени, то основной запас гликогена сосредоточен в мышцах. Подсчитано, что общего количества гликогена в организме хватит на одни сутки полного голодания при условии умеренной физической нагрузки. 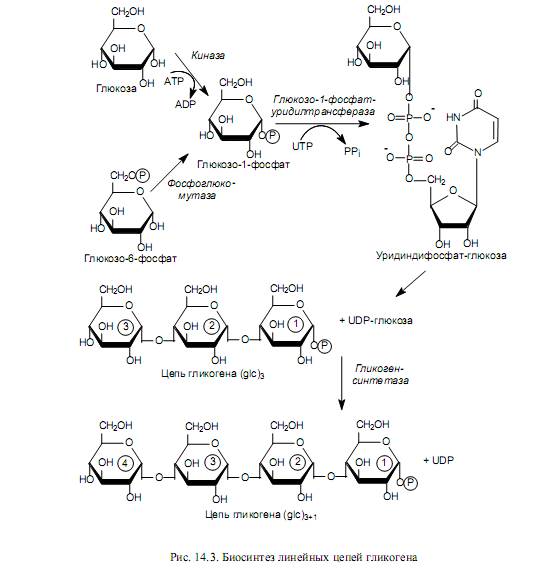 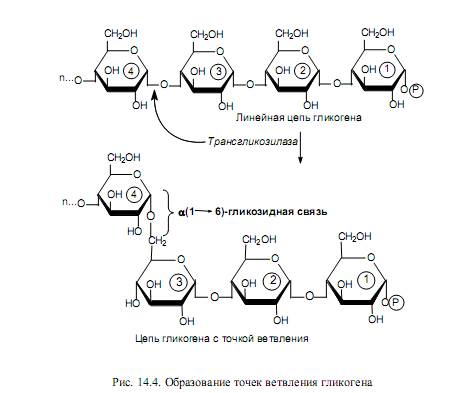 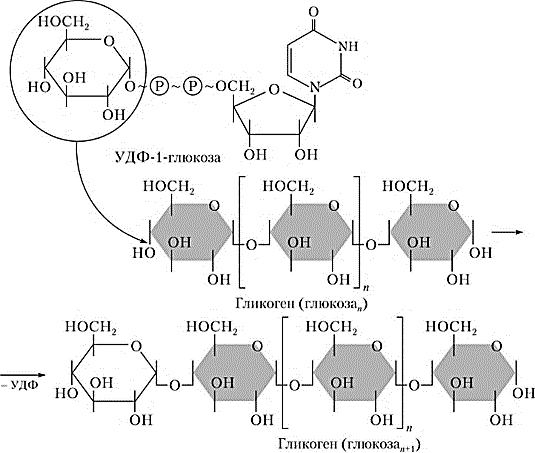  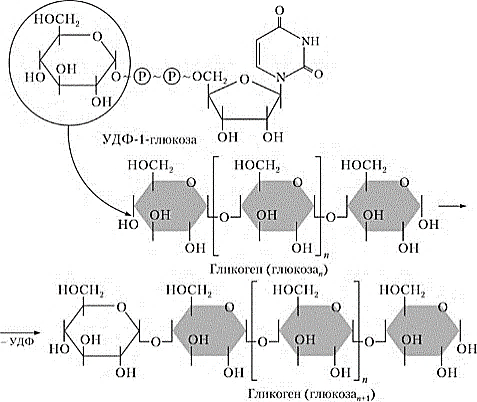 |
