Шпаргалка по кристаллохимии экзамен. Кристаллохимия испр экз. 1. Кристаллография как наука. Понятие о кристал, аморф сост вв. Основные сва кристалл сост
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
В крист.выс.кат нет един направл.,хаарк-ным признаком 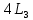 .Ни один класс не будет иметь 4оси 3-го порядка.Анизотропия сво-в выражена слабее-в разных направл.свой-ва разные.Многие физ.сво-ва (теплопроводность,электропроводность,показатель преломления)-они изотропны.Кристаллы им еют изомерич.форму(вписываются в шар Средн.кат.-одно единичное направл. Относятся –многогранники.Анизотропия свой-в этих кристаллов гораздо сильнее,чем у выс.кат. Низшая кат. -у них нет осей,кроме осей 2-го порядка, самые несимметричные, анизотропия больше выражена,чем в дургих категориях. .Ни один класс не будет иметь 4оси 3-го порядка.Анизотропия сво-в выражена слабее-в разных направл.свой-ва разные.Многие физ.сво-ва (теплопроводность,электропроводность,показатель преломления)-они изотропны.Кристаллы им еют изомерич.форму(вписываются в шар Средн.кат.-одно единичное направл. Относятся –многогранники.Анизотропия свой-в этих кристаллов гораздо сильнее,чем у выс.кат. Низшая кат. -у них нет осей,кроме осей 2-го порядка, самые несимметричные, анизотропия больше выражена,чем в дургих категориях._______________________________________________ 8. Размеры атомов и ионов. Эффективные и действительные размеры. Зависимость их от положения элемента в периодической системе для s-, p-, f- элементов, от координационного числа заряда. Поляризация ионов. В кх принято пользоваться не орбитальным радиусами (показывают расстояние от ядра до максимума орбитальной оболочки), а эффективными радиусами(это есть сфера действия атома, то есть минимальное расстояние на которое центры сфер атомов могут приблизиться к поверхности сфер соседних атомов). Размеры ионов и атомов в группах увел-ся с ростом их порядкого номера, т.к. число электронных оболочек вокруг ядра увел-ся. Радиус уменьшается с увеличением их зарядов, так как по мере роста числа удаленных электронов ядро с большей силой притягивает электроны. Размеры одного и того же элемента могут изменятся от заряда. Ионный радиус уменьшается с ростом положительного заряда, и увелич-ся с ростом отрицательного заряда.  Ионные радиусы зависят от координационных чисел. Чем больше координац-е число, тем больше радиус. Группа лантаноиды. В этой группе идет уменьшение ионных радиусов с увеличением порядкого номера. Величина атома радиуса меняется в зависимости от поляризационной способности атомов. Поляризационная способность - это способность иона под действием внешнего электростатического поля деформироваться, смещая положение ядра относительно оболочки. Ионы с большим радиусом способны сильнее поляриз-ся, чем ионы с малыми радиусами, т.е. анионы способны больше поляриз-ся, чем катионы. Катионы имеющие малые радиусы и большие заряды, обладают большей поляриз-й способностью, чем анионы, но сами почти не поляризуются. Результатом поляризации обычно явл-ся умень-е ионных радиусов. Это может привести к умень-ю расстояния между частицами, изменению координ-го числа и структуры. _________________________________________________ 14.Полиморфизм. Структурные типы полиморфных превращений. Фазовые переходы I и II рода. Полиморфизм – это св-во некоторых в-в,способных существовать в нескольких кристаллических фазах, между собой по симметрии структуры и по св-вам. Каждая кристалическая модификация стабильна в определенной области температуры и давления, полиморфные модификации. Изменение внешних условий (температ давление хим обстановка) вызывают полиморфное превращения) Типы полиморфных превращений: -монотропный (необратимый процесс) алмаз->графит –энанотиотропный (обратимый) альфа-кварц->бета-кварц При фазовом переходе 1 рода энергия гибсса=0,энтальпия не равна 0, энтропия не равна 0, внутренняя энергия не равна 0 и в точке перехода наблюдают скачкообразные изменения этих в-в. При фазовом переходе 2 рода энергия гибсса=0,энтальпия =0, энтропия =0, внутренняя энергия =0 будут наблюдатся плавный переход, скачка не будет.  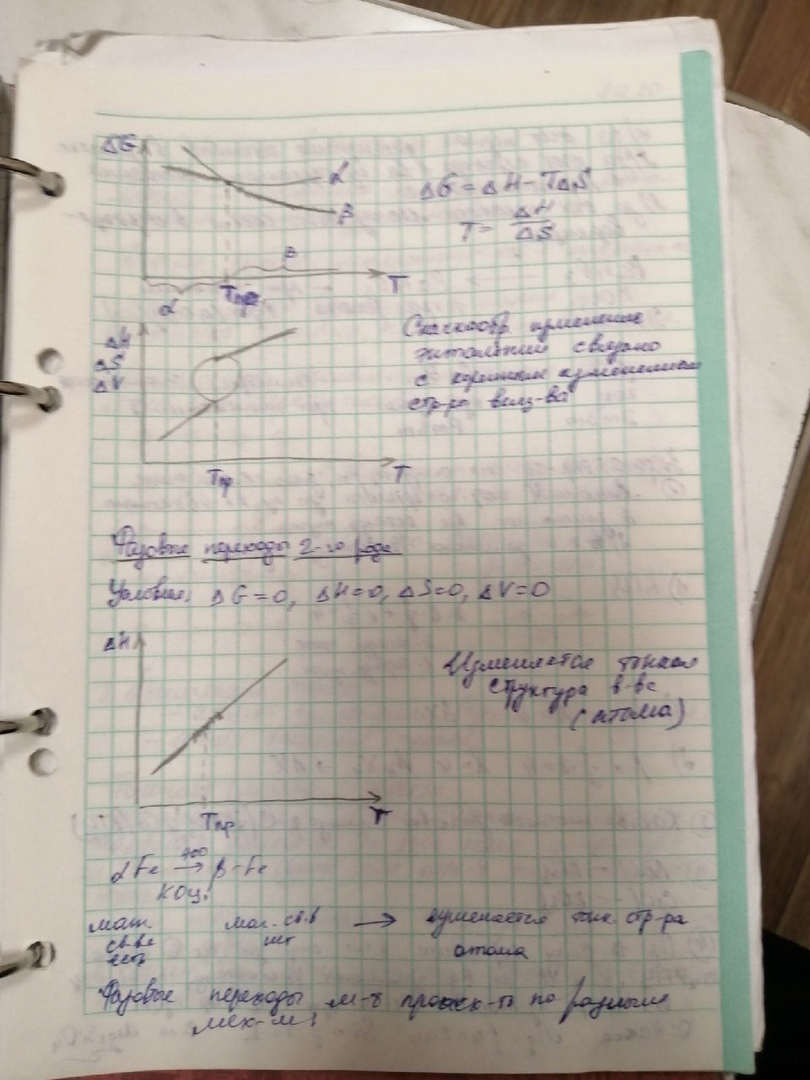 | 5.Формы кристаллических многранников.Простые и комбинированные формы. Простой формой называют совокупность граней,выводящихся др.из др.при помощи эл.симметрии кристалла.Формы бывают простые и комбинированные. Простая форма-это совокупность граней кристалла одинак.размера и формы,связанных элементами симметрии.Простые формы бывают:открытые и закрытые.Закрытые формы: все грани образ.замкнутое пространство.Закр.формы существуют в природе самостоят-но. Открытые формы-грани не образ.со всех сторон замкнутое простр-во.Такие формы не могут существовать в природе самост-но. Пинакоид(две грани паралл-ные)-призмы Комбинированная форма-совокупность неск-ких простых форм.(все призмы). моноэдр Простые формы низшей категории(7) . Открытые: Моноэдр (от греч. "моно"- один, "эдра"- грань) - простая форма, представленная одной единственной гранью. Моноэдром является, например, основание пирамиды. Пинакоид (от греч."пинакс"- доска) - простая форма, состоящая из двух равных параллельных граней, часто обратно ориентированных. Диэдр (от греч."ди" - два, "эдр"- грань) - простая форма, образованная двумя равными пересекающимися (иногда на своем продолжении) гранями, образующими "прямую крышу". Ромбическая призма (кирпичик) Ромбическая пирамида Из закрытых простых форм низших сингоний отметим следующие: Ромбическая дипирамида Ромбический тетраэдр Открытыми простыми формами средней категории будут(призмы и пирамиды их 25) Тригональная призма (от греч."гон"- угол) - три равных грани, пересекающихся по параллельным ребрам и образующих в сечении равносторонний треугольник; Тетрагональная призма (от греч."тетра"- четыре) - четыре равных попарно параллельных грани, образующих в сечении квадрат; Гексагональная призма (от греч."гекса"- шесть) - шесть равных граней, пересекающихся по параллельным ребрам и образующих в сечении правильный шестиугольник. В кристаллах ср.кат. встречаются так же закрытые простые формы: Дипирамиды - простые формы, образованные двумя равными пирамидами, сложенными основаниями. В таких формах происходит удвоение пирамиды, в зависимости от порядка оси могут иметь различные формы сечения. Они могут быть тригональными, дитригональными, тетрагональными, дитетрагональными, гексагональными и дигексагональными. Ромбоэдр - простая форма, которая состоит из шести граней в виде ромбов и напоминает вытянутый или сплющенный по диагонали куб.В сингониях ср. категории вероятны таке скаленоэдры,трапецоэдры и тетрагональные тетераэдры. ________________________________________________________ 9. Кристаллическая структура. Молекулярные, ковалентные кристаллы. Особенности координирования в них структурных единиц. Примеры. Многокомпонентные изоморфные системы. Под кристаллической структурой понимают пространственное расположение всех материальных частиц – атомов, ионов, молекул. Структура – конкретное расположение материальных частиц в пространстве. Кристаллы с ван-дер-ваальсовыми связями (молекулярные кристаллы).Инертны газы (Ar и Kr), а так же соединения, молекулы которых не обладают постоянным дипольным моментом (СО2, метан, бензол и др.) конденсируются с образованием кристаллов с небольшими энергиями межмолекулярных связей называемых ван-др-ваальсовыми. Молекулярных структуры - рыхлые структуры с малыми к.ч., с низкими темпер-ми плавления и испарения. К ковалентным кристаллам относят твердые тела, кристаллическая структура которых образована за счет ковалентной связи. Типичными представителями кристаллов с чисто ковалентной связью являются: алмаз, кремний, германий, серое олово, которые построены по типу структуры алмаза. Когда атомы в кристалле имеют близкие значения электроотрицательностей, образование связи происходит через обобществление валентных электронов, причем каждый атом вкладывает в связь один электрон. Типичные ковалентные кристаллы образованы элементами IV группы, такими как углерод, кремний и германий. Возникает между одинаковыми или близкими по свойствам атомами. Ков. связь обусловлена перекрыванием валентных орбиталей атомов, и осуществляется в результате обобществления пар электронов, которые принадлежат одновременно двум атомам. Связь эта строго направленная и насыщенная, т.к. число электронов у каждого атома ограниченно. Свойства: А) Низкие к.ч.=4 Б) Никогда не будет плотнейших упаковок В )Для них характерны высокие значения твердости, высокие температуры плавления. Г) Ков. связь –признак полупроводниковых свойств. Д) Энергия связи достаточно высокая, превышает энергию связи металлических структур. Изоморфные системы могут возникать в том случае, когда соединяющиеся между собой две плоские сетки разных веществ имеют двумерную структурную аналогию, т. е. трансляционную общность в двух направлениях. Частично изоморфные системы , подобно твердым растворам, образуют физически однородную общую фазу из. разных кристаллических веществ. ________________________________________________________ 15.Ионные кристаллы. Координационные принципы строения ионных кристаллов. Зависимость между видом координационного полиэдра (координационным числом) и отношением радиуса катиона (rk) к радиусу аниона (rа). Правило Магнуса-Гольдшмидта. Ионные кристаллы представляют собой кристаллы, состоящие из ионов, связанных между собой электростатическим притяжением. Ионные кристаллы обладают преимущественно ионной химической связью. Галогениды щелочных и щелочноземельных металлов являются типичными примерами ионных кристаллов Осуществляется электростатическим взаимодействием между положительными и отрицательными ионами, которые образуются из-за избытка или недостатка электронов у атома. Ионная связь малонаправленная и ненасыщенная (как и металлическая связь). Ненаправленность определяется тем, что каждый ион имеет сферическую форму электронного поля и может притягивать ионы противоположного знака по любому направлению. Ненасыщенность объясняется тем, что взаимодействие ионов противоположного знака не приводит к компенсации силовых полей и у них сохраняется способность притягивать ионы противоположного знака. Помним, что вокруг каждого иона располагается ограниченное число противоионов, это связано с координационным числом. Зависимость координац числа от отношение радиусов катионов rk и анионов ra
Правило магнуса – гольдшмитда определяет координац число катиона в зависимости от отношения радиуса катиона к радиусу аниона | ||||||||||||||||||||||
| 11. Гомо-гетеродесмические структуры. Примеры. Классификация кристаллических структур по типу химической связи и характер координации. Если в кристалле связь между всеми атомами одинакова, то такие структуры называют гомодесмическими. Примерами изодесмических структур являются структуры металлов, ионных (NaCl, шпинель) или ковалентных (алмаз) веществ. Когда в структуре кристалла сосуществуют несколько типов химической связи, структуры называют гетеродесмическими. Один тип связи проявляется внутри группировки атомов, другой — между атомами из соседних группировок или отдельными атомами и группировками. Типичным примером являются молекулярные органические кристаллы, в которых атомы внутри молекулы связаны прочными ковалентными связями, а молекулы объединяются между собой слабыми ванн-дер-ваальсовыми связями.
Принимая во внимание геометрию расположения материальных частиц в структуре кристалла — геометрический характер структуры — выделяют пять различных структурных мотивов, координационный, островной, цепочечный, слоистый и каркасный. Типы химической связи: 1. Металлическая связь. Характерна для элементов первых групп периодической системы и для интерметаллов. Она осуществляется взаимодействием свободных электронов и положительно заряженных атомных ядер. Все атомы отдают свои валентные электроны в общее пользование, т.е. свободные электроны обобществляются и легко перемещаются в между атомными ядрами, представляя своеобразный электронный газ. Только металлы имеют к.ч.=12. Основные свойства Ме: А) Имеют большие к.ч. (8, 12) Б) Плотнейшая упаковка. В) Все металлы обладают высокой тепло- и электропроводностью. Г) Обладают ковкостью. Д) Цвет, блеск. Энергия крист-1 решетки 10-20 ккал/моль. 2.Ионная связь (гетерополярная) Осуществляется электростатическим взаимодействием между положительными и отрицательными ионами, которые образуются из-за избытка или недостатка электронов у атома. Ионная связь малонаправленная и ненасыщенная (как и металлическая связь). Ненаправленность определяется тем, что каждый ион имеет сферическую форму электронного поля и может притягивать ионы противоположного знака по любому направлению. Ненасыщенность объясняется тем, что взаимодействие ионов противоположного знака не приводит к компенсации силовых полей и у них сохраняется способность притягивать ионы противоположного знака. Помним, что вокруг каждого иона располагается ограниченное число противоионов, это связано с координационным числом. Свойства: А) К.ч.=6-8 Б) Плотнейшая упаковка В) Для ионных структур характерны диэлектрические свойства, низкая электро- и теплопроводность, хрупкость. Г) Электропроводность осуществляется движением ионов. Энергия связи около 180 ккал/моль. (достаточно высокая). 3. Ковалентная связь. Возникает между одинаковыми или близкими по свойствам атомами. Ков. связь обусловлена перекрыванием валентных орбиталей атомов, и осуществляется в результате обобществления пар электронов, которые принадлежат одновременно двум атомам. Связь эта строго направленная и насыщенная, т.к. число электронов у каждого атома ограниченно. Свойства: А) Низкие к.ч.=4 Б) Никогда не будет плотнейших упаковок В) Для них характерны высокие значения твердости, высокие температуры плавления. Г) Ков. связь –признак полупроводниковых свойств. Д) Энергия связи достаточно высокая, превышает энергию связи металлических структур. 4. Ван –дер – Ваальсова связь. Характерна для молекулярных структур (рыхлые структуры с малыми к.ч., с низкими темпер-ми плавления и испарения). По электрическим свойствам они диэлектрики. К молекулярным структурам относят благородные газы в твердом состоянии, также кристаллы из насыщенных молекул. (O2, H2, HCl, метан, орган. соед.) К молекулярным структурам относят благородные газы в твердом состоянии, также кристаллы из насыщенных молекул. (O2, H2, HCl, метан, орган. соед.) 5. Водородная связь Энергия водородной связи примерно в 10 раз превышает энергию ванн-дер-ваальсовой связи, но в 10 раз слабее ковалентной связи. Атомы водорода соединяются с более электроотрицательными элементами. Когда атом водорода связывается с сильно электроотрицательным атомом, электронная пара, образующая связь, является настолько неравномерно смещенной, что атом водорода можно рассматривать как положительный заряд, способный притягивать атом с неподеленной парой электронов в другой молекуле. Атом водорода в кристаллах с водородными связями обычно располагается асимметрично между двумя такими электроотрицательными атомами. | |||||||||||||||||||||||
