Навигация по странице:24. Физические свойства минералов. Твердость, спайность, теплопроводимость, пьезо-, пироэлектричество, электрические свойства. ТвердостьШкала , оценивающая по 10 бальной шкалеКаждый минерал этой таблицы царапает предыдущий и царапается последующим минералом.Электрические свойстваПьезо-(давление)- электрический эффект ,состоит в том ,что под действием механического воздействия или деформации на концах полярных направлений кристалла возникают разноименные зарядыПиро-(температура)-электрический эффект состоит в том что под действием температуры на концах главных полярных направлениях кристалла, возникают разноименные электрические заряды19.Кристалл, его основные свойства.22.Структурные типы кристаллов25. Методы кристаллографического индицирования. Закон целых чисел. Индексы МиллераЧто бы описать положение граней кристалла нужно20.Классы симметрии. Вывод. Формулы и международные символы элементов симметрииТригон.: 1)Тетрагон.: 1 класс4 классСред.катег.гексагон.система: 1 класс3 класс23.Рост кристаллов. Гомогенное и гетерогенное зародышеобразование. Критический размер зародыша и его термодинамическое обоснование КристаллизацияГомогенное зародышобразованиеТермодинамика образования зародыша.Гетерогенное зародышеобразованиеЗакон постояннства углов26.Структура простых и сложных оксидов
|
Шпаргалка по кристаллохимии экзамен. Кристаллохимия испр экз. 1. Кристаллография как наука. Понятие о кристал, аморф сост вв. Основные сва кристалл сост
18.Пространственные решетки Бравэ, их обозначения, распределение по сингониям
1848г. Бравэ доказал, что всю кристаллографию в-ва можно описать 14 решетками.
Решетки Бравэ – элементарные ячейки, с помощью которых мы представляем себе распределение материальных частиц.
Выбор решеток Бравэ:
1. Симметрия решетки бравэ должна соответствовать симметрии кристалла
2. Решетка должна иметь максимально возможное кол-во прямых углов или равных углов (ромбоэдр)
3. Минимальный объем элементарной ячейки
По расположению материальных частиц все решетки подразделяются на 4 типа:
Примитивная (P мат частицы находятся в вершинах)
Объемно-центрированная (J мат частицы в вершинах и в центре объема)
Гранецентрированная (F мат ч в вершинах и центре каждой грани)
Базоцентрированная (С в вершинах и в центре 2 базовых граней)
Распр-е эл ячеек по сингониям:
Триклинная (P, a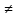 b b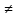 c, α c, α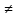 β β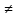 γ γ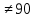 ) )
Моноклинная (P, C; a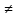 b b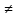 c, α c, α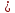 β β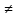 γ γ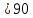 ) )
Ромбическая (все, ; a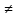 b b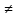 c, α c, α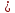 β β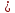 γ γ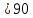 ) )
Тригональная (P, a=b=c, α=β=γ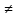 90) 90)
Гексагональная (P, γ=120, α=β=90, a=b=c)
Тетрагональная (P, J; a=b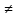 c, α=β=γ=90) c, α=β=γ=90)
Куб (J F)
________________________________________________
24. Физические свойства минералов. Твердость, спайность, теплопроводимость, пьезо-, пироэлектричество, электрические свойства.
Твердость-это есть сопротивление материала , проникновению его другими телами.
Метод шкала Маосс. Шкала , оценивающая по 10 бальной шкале:
1. Тальк Mg3[Si4O10] (OH)2
2. Каменная соль NaCL, гипс CaSO4*2H2O
3. CaCO3 (известковый шпат)
4. CaF2 Плавиковый шпат
5. Апатит (Ca5(PO4)3F
6. K[AlSi3O8] ортоклаз
7.α-кварц SiO2
8. Топаз Al2[SiO4]F2
9.Коруид α-Al2O3
10. Алмаз β-с
Каждый минерал этой таблицы царапает предыдущий и царапается последующим минералом.
От чего зависит твердость любого минерала:
Твердость кристалла зависит от его структуры, от коэффициента упаковки (удельный объем) и от зарядов материальных частиц который образует данный кристалл 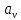 =∑ =∑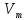 / / 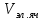 *100% *100%
1. Твердость тем больше чем меньше размеры атомов или ионов , при этом рассматриваются изоморфные структуры кристаллов (изоморфные-одинаковые формы и разные химические составы)
2. Твердость увеличивается с увеличением зарядов катионов, входящих в данный минерал(изоструктурный)
3. Твердость возрастает с увеличением плотности упаковки
4. (OH, F) входящие в одну и ту же структуру мелких ……. Приводит к увеличению твердости , а вкл. В эту структуру анионов OH‾ ,F‾,H2O приводит к уменьшению твердости
5. Твердость зависит от ретикулярной плоскости –это число структурных единиц на единицу площади плоской сетки
Спайность – способность кристаллов раскалываться при ударе по определенным плоскостям, которые называются плоскостями спайности.
Качество спайности характеризуется терминами:
- весьма совершенная спайность (слюда)
- совершенная спайность (кальцит)
- хорошая спайность (полевой шпат)
- несовершенная спайность (апатит)
Теплопроводность -это явление , связанное с переносом тепла, это свойство зависит от симметрии кристалла
В кубических кристаллах , в j параметры элементарной ячейки равны между собой (а=в=с) такие как и в аморфных телах скорость распространения тепла во всех направлениях одинаковы , поэтому изометрическая поверхность таких кристаллов представляет собой сферу
Кристаллы средний категории (тригональная, тетрагональная, гексагональная) –изометрическая поверхность представляет собой эллипсоидальное вращение
Кристаллы низший категории (а≠в≠с) (триклинная, моноклинная, ромбическая) –получаем трехслойный эллипсоид.
Электрические свойства - Минералы делятся на 2 группы: проводники,непроводники
Эти свойства можно связать с типом химической связи. Проводниками являются минералы с металлической связью. Непроводники минералы с ковалентной или ионной св
язью. Тело проводит электрический ток если имею электрические заряды (ионы и ē)
Проводники-это тела , в j электрический заряд может перемещаться по всему ее объему
Проводники делятся на 2 группы: проводники 1 рода-это металлы перемещение зарядов не сопровождается химичесим превращением , проводники 2 рода –расплавленные соли и растворы –перемещение в них зарядов ведет к химическим превращениям
Диэлектрики-тела j не проводят электрический заряд
Полупроводники-их проводимость сильно зависит от внешних условий( ТЕМПЕРАТУРА)
Пьезо-(давление)- электрический эффект ,состоит в том ,что под действием механического воздействия или деформации на концах полярных направлений кристалла возникают разноименные заряды
Отсутствует полярное направление-нет центр симметрии
Присутствует полярное направление –есть центр симметрии
Пьезо-электрики служат электромеханическими преобразованиями , при помощи них электрическая энергия превращается в механический и наоборот
Пиро-(температура)-электрический эффект состоит в том что под действием температуры на концах главных полярных направлениях кристалла, возникают разноименные электрические заряды
Причина эффекта: при изменении температуры кристалла анизотропа изменяется его размеры, из-за изменения межатомных расстояний и валентных узлов это приводит к изменению величины и положения элементарных диполей. Изменяется суммарный момент кристалла и поверхностная плотность заряда, то есть возникает пироэлектрический эффект.
19.Кристалл, его основные свойства.
Кристалл- это твердое тело, атомы и молекулы которого расположены в определенном порядке.
Основные свой-ва кристаллического состояния:
1.Однородность- кристалл наз-ся однородным, если для любой точки,взятой внутри него найдется др. такая точка , в которых сво-ва совершенно одинак., причем они отстоят др. от др. на некотором конечном состоянии 0,5нм.
2.Анизотропия – это количественное различие свой-в кристаллов в разных направлениях.
3.Самоограняемость-способность кристаллов, образовывать плоские грани при кристаллизации.
4.Симметрия- все кристаллы симметричны.
5.Только кристаллы обладают темпр. плавления и min внутр.энергией
______________________________________________
22.Структурные типы кристаллов
Описывая структуру надо указать вид и размер частиц и расстояние между ними. Но так как многие структуры похожи между собой можно указать менее относительное расположение частиц в кристалле , а не абсолютные расстояния между ними . так определяется структурный тип кристалла-это характеристика относительного расположения структурных единиц в кристалле (атомы,молекулы,ионы,или их групп)
Структурный тип NaCl
Cl-плотнейшая упаковка
Na- в пустоты , 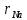 / /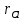 =0.54 =0.54
Система кубическая –гранецинтрированная а=в=с α=β=γ=90°
Решетка Бравэ кубическая гранецинтрированная
К.ч=3 к.м-октаэдр
Пространственная группа симметрии F m3m 3Pk4L36Pg6L23L4C
Указать позиции атомов в элементарной ячейке (1/2 1/2 0)
Структурный тип меди
1)кубическая система а=361пм
2)к.ч=12 к.м-кубоктаэдр
3) F m3m
4)плотнейшая упаковка
Структурный тип магний
Система-гексагональная
Тип решетки бравэ примитивная
К.ч=12 к.м-кубоктаэдр
P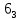 /mmc c-плоскость скользящего отражения , /mmc c-плоскость скользящего отражения , 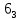 ось 6 ого порядка винтовая ось ось 6 ого порядка винтовая ось
Позиция атомов
Плотнейшая упаковка, пустоты свободны
Алмаз
1)кубическая система
2) решетка-гранецинтрированная
3)к.ч=4 тетраэдр
4) плотнейший упаковки нет
5) 3m
6) позиции
____________________________________________
25. Методы кристаллографического индицирования. Закон целых чисел. Индексы Миллера
Что бы дать точную характеристику кристаллу нужно определить расположение его граней относительно координатных осей.
Что бы описать положение граней кристалла нужно:
1.Выбрать кристаллографическую систему координат. Чтобы оси координат. Что бы оси координат (x,y,z) были параллельны ребрам кристалла и совпадали с осями координат или нормалями к плоскостям, если они есть.Для каждой системы существует своя система координат.
2. Выбрать масштаб измерений по каждой оси, из называют «единичные параметры» (осевые единицы)
а) если строение кристалла не известно то выбирают единичную грань , j пересекает при оси координат и отсекают на них отрезки (параметры) , j принимают за единицы измерения (111) (один,один,один)
б) Если строение кристалла известно, то за единичные параметры принимают параметры элементарной ячейки (a,b,c)
3. Затем измерить параметры искомой грани, периметрами единичной грани . Получаем параметры Вейсса: p,q,r
4. Но, в кристаллографии принято обозначать грани не параметрами Вейсса, а индексами Миллера (h,k,l=1/p: 1/q: 1/r)
Надо взять отношение обратное найденным, привести их к общему знаменателю.
Закон целых чисел: Для любых двух граней реального кристалла двойные отношения параметров, равны отношению целых чисел.
Индексы Миллера — кристаллографические индексы, характеризующие расположение атомных плоскостей в кристалле. Индексы Миллера связаны с отрезками, отсекаемыми выбранной плоскостью на трёх осях кристаллографической системы координат (не обязательно декартовой).
Таким образом, возможны три варианта относительного расположения осей и плоскости:
плоскость пересекает все три оси
плоскость пересекает две оси, а третьей параллельна
плоскость пересекает одну ось и параллельна двум другим
|
20.Классы симметрии. Вывод. Формулы и международные символы элементов симметрии
Существует 32 класса симметрии. Они описывают все возможные для кристаллов комбинации известных элементов симметрии.
При выводе классов симметрии основным элементом является ось симметрии. Затем к этой оси поочередно добавляются другие элементы симметрии, при этом ось симметрии должна оставаться единичным
Ось симм: n (1,2,3,4,5,6)
Плоскость: m
n*m взаим паралл
n/m вз перпенд
n/m1m2 – 1m перп n, 2: m паралл n
Сред категория: 1. Единич напр (3,4,6), 2. Коорд элементы симметрии, 3 Диаг Э.С.
(препдочтение отдается плоскостям)
Высш категория: 1. Кординат Э.С (всегда 3)плоскости, оси; 2. «3» (4L3), 3. Диагон Э.С (всегда 6)
(предпочтение плоскостям)
Низшая: 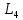 4 4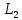 5PC=4/mm (4/mmm) 5PC=4/mm (4/mmm)
mmm=3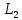 3PC 3PC
23=3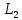 4 4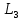
3m=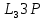
m3=3P4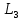 3 3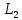 C C
Средняя катег. делится на тригон.,тетрагон. и гексагон.Каждая сист. подразд-ся на классы. Тригон.:
1)класс-примитив., ось симм.-L3.2)класс центральный-к оси симм. + центр симм. = 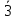 (L3C).3)класс планальный - +вертик. пл-сть = 3m(L33P).По 3 теореме 3 пл-сти 4 класс-аксиальный, + ось симметрии ⟂-ую и получаем 32(L33L2).из теор.4-в классе планаксиальном + центр симметрии и получаем (L3C).3)класс планальный - +вертик. пл-сть = 3m(L33P).По 3 теореме 3 пл-сти 4 класс-аксиальный, + ось симметрии ⟂-ую и получаем 32(L33L2).из теор.4-в классе планаксиальном + центр симметрии и получаем 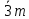 (L33L23PC).По следствию из теории при наличии центра симм. кол-во четных осей = числу пл-стей. (L33L23PC).По следствию из теории при наличии центра симм. кол-во четных осей = числу пл-стей.
Тетрагон.: 1 класс(примитив.), где ось симм. L4; 2 класс – к оси симм. + центр симм. 4/m (4PC), по теор. 2а появ-ся пл-сть симметрии;3 класс - +вертик. пл-сть 4mm (L44P) по теор. 3 появ-ся 4 плос-ти симметрии;4 класс(аксиальный) - + ось симм. ⟂ и получ. 422(L44L2) (из теор. 4); 5 класс(планаксиальный) - + центр симм. получ. 4/mmm (L44L25PC) по следств. из теор. число пл-стей 5;6 класс (инверсионно-примитив.) – инверс. ось 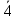 ( (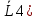 . .
Сред.катег.гексагон.система:
1 класс(примитив.) – присут. ось симм.L6; 2 класс(централный) – где к оси + центр симм – 6/m (L6PC) по теор. 2а появ. пл-сть симм.;3 класс (планальный) - + вертик. пл-сть = 6mm (L66P) из теор. 3 появл. 6 пл-стей симм.;4 класс(аксиальн.) - + ось симм. ⟂ = 622 (L66P) из теор. 4; 5 класс(планаксиальн.) - + центр симм. = 6/mmm (L66L27PC) по следств. из теор. число пл-стей 7;6 класс (инверс.-примит.) – инверс. ось 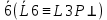 . .
Теоремы о сложении элементов симметрии С,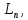 P, P,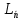 -элементы симметрии; Вершина грань ребро – элементы огранения кристалла -элементы симметрии; Вершина грань ребро – элементы огранения кристалла
Эти эл-ты симметрии могут складываться м/д собой. Сложение этих эл. симметрии приводит к появлению равнодействующего элемента.
________________________________________
23.Рост кристаллов. Гомогенное и гетерогенное зародышеобразование. Критический размер зародыша и его термодинамическое обоснование
Кристаллизация-процесс,в ходе которого из неупорядоченного состояния (система переходит) создается упорядоченная решетка кристалла.
Кристаллизация- идет при строго определенной температуре.
Две стадии:1) возниконовение субмикроскопического зародыша. 2) последующий рост этого зародыша, превращение его в макрокристали ограниченный поверхностями (гранями)
Гомогенное зародышобразование -самопроизвольное образование зародыша внутри метастабильной фазы.
Для того что бы возник зародыш способный к росту нужно создать условия переохлаждения или пересыщения.
Термодинамика образования зародыша.
С точки зрения термодинамических фаз переход расплав-кристалл возможен уже при бесконечно малом переохлаждении. Т.к этот переход идет с уменьшением энергии гиббса .На самом деле этот переход не наступает при Тплавл. Нужны большие охлаждения
Гетерогенное зародышеобразование (используется в промышленности )-зародыш образуется на частицах другой фазы (на стенках сосуда,на частицах примесей ,на затровках(кристаллы введенные в расплав или раствор))
Если во время фазого перехода кристаллическая фаза уже имеется то необходимость в работе образования зародышей отпадает и фазовый переход будет происходить при очень малых пересыщениях
Реальные кристаллы растут при незначительных пересыщениях так как они имеют нарушения. Поэтому частицам энергетически выгоднее присоединиться к тому месту где есть нарушение структуры.
Задержка фаз перехода заключается в том что процесс кристаллизации не чисто объемным процессом ∆Gv?, а в значительной степени определяется свойствами границы раздела кристалл. Зародыша с окружающим его расплавом. Для того что бы возник зародыш нужно затратить энергию, т.е работу на создание.
Выход винтовой дислокации на выход кристалла представляет собой ступеньку , к j легко может присоединиться частица. Присоединение этой частицы незалечивает ступеньку , рост происходит путем спирально-слоистого нарастания границ.
|
21.Закон постоянства углов. Уравнение Вульфа-Брэгга
Был открыт в 1669г Стенон
Закон постояннства углов гласит, что во всех кристал данные в-ва углы между однотипными гранями кристаллов остаются постоянными (Т,Р,хим обстановка)
1) Все кристаллы одного в-ва имеют одинаковую структуру
2) В настоящее время углы замеряют с помощью рентгенограмм
3) Т.к длины волн ренгеновских соизмеримы межатомное расстоян кристалов,то кристаллы явл-ся природными дифракционными решетками для этих лучей.
4) Закон диф ренгеновских лучшей описывается Вульфом-Брэгга: 2dsinO=n*лямбда (разность хода)=дельта, О(татарская) – угол падения ренгеновских лучей на сетку, n=1,2,3 лямбда-длина волны


_______________________________________________________
26.Структура простых и сложных оксидов
Простые оксиды – один вид Me+O2
Сложный оксиды – два вида Me+O2 (шпинель)
Me(в степени+2)O2(в степени-2) (MgO,CdO,BaO,NiO,FeO,MnO и тд) все относятся к структурному типу NaCl
BeO,ZnO – отличаются от структурного типа NaCl
Тип решетки бравэ – примитивная,гексагональная
Альфа-Al2O3 – корунд (Fe2O3,Cr2O3,V2O3)
O-создает плотнейшую упаковку
Al- в октаэдрические пустоты
2/3 пустоты будут заняты,Al- остальные свободны
MgAl2O шпинель (сложный оксид), тип решетки – гранецентрированая F, a=b=c, альфа=бета=гамма=90градусов – кубическая система, красные атомы =32, синие атомы=8
Октаэдрических пустот=32, тетраэдрических=64, пгс=Fd3m
|
|
|
|
 Скачать 0.84 Mb.
Скачать 0.84 Mb.