BKh_последняя 14. 1. Кровь. Понятие, физиологические функции
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
Нормальные значения общего белка сыворотки кровиВ норме содержание общего белка в сыворотке крови составляет у новорожденного до 1 мес — 46,0 — 68,0 г/л, уровень белка в сыворотке у недоношенных может быть намного ниже, чем у доношенных, - в пределах от 36 до 60 г/л, уровень общего белка сыворотки у детей в возрасте 1 — 12 мес — 48,0 — 76,0 г/л, у детей 1 — 16 лет — 60,0 — 80,0 г/л, у взрослых — 65,0 — 85,0 г/л. После 60 лет уровень общего белка в сыворотке крови ниже приблизительно на 2 г/л. Клиническое значение определения общего белка сыворотки кровиОбщий белок сыворотки крови является лабораторным показателем, отражающим состояние гомеостаза. Белки сыворотки крови играют очень важную и многообразную роль. Благодаря им поддерживается вязкость и текучесть крови и формируется ее объем в сосудистом русле, а концентрация белка обеспечивает плотность плазмы крови, что позволяет форменным элементам удерживаться во взвешенном состоянии. Белки сыворотки крови осуществляют транспортные (связывание гормонов, минеральных компонентов, липидов, пигментов и т. п.) и защитные (иммуноглобулины, опсонины, белки острой фазы и др.) функции, участвуют в регуляции кислотно-щелочного состояния организма, являются регуляторами свертываемости крови и антителами. Поэтому содержание общего белка является очень важным диагностическим параметром при целом ряде заболеваний, особенно связанных с выраженными нарушениями метаболизма. В клинической практике довольно часто встречаются состояния, характеризующиеся изменением концентрации общего белка сыворотки крови. Увеличение концентрации общего белка в сыворотке крови носит названиегиперпротеинемии, а снижение — гипопротеинемии. ГиперпротеинемияУвеличение общего белка в сыворотке крови может быть относительным и абсолютным. Относительная гиперпротеинемия связана с уменьшением содержания воды в сосудистом русле, к чему могут приводить следующие состояния: тяжелые ожоги; генерализованный перитонит; непроходимость кишечника; неукротимая рвота; профузный понос; несахарный диабет; хронический нефрит; усиленное потоотделение; диабетический кетоацидоз. Абсолютная гиперпротеинемия встречается редко. При этом увеличение общего белка в сыворотке крови может быть связано с синтезом патологических белков (парапротеинов), повышением синтеза иммуноглобулинов или усиленном синтезе белков острой фазы воспаления. Абсолютная гиперпротеинемия наблюдается при следующих заболеваниях: парапротеинемических гемобластозах (миеломная болезнь, болезнь Вальденстрема, болезнь тяжелых цепей) — отмечается значительное — до 120 — 160 г/л - возрастание концентрации общего белка; болезни Ходжкина; хроническом полиартрите; активном хроническом гепатите; острых и хронических инфекциях; аутоиммунных заболеваниях; саркоидозе; циррозе печени без выраженной печеночно-клеточной недостаточности. ГипопротеинемияСнижение концентрации общего белка в сыворотке крови также может быть относительным и абсолютным. Относительная гипопротеинемия, как правило, связана с увеличением объема воды в кровеносном русле и наблюдается при следующих состояниях: водной нагрузке («водном отравлении»); прекращении отделения мочи (анурии); уменьшении диуреза (олигурии); внутривенном введении больших количеств раствора глюкозы больным с нарушенной выделительной функцией почек; сердечной декомпенсации; повышенной секреции в кровь антидиуретического гормона гипоталамуса - гормона, способствующего задержке воды в организме. Абсолютная гипопротеинемия, как правило, связана с гипоальбуминемией. При этом уменьшение концентрации общего белка в сыворотке крови возникает при: недостаточном поступлении белка в организм (голодание, недоедание, сужение пищевода, нарушение функции желудочно-кишечного тракта, например, воспалительного характера — энтериты, энтероколиты и др.); подавлении биосинтеза белка, сопровождающем хронические воспалительные процессы в печени (гепатиты, циррозы печени, интоксикации, атрофия печени); врожденных нарушениях синтеза отдельных белков крови (анальбуминемия, болезнь Вильсона-Коновалова, другие дефектопротеинемии — значительно более редко); повышенном распаде белка в организме (злокачественные новообразования, обширные ожоги, гиперфункция щитовидной железы (тиреотоксикоз), состояния после операции, длительная лихорадка, травмы, длительное лечение кортикостероидами); повышенной потере белка (нефротический синдром, гломерулонефрит, сахарный диабет, длительный (хронический) понос, кровотечения); перемещении белка в «третьи» пространства (асцит, плеврит). Уменьшение концентрации общего белка в сыворотке крови отмечается и при некоторых физиологических состояниях, например, при длительной физической нагрузке, у женщин в последние месяцы беременности и в период лактации. На уровень общего белка в сыворотке крови может оказывать влияние прием некоторых лекарственных препаратов. Так, например, кортикотропин, кортикостероиды, мисклерон, бромсульфалеин и клофибрат способствуют повышению концентрации общего белка в сыворотке, а пиразинамид, эстрогены — его снижению. На степень концентрации общего белка может оказывать влияние и положение тела: при изменении горизонтального положения тела на вертикальное концентрация общего белка повышается приблизительно на 10% в течение 30 минут. Пережатие сосудов во время взятия крови и «работа рукой» также могут привести к возрастанию концентрации общего белка в сыворотке крови. При интерпретации результатов определения общего белка сыворотки крови необходимо учитывать значение гематокрита — в ряде случаев это помогает отличить относительное изменение общего белка от абсолютного, а следовательно, правильно поставить диагноз и определиться с тактикой лечения. 16)Альбумины и глобулины сыворотки крови, содержание в норме, функции.Альбуминово-глобулиновый коэффициент ( Гезалян: не знаю чей вопрос, но тут была табл, которую я сознательно убрал, она есть в 15 вопросе) На долю альбуминов приходится более половины (55-60%) белков плазмы крови человека.Благодаря высокой гидрофильности , особенно небольшим размером молекул и знач конц в сыворотке, альбумину играют важную роль в поддержание онкотического давления крови .Известно, что концентрация альбуминов в сыворотке ниже 30 г/л выз знач изменения онкотического давления., что приводит к возникновению отеков. Альбумины выполняют ваажную ф-ию транспорта многих биологических активных веществ( в частности гормонов).Они способны связываться с холестерином , желчными пигментами.Значительная часть кальция в сыворотке крови также связана с альбинами. Глобулины – крупномолекулярные белки, количества их доходит до 3 % определяют иммунные свойства организма; определяют свертываемость крови; участвуют в транспорте железа и в других процессах. Альбумин - глобулиновый коэффициент — соотношение альбуминов и глобулинов крови, величина в норме относительно постоянная (1,5—2,3). 17)Ферменты крови. Происхождение ферментов крови ,диагностическое значение определения Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы секреторные, индикаторные,экскреторные. Секреторные ферменты, синтезируясь в печени , в норме выделяются в плазму крови, где играют опреленную физиологическую роль. Типичными представителями являются ферменты, участвующие в процессе свертывания крови и сывороточная холинэстераза. Индикаторные( клеточные) ферменты попадают в кровь из тканей , где они выполняют определенные внутриклеточные ф-ии. Один из них находится главным образом в цитозоле клетки ( ЛДГ, алдолаза), другие – в митохондрях (глутаматдегидрогеназа), третьи- в лизосомах (бета-глюкоронидаза, кислая фосфотаза). В физиологических условиях эти ферменты выделяются с желчью. Еще не полностью выяснены механизмы , регулирующие поступления данных ферментов в желчные капилляры. Особый интерес для клиники представляет исследование индикаторных ферментов в сыворотки крови, так как при повышении можно судить о функц состоянии и поражении различ органов( например печени, сердечной и скелетной мускулутуры) 18)Кининовая система, представители, физиологическая роль кининов.( не оч) Кинин-калликреиновая система — группа белков крови, играющих роль в воспалении, контроле артериального давления, коагуляции и возникновении болевых ощущений. Важнейшими компонентами данной системы являются брадикинин и каллидин. Полипептиды Брадикинин, действующий на В2 и в меньшей степени на B1 рецепторы, образуется из ВМК под действием калликреина. По химическому составу — нонапептид. Каллидин — декапептид, высвобождающийся из НМК при воздействии на него тканевого калликреина. Ферменты Калликреины (тканевой и плазменный) — сериновые протеазы, катализирующие образование кининов из кининогенов[4]. Прекалликреин служит предшественником плазменного калликреина. Он может катализировать образование кининов только после активации фактором Хагемана. Карбоксипептидазы присутствуют в двух формах: циркулирующей N-форме и связаной с мембраной M-формой. Ангиотензинпревращающий фермент (АПФ или кининаза II) инактивирует группу пептидов, включая брадикинин. Катализирует образованиеангиотензина II из ангиотензина I. Нейтральная эндопептидаза также инактивирует кинины. Кинины - группа олигопептидов с большим спектром физиологической активности, участвующих в регуляции тонуса сосудов , уровня артериального давления , проницаемости,болевых реакциях организма. Кинины образуются как эффекторные субстанции калликреиновой системы и являются связующим звеном между системами регуляции сосудистого тонуса исистемами свертывания крови и фибринолиза . В тканях млекопитающих идентифицированы четыре типа кининов: нонапептид брадикинин , каллидин , Mel-Lys- брадикинин и Т-кинин . Многообразна роль кининов в патологических процессах: воспаление , отек , нарушения гемодинамики , ишемическое повреждение миокарда , нефротический синдром , бронхиальная астма и др. 19)Белки острой фазы, представители, диагностическое значение Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах - полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахари-дом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать 20)Ренин-ангиотензивная система, состав, физиологическая роль 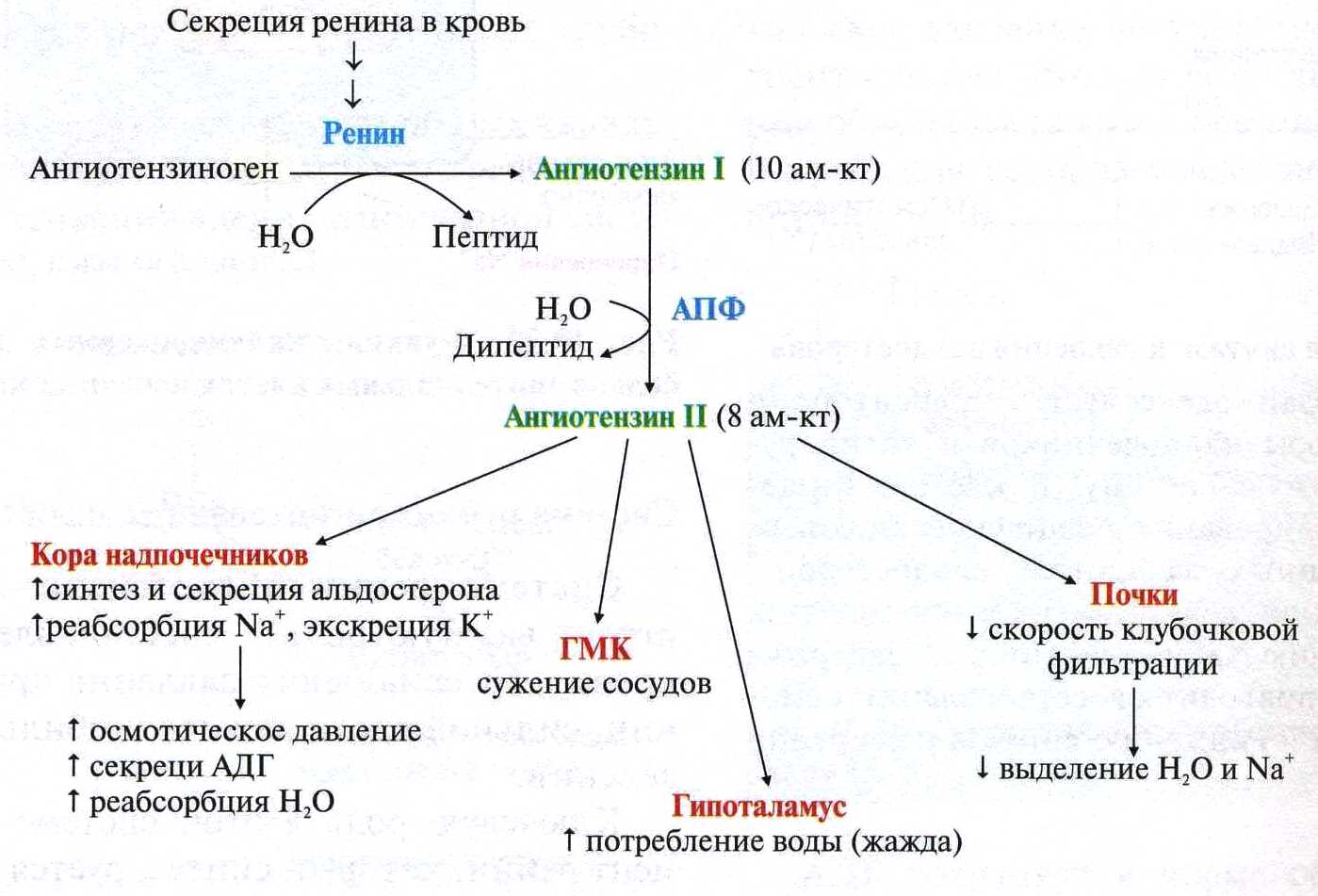  Вопрос 26. Противосвертывающая система крови. Основные первичные и вторичные природные антикоагулянты крови. Противосвертывающая система крови Физиологические ингибиторы свёртывания крови играют важную роль в поддержании гемостаза, так как они сохраняют кровь в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда. Тромбин, образующийся в результате реакций прокоагулянтного и контактного путей свёртывания крови, вымывается током крови из тромба. Он может инактивироваться при взаимодействии с ингибиторами ферментов свёртывания крови или активировать антикоагулянтную фазу, тормозящую образование тромба. Антикоагулянтная фаза. Свёртывание крови должно быть ограничено не только в пространстве, но и во времени. Антикоагулянтная фаза ограничивает время существования активных факторов в крови и инициируется самим тромбином. Этот этап представляет собой короткий каскад реакций, в котором кроме тромбина участвуют белок-активатор тромбомодулин (Тм), витамин К-зависимая сериновая протеаза протеин С, белок-активатор S и факторы Va и VIIIa (рис. 14-16). 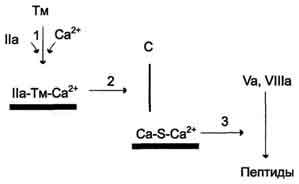 Рис. 14-16. Антикоагулянтная фаза. Тм - тромбомодулин; С - протеин С; Са - активный протеин С; S - протеин S; жирные линии - мембранно-связанный комплекс. 1 - тромбин (На) образует мембранный комплекс с белком тромбомодулином (Тм); 2 - тромбин в составе мембранного комплекса Иа-Тм-Са2+ активирует протеин С; 3 - активированный протеин С в составе ферментного мембранного комплекса Са-S-Са2+ гидролизует по 2 пептидные связи в факторах Va и VIIIa и превращает их в неактивные пептиды В каскаде реакций антикоагулянтной фазы последовательно образуются 2 мембранных комплекса IIа-Тм-Са2+ и Ca-S-Са2+. Тромбомодулин - интегральный белок мембран эндотелиальных клеток. Он не требует протеолитической активации и служит белком-активатором тромбина. Тромбин приобретает способность активировать протеин С только после взаимодействия с тромбомодулином, причём связанный с тромбомодулином тромбин не может превращать фибриноген в фибрин, не активирует фактор V и тромбоциты. Протеин С - профермент, содержащий остатки γ-карбоксиглутамата. Тромбин в мембранном комплексе IIа-Тм-Са2+ активирует частичным протеолизом протеин С. Активированный протеин С (Са) образует с белком-активатором S мембраносвязанный комплекс Ca-S-Са2+. Са в составе этого комплекса гидролизует в факторах Va и VIIIa по две пептидные связи и инактивирует эти факторы. Под действием комплекса Ca-S-Са2+ в течение 3 мин. теряется 80% активности факторов VIIIa и Va. Таким образом, тромбин по принципу положительной обратной связи не только ускоряет своё образование, но и, активируя протеин С, тормозит процесс свёртывания крови. Наследственный дефицит протеина С и S ведёт к снижению скорости инактивации факторов VIIIa и Va и сопровождается тромботической болезнью. Мутация гена фактора V, при которой синтезируется фактор V, резистентный к протеину С, также приводит к тромбогенезу. Антикоагулянтная фаза вызывает торможение каскада реакций свёртывания крови, а ингибиторы ферментов свёртывания инактивируют активные ферменты в кровяном русле. Ингибиторы ферментов свёртывания крови. Физиологические ингибиторы ферментов свёртывания крови ограничивают распространение тромба местом повреждения сосуда. Белок плазмы крови антитромбин III - наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Антитромбин III не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбо-образования в кровотоке. Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин - гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина. При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни. α2-Макроглобулин образует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется, и они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин. Антиконвертин (тканевый ингибитор внешнего пути свёртывания) синтезируется в эндотелии сосудов. Он специфически соединяется с ферментным комплексом Тф-VIIа-Са2+, после чего улавливается печенью и разрушается в ней. α1-Антитрипсин ингибирует тромбин, фактор ХIа, калликреин, однако он не рассматривается как важный ингибитор факторов свёртывания крови, α1-Антитрипсин в основном на тканевом уровне ингибирует панкреатические и лейкоцитарные протеазы, коллагеназу, ренин, урокиназу. Пептиды, образующиеся в результате протеолитической активации проферментов и профакторов, тоже обладают выраженными антикоагулянтными свойствами, но механизм их действия в настоящее время не выяснен. (далее минутка Покровского). Мне кажется надо просто знать те антикоагулянты, которые упомянуты в тексте и уметь отличить первичные от вторичных. Просто если все – то их много (см. ниже) Естественные антикоагулянты делят на первичные и вторичные. Первичные антикоагулянты всегда присутствуют в циркулирующей крови, вторичные — образуются в результате протеолитического расщепления факторов свертывания крови в процессе образования и растворения фибринового сгустка. Первичные: антитромбин III, протергликаны, кофактор гепарина II, альфа2-анитплазмин, а2-макроглобулин, а1-антитрипсин, с1-эстеразный ингибитор или ингибитор комплимента I, аннексин 5, протеин С, протеин S, ПРОТЕИН Z, тромбомодулин, плавающие рецепторы, аунтотела к факторам свертывания. К вторичным антикоагулянтам относят «отработанные» факторы свертывания крови (принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие мощным антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам. Вопрос 27. Фибринолитическая система крови. Механизм действия. Тромб растворяется в течение нескольких дней после образования. Фибринолиз - ферментативное расщепление волокон фибрина с образованием растворимых пептидов, которые удаляются из сосудистого русла. Разрушение фибрина в составе тромба происходит под действием сериновой протеазы плазмина. Плазмин образуется из плазминогена под действием активаторов. Неактивный профермент плазмина плазминоген синтезируется в печени, почках и костном мозге. |
