BKh_последняя 14. 1. Кровь. Понятие, физиологические функции
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
38. регуляция водно-электролитного обмена. Строение и функции альдостерона, вазопрессина и ренин-ангиотензиновой системы, механизм регулирующего действия В норме человек должен потреблять воды столько, сколько бывает необходимо, чтобы возместить суточную ее потерю через почки и внепочечными путями. Оптимальный суточный диурез 1400—1600 мл. При нормальных температурных условиях и нормальной влажности воздуха организм теряет через кожу и дыхательные пути от 800 до 1000 мл воды — это так называемые неощутимые потери. Таким образом, общее суточное выведение воды (моча и перспирационные потери) должно составлять 2200—2600 мл. Организм в состоянии частично покрыть свои потребности за счет использования образующейся в нем метаболической воды, объем которой составляет около 150—220 мл. Нормальная сбалансированная суточная потребность человека в воде от 1000 до 2500 мл и зависит от массы тела, возраста, пола и других обстоятельств Альдостерон - наиболее активный минера-локортикостероид, синтезирующийся в коре надпочечников из холестерола. АКТГ. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система. Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой. Механизм действия альдостерона В клетках-мишенях гормон взаимодействует с рецепторами, которые могут быть локализованы как в ядре, так и в цитозоле клетки. Образовавшийся комплекс гормон-рецептор взаимодействует с определённым участком ДНК и изменяет скорость транскрипции специфических генов. Результат действия альдостерона - индукция синтеза: а) белков-транспортёров Na+ из просвета канальца в эпителиальную клетку почечного канальца; б) Nа+,К+,-АТФ-азы, обеспечивающей удаление ионов натрия из клетки почечного канальца в межклеточное пространство и переносящей ионы калия из межклеточного пространства в клетку почечного канальца; в) белков-транспортёров ионов калия из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов. Суммарным биологическим эффектом индуцируемых альдостероном белков является увеличение реабсорбции ионов натрия в канальцах нефронов, что вызывает задержку NaCl в организме, и возрастание экскреции калия. Антидиуретический гормон Антидиуретический гормон (АДГ), или вазопрессин - пептид с молекулярной массой около 1100 Д, содержащий 9 аминокислот, соединённых одним дисульфидным мостиком Механизм действия Для АДГ существуют 2 типа рецепторов: V1 и V2. Рецепторы V2, опосредующие главный физиологический эффект гормона, обнаружены на базолатеральной мембране клеток собирательных трубочек и дистальных канальцев - наиболее важных клеток-мишеней для АДГ, которые относительно непроницаемы для молекул воды. В отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1,0-1,5 л в сутки). Связывание АДГ с V2(рис. 11-32) стимулирует аденилатциклазную систему и активацию протеинкиназы А. В свою очередь, протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в неё, образуя водные каналы. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство. Поскольку в результате происходит реабсорбция воды из почечных канальцев и экскреция малого объёма высококонцентрированной мочи (антидиурез), гормон называют антидиуретическим гормоном. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена Главным механизмом регуляции синтеза и секреции альдостерона служит система ренинангиотензин. Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки Система ренинангиотензинальдостерон. Ренин, протеолитический фермент, катализирует превращение ангиотензиногена (гликопротеина) в ангиотензин I (декапептид). 1 - ренин, протеолитический фермент, катализирует превращение ангиотензиногена (глйкопротеина) в ангиотензин I; 2 - ангиотензин I превращается в ангиотензин II под действием АПФ, отщепляющего два аминокислотных остатка от декапептида; 3 - ангиотензин II стимулирует синтез и секрецию альдостерона; 4 - ангйотензин II вызывает сужение сосудов периферических артерий; 5 - альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6, 7, 8, 9 - торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии - регуляция по принципу обратной связи. 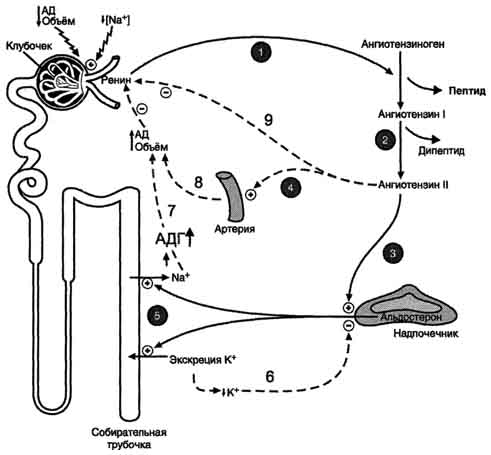 39. Механизмы поддержания объема, состава и pH жидкостей организма. Все что было до этого+ Важнейшие параметры вводно-солевого гомеостаза - осмотическое давление, рН и объём внутриклеточной и внеклеточной жидкости. Изменение этих параметров может привести к изменению АД, ацидозу или алкалозу, дегидратации и отёкам тканей. Основные гормоны, участвующие в тонкой регуляции водно-солевого баланса и действующие на дистальные извитые канальцы и собирательные трубочки почек: антидиуретический гормон (АДГ), альдостерон и предсердный натриуретический фактор (ПНФ). Уменьшение общего объёма жидкости, например в результате кровопотери, при обильной рвоте, диарее вызывает высвобождение ренина. Этому способствует также снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения внутрисосудистого объёма жидкости. В результате увеличивается продукция ангиотензина II, наиболее мощного стимулятора секреции альдостерона. Повышение концентрации альдостерона в крови вызывает задержку ионов натрия, что является сигналом для осморецепторов гипоталамуса и секреции из нервных окончаний передней доли гипофиза АДГ, стимулирующего реабсорбцию воды из собирательных трубочек. Ангиотензин II, оказывая сильное сосудосуживающее действие, повышает АД и, кроме этого, усиливает жажду. Поступающая с питьём вода в большей мере, чем это происходит в норме, задерживается в организме. Увеличение объёма жидкости а, также повышение АД приводят к устранению стимула, который вызвал активацию ренинангиотензиновой системы, секрецию альдостерона и восстановление объёма крови Действием предсердного натриуретического фактора является увеличение экскреции Na+ и понижение АД Состав регулируют органы имеющие рецепторы к различным веществам и минералам, которые в ответ на изб/недост выделяют либо гормон либо сам минерал (если орган явл депо) , кислотность также, только в основном регулируется почками. пониженная кислотность исправляется выделением кислых солей, а повышенная – бикарбонатов. 40. гипо- и гипергидратация водно-элетролитных пространств. Причины возникновения. ( объемный и сложный вопрос, не думаю что его будут так требовать, но я сократил и упростил как мог, если хотите подробностей и весьма интересных клинических картин, диагностики и влияния болезни гоу http://med-books.info/terapiya-anesteziologiya-intensivnaya/vodno-elektrolitnyiy-obmen.html Дисгидрии делят на две группы: дегидратацию и гипергидратацию. В каждой из них выделяют три формы: нормоосмоляльную, гипоосмоляльную и гиперосмоляльную. За основу в классификации взята осмоляльность внеклеточной жидкости, ибо она является основным фактором, определяющим распределение воды между клетками и интерстициальным пространством. Гипо- или Дегидратация. Изотоническая (нормоосмоляльная) дегидратация развивается вследствие потерь внеклеточной жидкости, по электролитному составу близкой плазме крови: при острых кровопотерях, обширных ожогах, обильном отделяемом из различных отделов желудочно-кишечного тракта, при просачивании экссудата с поверхности обширных поверхностных ран, при полиурии, при чрезмерно энергичной терапии диуретиками, особенно на фоне бессолевой диеты. Эта форма является внеклеточной, поскольку при присущей ей нормальной осмоляльности внеклеточной жидкости клетки не обезвоживаются. Гипертоническая (гиперосмоляльная) дегидратация отличается от предыдущей разновидности тем, что на фоне общего дефицита жидкости в организме преобладает недостаток воды. Этот вид дегидратации развивается при потерях свободной от электролитов воды (перспирационные потери), либо когда потери воды превышают потери электролитов. Гипотоническая (гипоосмоляльная) дегидратация характеризуется преобладанием недостатка в организме электролитов, что обусловливает снижение осмоляльности внеклеточной жидкости. Истинный дефицит Na+ может сопровождаться относительным избытком "свободной" воды при сохранении дегидратации внеклеточного пространства. Моляльная концентрация внеклеточной жидкости при этом снижена, создаются условия для поступления жидкости во внутриклеточное пространство, в том числе и в клетки головного мозга с развитием его отека. Гипергидратация. Она тоже может быть нормо-, гипо- и гиперосмоляльной. С ней анестезиологам-реаниматологам приходится встречаться значительно реже. Гипергидратация изотоническая чаще развивается вследствие чрезмерного введения изотонических солевых растворов в послеоперационном периоде, особенно при нарушении функции почек. Причинами этой гипергидратации также могут быть заболевания сердца с отеками, цирроз печени с асцитом, заболевания почек (гломерулонефрит, нефротический синдром). В основе развития изотонической гипергидратации лежит увеличение объема внеклеточной жидкости в связи с пропорциональной задержкой в организме натрия и воды. Гипергидратация гипотоническая обусловливается теми же факторами, которые вызывают изотоническую форму, но ситуация усугубляется перераспределением воды из межклеточного во внутриклеточное пространство, трансминерализацией и усиленным разрушением клеток. При гипотонической гипергидратации содержание воды в организме значительно увеличивается, чему также способствует инфузионная терапия безэлектролитными растворами. Гипергидратация гипертоническая возникает в результате чрезмерного введения в организм гипертонических растворов энтеральным и парентеральным путем, а также при инфузиях изотонических растворов больным с нарушением выделительной функции почек. 41. Патогенетически различаюттри типа отеков, развивающихся при разныхпоражениях почек. 1. Отеки при острой и хронической недостаточности почек. Основной механизм их развития — гидростатический (гиперволемический). Уменьшение скорости клубочковой фильтрации, характерное для почечной недостаточности, приводит к задержке натрия и воды в организме (положительный водный баланс) и, как следствие, к гиперволемии. Последняя, являясь причиной увеличения гидростатического давления в капиллярах, вызывает развитие отеков по механизму Старлинга. 2. Нефротические отеки. Основной механизм их развития — онкотический (гипопротеинемический). Нарушения клубочкового фильтра при нефрозе вызывают массивную протеинурию, в результате которой развивается гипопротеинемия и падает онкотическое давление крови. Это, в свою очередь, по механизму Старлинга вызывает переход воды из сосудов в ткани — развиваются отеки. 3. Нефритические отеки. Развиваются при остром и хроническом гломерулонефрите. Патогенез этих отеков сложный и включает следующие механизмы: а) воспаление клубочков -> застой крови в сосудах почек -> гипоксия юкстагломерулярного аппарата -> активация ренин-ангиотензинной системы -> секреция альдостерона -> задержка натрия в организме и повышение осмотического давления крови -> секреция антидиуретического гормона -> задержка воды -> гиперволемия -> отеки; б) воспаление клубочков -> нарушения почечного кровообращения -> уменьшение скорости клубочковой фильтрации -> задержка натрия и воды в организме -> гиперволемия -> отеки; в) воспаление клубочков -> увеличение проницаемости почечного фильтра -> протеинурия -> гипопротеинемия -> отеки. Почечаня гипертензия – артериальная гипертензия, патогенетически связанная с патологией почек. Почечная гипертензия относится к вторичным (симптоматическим) гипертензиям, встречается в 5 -10% всех случаев артериальной гипертензии. Характерными признаками заболевания помимо повышения артериального давления (выше 140/90 мм рт.ст.) является стойкое повышение диастолического давления, молодой возраст больных, высокая частота злокачественного течения гипертензии, низкая эффективность медикаментозного лечения. Классификация На практике часто используется классификация, согласно которой все почечные гипертензии разделяются на три большие группы. Ренопаренхиматозные гипертензии – возникают вследствие одностороннего или двустороннего диффузного поражения паренхимы (тканей) почек, в том числе при: хроническом пиелонефрите; поликистозе почек и других врожденных аномалиях почек; диабетическом гломерулосклерозе; хроническом гломерулонефрите; туберкулезном поражении почек; диффузных заболеваниях соединительной ткани (СКВ, системной склеродермии). Помимо этого, паренхиматозная почечная гипертензия может возникнуть вследствие воспалительных стриктур мочеточников или уретры, при мочекаменной болезни, при механическом сдавлении мочевыводящих путей (опухоли, кисты, спайки). Реноваскулярные гипертензии – возникают вследствие поражения одной или обеих почечных артерий. Частота выявления данной патологии составляет 1% всех больных артериальной гипертензией. Возникает при: атеросклеротическом поражении почечных сосудов (2/3 всех случаев); фибромышечной гиперплазии почечных артерий; аномалиях развития почечных артерий; механическом сдавлении. Смешанные почечные гипертензии– возникают при сочетанном поражении ткани и сосудов почек (при нефроптозе, опухолях и кистах почек, врожденных аномалиях почек и их сосудов). Как и почему развивается почечная гипертензия Механизм развития почечной гипертензии связывают с тремя основными моментами: задержка ионов натрия и воды; активация ренин-ангиотензин-альдостероновой системы (РААС); угнетение депрессорной системы почек (почечные простагландины и калликреинкининовая система (ККС)). Пусковым моментом для развития почечной гипертензии является уменьшение почечного кровотока и клубочковой фильтрации, как вследствие диффузных изменений паренхимы, так и при поражении сосудов почек. В ответ на снижение почечного кровотока в почках увеличивается реабсорбция натрия (а вслед за ним и воды). Задержка натрия и воды приводит к увеличению объема внеклеточной жидкости и компенсаторной гиперволемии, что в свою очередь сопровождается повышением концентрации натрия в стенке сосудов. Избыток натрия вызывает набухание сосудистой стенки и повышение ее чувствительности к ангиотензину и катехоламинам (альдостерону). Активация РААС также является одним из значимых звеньев развития почечной гипертензии. Ренин – протеолитический фермент, выделяемый почками. Сам по себе ренин не оказывает прессорного действия, однако, соединяясь с а2-глобулином сыворотки крови, он превращается в высокоактивное вещество – ангиотензин-ll. Ангиотензин-llобладает способностью прямо повышать уровень артериального давления, а также усиливает выделение надпочечниками гормона альдостерона, который стимулирует реабсорбцию ионов натрия в почках. Одновременно с описанными выше механизмами компенсаторные возможности почек, направленные на понижение артериального давления (путем активации выделения простагландинов и ККС) постепенно истощаются. Таким образом, возникает порочный круг, в результате которого развивается стойкое повышение артериального давления. Симптомы почечной гипертензии Поскольку почечная гипертензия часто развивается на фоне поражения почек при пиелонефрите, гломерулонефрите, сахарном диабете, клинические проявления будут связаны с основным заболеванием. Наиболее частыми жалобами являются боли в области поясницы, дизурические проявления, кратковременное увеличение температуры тела, жажда, полиурия, общая слабость и повышенная утомляемость. При исследовании мочи часто выявляется бактериурия, протеинурия и микрогематурия. Клинические проявления почечной гипертензии определяются степенью повышения артериального давления, изначальным состоянием почек, наличием вторичных осложнений при гипертензии (поражение сердца, сосудов сетчатки, головного мозга). Для почечной гипертензии характерно постоянное увеличение уровня артериального давления, особенно выражено повышение диастолического давления. У некоторых больных развивается злокачественный гипертонический синдром, при котором наблюдается спазм артериол и повышение общего периферического сопротивления сосудов. 42. Деятельность почек, направленная на поддержание постоянства внутренней среды организма, осуществляется путем активного ионного обмена по обе стороны канальцевой мембраны и выведения избытка анионов и катионов, в том числе при помощи адекватных реабсорбции и экскреции натрия, калия и воды. Реабсорбция и экскреция важнейших электролитов и воды очень тонко приспособлены к сохранению стабильных объемов внеклеточной жидкости с оптимальным содержанием растворенных в них веществ. Суточный водный рацион здорового человека, включая воду, содержащуюся в продуктах питания, составляет около 2000 мл и около 500 мл воды образуется в организме в процессе обмена веществ; из этого количества 900 мл выделяется через кожу и легкими, 100 мл выводится через кишечник и 1500 мл почками. Количество воды, выводимой почками, подвержено наибольшим колебаниям в зависимости от состояния и потребностей организма. В условиях максимального диуреза почки могут выводить до 12—15 л жидкости, и в условиях антидиуреза это количество может снижаться до 250—300 мл. Столь резкие колебания диуреза почти полностью зависят от характера и интенсивности канальцевой реабсорбции. |
