Ответы на зачет по общей химии. 1. место химии в формировании представлений о строении и законах функционирования различных систем человеческого организма. Связь химии с биологией, медициной и формацией. Основные этапы развития химии. Вклад отечественных ученых в развитие общей химии
 Скачать 188.85 Kb. Скачать 188.85 Kb.
|
|
30. основные положения протолитической теории кислот и оснований. Кислоты и основания Бренстеда. Константы кислотности и основности. Амфолиты. Изоэлектрическая точка. Показатели кислотности (рКа) и основности (рКв). Сопряженные пары. Согласно теории Бренстеда и Лоури: Кислотой называют всякое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов; Основанием называют всякое вещество, молекулярные частицы которого (в том числе ионы) способны присоединять протоны, т.е. быть акцептором протонов Согласно этой теории кислоты подразделяют на 3 группы: 1) нейтральные кислоты (соляная, серная, фосфорная) 2) катионные кислоты, представляющие собой положительные ионы, например катион аммония и гидроксония. 3) анионные кислоты, представляющие собой отрицательные ионы, например гидросульфат-анион, гидрофосфат - анион, дигидрофосфат – анион Подобного типа классификация имеется и для оснований:
растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот, которые могут быть как донорами, так и акцепторами протонов, являются амфолитами. Протон – ион атома водорода, не имеющий электронного уровня, такой ион обладает большой подвижностью и способностью внедряться в электронные уровни других молекул и ионов. Согласно этой теории кислотные свойства обнаруживаются только в присутствии оснований, а основные только в присутствии кислот. В результате кислота и основание должны быть сопряженной парой. А-Н + В: А- + В-Н+ Кислотность определяется константой равновесия протолитической реакции Ка = ([A-] [B-H+]) \ ([A-H] [B]) На практике для определения кислотности используют отрицательные логарифмы констант кислотности, называемые показателями кислотности. рКа = -ℓg Ка чем меньше рКа, тем сильнее кислота мерой основности служит константа основности В: + Н2О = В-Н+ + ОН- К = ([OH-] [B-H+]) \ ([B:] [H2O]) Кв = К [H2O] Кв = ([OH-] [B-H+]) \ [B:] Отношение произведения концентраций сопряженной кислоты и сопряженного основания к концентрации основания. Чем больше константа, тем сильнее основание. На практике используют показатель основности рКв = -ℓg Кв при некотором промежуточном значении кислотности суммарный заряд макромолекулы становится равным 0. это значение называется изоэлектрической точкой. 31. диссоциация воды. Ионное произведение воды. Водородный рН и гидроксильный рОН показатели среды. Пределы изменения рН для нейтральной, кислой и щелочной среды. рН среды важнейших биологических жидкостей. Кд [Н2О] = Kw – над ионным произведением воды. Константа диссоциации воды при 298К = 1,8 10-16 моль \ л [Н2О] 1000г \ 18г\моль 1л = 55,6 моль \ л Kw = 1,8 10-6 55,6 = 1 10-14 моль2 \ л2 [Н+][ОН-] = 1 10-14 моль2 \ л2 ионное произведение воды В нейтральной среде [Н+] = [ОН-] = 1 10-7 моль \ л В кислой среде[Н+] > [ОН-], т.е. [Н+] > 10-7 В щелочной среде[Н+] < [ОН-], т.е. [Н+] < 10-7 Для характеристики среды концентрации [Н+] и [ОН-] используют водородный показатель pH = - lg [Н+] и гидроксильный показатель pОH = - lg [ОН-] если прологарифмируем ионное произведение, то получим что рН + рОН = 14 [Н+][ОН-] = 1 10-14 рН + рОН = 14 рН = 7 – нейтральная среда рН < 7 – кислая среда рН > 7 – щелочная среда Все биологические жидкости имеют постоянство водородных ионов рН сыворотки крови = 7,4±0,1 рН желудочного сока = 0,9±0,1 рН слезной жидкости = 7,4 рН грудного молока = 6,6-6,8 рН слюны = 6,35-6,85 в организме имеется жидкость, в которую сбрасываются кислотные и основные остатки, ее рН колеблется в значительных пределах 4,8 – 7,5 – моча. При различных заболеваниях наблюдается смещение рН либо в кислую, либо в щелочную сторону. 32. буферное действие – основной механизм протолитического гомеостаза организма. Общий механизм действия буферных систем. Расчет рН протолитических систем. Способность сохранять постоянное значение рН называют буферным действием. Механизм буферного действия можно понять на примере ацетатной буферной системы. СН3СОО- \ СН3СООН в основе действия которой лежит кислотно-основное равновесие: Главный источник ацетат-ионов – сильный электролит CH3COONa: CH3COONa→ СН3СОО- + Na+ При добавлении сильной кислоты сопряженное основание СН3СОО- связывает добавочные ионы Н+, превращаясь в слабую уксусную кислоту: СН3СОО- + Н+↔ СН3СООН (кислотно-основное равновесие смещается влево, по Ле-Шателье) Уменьшение концентрации анионов СН3СОО- точно уравновешивается повышением концентрации молекул уксусной кислоты. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, и незначительно изменяется рН. При добавлении щелочи протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуют добавочные ионы ОН-, связывая их в молекулы воды: СН3СООН + ОН-↔ СН3СОО- + Н2О (кислотно-основное равновесие смещается вправо, по Ле-Шателье). В этом случае также происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, и незначительное изменение рН. Уменьшение концентрации слабой уксусной кислоты точно уравновешивается повышением концентрации анионов СН3СОО- . Аналогичен механизм действия и других буферных систем. Буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов. Расчет рН буферных смесей. Каждая из буферных смесей характеризуется определенной концентрацией ионов, которую буферная система стремится сохранить при добавлении кислот или щелочей. В основе расчета рН буферных смесей лежит закон действующих масс. 33. Буферные системы. Буферные системы I и II типов. Основные буферные системы I типа. Механизм действия буферных систем. Факторы, определяющие величину pH буферных систем. Расчет pH буферных систем I типа (уравнение Гендерсона-Гессельбаха). Расчет буферных систем II типа. Буферные системы – равновесные системы, поддерживающие постоянство pH при добавлении небольших количеств кислот или оснований; или при разбавлении. Буферное действие – способность сохранять постоянное значение pH. Буферные системы:
Буферные системы I типа:
Ацетатная: CH3COONa/CH3COOH Водородкарбонатная: NaHCO3/H2CO3
Карбонатная: Na2CO3/NaHCO3
Фосфатная: Na2HPO4/NaH2PO4 относят белковую и гемоглобиновую буферные системы Буферные системы II типа: Аммиачная: NH4OH/NH4Cl Механизм действия буферных систем I типа: Na2HPO4/NaH2PO4 при попадании кислоты реагирует соль: Na2HPO4 + HCl → NaCl + NaH2PO4 при попадании в организм основания: NaH2PO4 +NaOH → Na2HPO4 + H2O Механизм действия буферных систем II типа: NH4OH/NH4Cl NH4OH + HCl → NH4Cl + H2O NH4Cl +NaOH → NH4OH + NaCl pH буферных систем 1типа: pH= pKa +lg 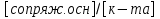 - уравнение Гендерсона-Гессельбаха - уравнение Гендерсона-Гессельбахапри добавлении кислоты в буферную систему pH можно рассчитать: pH= pKa +lg 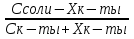 при добавлении основания: pH= pKa +lg 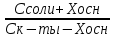 pH буферных систем II типа: pOH=pKb - lg 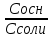 pH=14- pOH pH=14- pKb +lg 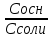 при добавлении кислоты Х: pH=14- pKb +lg 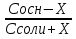 при добавлении щелочи Х: pH=14- pKb +lg 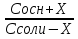 pH буферных растворов зависит от основания pKa и pKb, от отношения концентраций компонентов, но практически не зависит от разбавления H2O 34. Буферная емкость. Влияние добавления или щелочи на pH среды буферных систем. Буферная емкость по кислоте(Ва) и по щелочи(Вв). Факторы, определяющие буферную емкость. Буферная емкость – равна количеству вещества сильной кислоты или сильного основания, которое следует добавить к одному л буферного раствора, что бы изменить значение pH 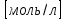 Буферная ёмкость по кислоте: Буферная емкость по основанию: Ва= 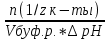 = =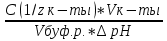 Вв= Вв=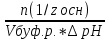 = =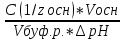 n(1/z к-ты) и n(1/zосн) – количество эквивалента кислоты и основания (моль) С(1/z к-ты) и С(1/z осн) – молярная концентрация эквивалента кислоты и основания ∆ pH = pH0 – pH pH0 и pH – значения pH буферного раствора до и после добавления кислоты или щелочи Буферная емкость зависит от факторов:
 =1 maxB =1 maxB
35. Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей. Бикарбонатная буферная система: NaHCO3/ H2CO3: Наиболее важная буферная система крови, на её долю в крови приходится больше 50% буферного действия. Кислоты, образованные в организме в результате метаболизма попадают в кровь, где связываются с бикарбонатной буферной системой: NaHCO3 + HCl⤑ NaCl + H2CO3 Угольная кислота переносится кровью в легкие, что обеспечивает выделение CO2 в воздух: H2CO3⤑ CO2 + H2O таким путем организм освобождается от избытка кислоты, накапливаемой соли и H2O удаляются с мочой и потом. Убыль бикарбоната пополняется в процессе тканевого дыхания. Если в кровь попадает щелочь: H2CO3 + NaOH NaHCO3 + H2O Расчет pH бикарбонатной буферной системы происходит по уравнению Гендерсона-Гессельбаха: pH= pKa (H2CO3)+lg 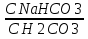 pKa (H2CO3)=6,36 pKa (H2CO3)=6,36 Фосфатная буферная система: Na2HPO4/NaH2PO4 Имеет наибольшее значение в биологических жидкостях(моче, крови, соке пищеварительных желез) и главным образом сосредоточено в почках. Расчет pH= pK (H2PO4-)+lg 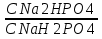 Имеет более высокую емкость по кислоте, чем по щелочи, поэтому она эффективно нейтрализует кислые метаболиты, поступающие в кровь. Т.к. буферная емкость по кислоте и по щелочи данной буферной системы мало отличается друг от друга поэтому фосфатная система участвует в нейтрализации основных продуктов Щелочь, попадая в почки, то происходит нейтрализация кислоты щелочью: NaH2PO4 + NaOH Na2HPO4 + H2O Белковая буферная система: Значительную долю буферной емкости крови обеспечивают белковые системы(гемоглобин, оксигемоглобин, белки плазмы) Благодаря белкам клетки и ткани организма проявляют значительные буферные действия. Молекула белков содержит остатки аминокислот : NH2 – CH(R) – COOH Аминокислоты – амфотерные электролиты. COOH COO- Белковая буферная система состоит из протеинов: Pt ↔ Pt : NH2 NH3 сопряженное основание(внутр. соль) Изоэлектрическая точка – значение pH при котором аминокислота или белки находятся в виде внутренней соли и количество COO- и NH3 равны. COOH COOH Pt + HCl ⤑ Pt NH3 NH3Cl солянокислый протеин При добавлении кислоты ионы Н+ связываются соленой формой. Количество незначительной кислоты повышается, а солевая форма белка понижается, поэтому pH остается постоянным. При добавлении щелочи к данному буферному раствору: COOH COONa Pt + NaOH ⤑ Pt NH3 NH3OH протеинат натрия Количество солевой формы белка повышается, а внутренние соли понижаются. pH практически не меняется Гемоглобиновая буферная система: Сосредоточена в эритроцитах. Состоит из четырех компонентов, поэтому обладает высокой буферной емкостью. ННв↔ НВ- + Н+ ННВ – гемоглобиновая кислота ННвО2 ↔Н+ + НВО2- ННвО2 – оксигемоглобиновая кислота Гемоглобиновая буферная система в организме работает в сочетании с бикарбонатной. В легких гемоглобин взаимодействует с О2 воздуха образуется оксигемоглобин: ННв + О2 ⤑ ННвО2 Оксигемоглобин как более сильная кислота взаимодействует с HCO3- с образованием более слабой H2CO3 ⤑ удаляется легкими ННв + О2 + HCO3- = НВО2- + H2O + СО2 процесс, протекающий в легочных капиллярах НВО2- + H2CO3 = О2 + ННв + HCO3- процесс, протекающий в тканевых капиллярах 36. Нарушение кислотно-щелочного равновесия. Ацидоз, алкалоз. Способы их устранения. При различных заболеваниях наблюдается смещение pH. При смещении pH крови в кислую область от нормы – ацидоз. В щелочную – алкалоз. Ряд патологических состояний характеризуется ацидозом, наблюдается при ИБР, сахарном диабете, заболеваниях желудка. Алкалоз при заболеваниях печени. Длительное смещение pH крови на 0,2, 0,3 приводит к смерти больного. При ацидозе в организм вводят стерильный раствор NaHCO3 4%, а при алкалозе вводят внутривенно раствор аскорбиновой кислоты. 37. Понятие о кислотно-основном состоянии организм. Гидролиз солей разного типа: образованных сильной кислотой и слабым основанием, сильным основанием и слабой кислотой и солей, образованных слабыми кислотами и основаниями. Примеры. Константа гидролиза. Степень гидролиза. Роль реакций гидролиза в биохимических процессах. Гидролиз АТФ. Кислотно-основное состояние определяется соотношением кислот и оснований во внутренней среде организма. Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений.
NH4Cl + HOH = NH3*H2O + HCl NH3+ + HOH = NH3 + H3O+ (pH<7)
CH3COONa + HOH = CH3COOH + NaOH CH3COO- + HOH = CH3COOH + OH- (pH>7)
NH4CN + HOH = NH3*H2O + HCN NH4+ + CN- + HOH = NH3*H2O + HCN Количественно гидролиз как КО-равновесие характеризуется степенью гидролиза αг и константой гидролиза Кг. Степень гидролиза измеряется отношением количества гидролизованного вещества к общему количеству растворенного вещества: αг = 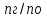 (доли или %) (доли или %)nг – количество гидролизованной соли nо – общее количество растворенной соли Константа гидролиза – концентрация недиссоциированных молекул воды в разбавленных расворах практически постоянна при Т= const, произведение Кс[Н2О] поэтому также будет величиной постоянной. Кс[Н2О] = 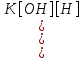 = Kг = KгФерментативный гидролиз, благодаря ему три основных компонента пищи – жиры, белки и углеводы – в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. Гидролиз АТФ: АТФ4- + Н2О = АДФ3- + НРО42- + Н+ АТФ функционирует в клетке как промежуточный продукт, переносящий энергию и сопрягающий реакции, сопровождающиеся выделением и потреблением энергии. Промежуточное значение свободной энергии гидролиза АТФ очень важно для его биологической функции и делает это соединение незаменимым переносчиком энергии, обеспечивающим круговорот энергии в клетке. |
