Ответы на зачет по общей химии. 1. место химии в формировании представлений о строении и законах функционирования различных систем человеческого организма. Связь химии с биологией, медициной и формацией. Основные этапы развития химии. Вклад отечественных ученых в развитие общей химии
 Скачать 188.85 Kb. Скачать 188.85 Kb.
|
|
48. Внутрикомплексные соединения. Строение и типы связей в молекуле внутрикомплексных соединений. Внутрикомплексные соединения – солеобразные соединения, характеризующиеся донорно-акцепторными и ковалентными связями между лигандами и комплексообразователем. Отличаются большой прочностью, т.к. лиганды захватывают центральный ион как клешни рака(клешневидный комплекс) Внутрикомплексные соединения относят комплексы, в которых лигандами являются органические молекулы. Пример: глицерин, этилендиамин, анион щавелевой кислоты с комплексообразователем например Сu Бис(этилендиамино)меди(II) СН2 – NH2 - - - - NH2 - СН2 Сu2+ СН2 – NH2 - - - - NH2 - СН2 Связь, соединяющие донорные атомы одной молекулы для удобства изображают в виде дуги. NH2 - - - - NH2 наиболее распространенны комплексные соединения в которых донорные атомы Сu2+ лигандов заключены в единое кольцо – цикл и представляют собой порфирины NH2 - - - - NH2 49. Природные внутрикомплексные соединения. Общие представления о строении гема, хлорофилла, каталазы, цианокобаламина, цитохромов. Метаболические реакции с участием металлоферментов. Их роль в биологических процессах. В качестве центрального атома может выступать Mg+2 (II) образуется хлорофилл (зеленый пигмент растений, играет ключевую роль в процессе фотосинтеза) N - - - - - N R1, R2, R3, R4 – углеводородные радикалы Mg донорные атомы N расположенные по углам квадрата, т.е. жестко скомбинированы в N - - - - - N пространстве, поэтому такие комплексы имеют прочную структуру. Ион Fe2+ входит в состав гемоглобина, у него 6 координационных вакансий: 4 удерживают его в плоскости кольца порфирина, а 2 направлены перпендикулярно к плоскости. О2 координационное число = 6 Комплексообразователь - Fe2+ N - - - - - N ⋮ Fe2+ ⋮ N - - - - - N N-глобин Гемоглобин выполняет две биологические функции:
Компонент гемоглобиновой буферной системы Каталаза: Фермент катализирующий разложение перекиси Н2О2 координационное число = 6 Комплексообразователь – Fe3+ N - - - - - N ⋮ Fe3+ ⋮ N - - - - - N ОН Механизм действия каталазы: katFeOH + H2O katFeOOH + H2O katFeOOH + H2O2 katFe– OH + O2 + H2O H2O2 + H2O3 2H2O + O2 2 H2O2 2H2O + O2 Цитохром: N - гистидин координационное число = 6 Комплексообразователь – Fe3+, Fe2+ N - - - - - N ⋮ Fe3+ ⋮ N - - - - - N S-метионин Участвует в переносе электронов в результате обратимого изменения валентности атома Fe, т.е. участвует в ОВР. Витамин В12 (цианокобаламин) CN координационное число = 6 Комплексообразователь – Со3+ N - - - - - N ⋮ Co3+ ⋮ N - - - - - N N-бензимидазол Биологическая роль: участвует в синтезе гемоглобина, вызывает анемию; противоанемическое, противовоспалительное действие; применяется при заболеваниях нервной системы. 50. Образование комплексных соединений как основа хелатотерапии. Применение комплексонов при отравлениях тяжелыми металлами. Конкретные механизмы связывания металлов при использовании в качестве комплексонов этилендиаминтетрауксусной кислоты(Трилона А и Б), унитиола, тетацина. Загрязнение окружающей среды токсичностью элементов тяжелых металлов(Ве, Рb, Cd) может приводить к отравлениям и токсичность таких соединений объясняется взаимодействиям тяжелых металлов с бионеорганическими комплексами. МбL + Мт Мб + МтL МбL – комплекс иона биогенного металла(Fe, Cu, Co, Zn) Мт – ион тяжелого металла (Hg, Pb, Cd) В настоящее время сложилось специальное направление в медицине, связанное с использованием лигандов для регуляции металла лигандного баланса. CH2 – SH CH2 – S l l Hg+2 CH – SH + HgCI₂ CH – S + 2HCI I l CH2 – SО3Na CH2 – SО3Na унитиол С избытком унитиола образуется комплекс с координационным числом =4(Cd+2, Pd+2) В качестве антидотов широко используются нуклесомы(ЭДТА) НООС – СН2 СН2 – СООН N – СН2 – СН2 – N НООС – СН2 СН2 – СООН трилон А Трилон Б Na2 – ЭДТА NaООС – СН2 СН2 – СООNa NaООС СН2 – СООNa N – СН2 – СН2 – N N – СН2 – СН2 – N НООС – СН2 СН2 – СООН СН2 СН2 I Са I О=С – О О – С = О тетацинкальций 51. Устойчивость комплексных соединений. Первичная и вторичная диссоциация комплексных соединений. Константы нестойкости и устойчивости комплекса. Константы устойчивости комплексных соединений. Внутренняя и внешняя структура комплекса сильно различается по устойчивости. В растворах комплексных соединений имеет место первичная и вторичная диссоциация. Первичная диссоциация – отщепление сферы внешней от внутренней протекает как у сильных электролитов практически полностью(необратимо) [Ag(NH₃)₂]Cl [Ag(NH₃)₂]+ + Cl- Вторичная диссоциация характеризует диссоциацию самого иона, а т.к. лиганды находятся во внутренней сфере и связаны с центральным ионом значительно прочнее, поэтому отщепляются лишь в небольшой степени(обратимый процесс) [Ag(NH₃)₂]+ Ag+ + 2NH₃ Вторичная стадия диссоциации подчиняется закону действующих масс и характеризуется константой нестойкости – характеризует неустойчивость комплекса иона. Kн = 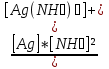 = 6,8 * 10-8 = 6,8 * 10-8Величина обратная Kн называется Куст Куст = 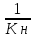 52. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни. Биогенные элементы - элементы необходимые для построения и жизнедеятельности клеток и организмов. Al, O, N, S, P, С, Са, Mg, К, Na, Сl, I, Mn, Со, Те, Мо, V, Fe, Sb, Br, F, Li Среди них наблюдают «10 металлов жизни»: Са, Mg, К, Na – I остов десятки сотни г, Fe, Со, Mn, Сu, Zn, Мо – II остов десятки доли г Zn – поджелудочная железа, половые органы, гипофиз I – щитовидная железа F – эмаль зубов Аs, Аl, V – волосы, ногти Са, Нg, Мb – почки Мn, Сr, Вr – гипофиз Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N Р – твердые ткани зубов в виде гидроксиолатитов В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям. 53. Классификация химических элементов в организме по Вернадскому. Роль макро – и микро- элементов в живом организме. Концентрирование химических элементов в органах, тканях и биожидкостях человека. Эндемические элементы. В зависимости от среды содержания элементов в живых организмах Вернадский разделил их на 3 группы:
Входят в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователя; участвуют в обмене веществ, процессах размножения, тканевом дыхании; участвуют в ОВР. Влияют на процесс кроветворения, проницаемость сосудов и тканей.
Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N Р – твердые ткани зубов в виде гидроксиолатитов. Са – в костной и зубной ткани NaCl – во внеклеточных областях К, Мg – во внутриклеточных областях Мg – твердые ткани зубов в виде Мg3(PO4)2 К, Na – в виде фторидов, в состав костной ткани В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям. F – кариес I – эндемические заболевания Эндемические заболевания: с аномалиями содержания некоторых элементов в почве, водоемах, той или иной биологической зоны. 54. Общая характеристика s-элементов. Валентные электроны. Изменение активности s-элементов в группе. Степень окисления. Щелочные металлы, их химические свойства. Особенности свойств лития. Оксиды, пероксиды, надпероксиды щелочных металлов. Биологическая роль натрия и калия. Натрий-калиевый насос. Соединения щелочных металлов, применяемых в медицине. Находятся в Iа и IIа групп главной подгруппы, а также Не. Валентными являются s-электроны. ns1 – I группа Н, Li, Na, Rb, Cs, Fe ns2 – II группа Be и щелочноземельные металлы: Mg, Са, Sr, Ва, Ra Свойства щелочных металлов: сверху вниз Радиус атомов в Iа подгруппе увеличивается Энергия ионизации уменьшается Сверху вниз растет активность. Исходя из строения атомы Iа группы проявляется степень окисления = +1, все металлы – восстановители, а их ионы в степени окисления +1 будут окислителями. Li – проявляет стабильную степень окисления = +1 тем не менее из-за наличия 2р оболочки. Химия Li отличается от химии его соседей по группе Li+1 – лучший комплексообразователь Все щелочные металлы энергично соединяются с кислородом, только Li образует оксид лития, а остальные металлы дают пероксиды и надпероксиды. Химические свойства:
4Li + O2 2Li2O 2Na + O2 Na2O2 К + O2 КO2 Пероксиды и надпероксиды являются солями сильных оснований и слабых кислот => подвергаются гидролизу Na2O2 +Н2О 2NaOH + Н2О2 КО2 + Н2О 2КОН + Н2О2 + О2 Пероксиды и надпероксиды сильные окислители используются для получения кислорода на космических кораблях и подводных лодках.
2Li + 2Н2О 2LiОН + Н2
Все соли щелочных металлов растворимы в воде, только литий образует плохорастворимые соли: Li3PO4, Li2CO3, LiF Концентрация ионов натрия внутри клетки в 15раз меньше, чем во внеклеточной жидкости, а концентрация ионов калия в 35 раз больше внутри клетки, чем вне её. Натрий-калиевый раствор обеспечивает перенос ионов, через плазматическую мембрану, против градиента концентрации за счет гидролиза 1 молекулы АТФ, 3 иона натрия выводят из клетки, а 2 иона калия поставляет внутрь клетки. Этот дисбаланс электрических зарядов служит при чиной возникновения разности потенциалов на плазматической мембране. Внутренняя сторона мембраны заряжена отрицательно по отношению к внешней поверхности мембраны. Na+ - необходим для сокращения мышц К+ - способствует расслаблению Избыток Na+ - гипертония, отеки Na+ - участвует в поддержании соматического давления(гомеостаза), обеспечивает кислотно-основное равновесие, регулирует водный обмен. Регулирует рН внутренней среды организма, участвует в передаче нервных импульсов через мембраны нервных клеток. К+ - распространен в печени, почках, сердце, крови, море: участвует в функционировании сердца, проведении нервных импульсов, участвует в обменных реакциях. Недостаток К – мышечная слабость, раздражительность, спазмы мышц Избыток К – возбуждение ЦНС, маниакальное состояние причина остановки сердца NaCl – используют дл промывания желудка, очистки гнойных ран, при отравлении Ag+ Li – в печени, почках, селезенке, легких, молоке, мышцах. Оказывает положительное влияние на больных с маниакальной депрессией, снижает эмоциональное напряжение (Li2CO3) NaHCO3 – при ацидозе, сахарном диабете, повышает кислотность желудочного сока, при воспалительных заболеваниях глаз, горла, за счет выделяющейся щелочи КСl – уменьшает возбудимость сердечной мышцы Na2SO4*10 Н2О – глауберова соль – расслабляющее средство 55. s-элементов llа группы. Степени окисления. Тип гибридизации атомных орбиталей. Щелочноземельные элементы. Особенности свойств бериллия. Биологическая роль ионов магния и кальция. Антагонизм ионов магния и кальция. Соединения магния и кальция, применяемы в медицине. Степень окисления +2 Ве, Mg, Са, Sr, Ва, Ra sp-гибридизация Ca, Sr, Ве – проявляют большие сходства между собой и называются щелочноземельными Ве – «стоит особняком» из-за наличия гелиевого экрана Амфотерность Ве: ВеО + 2НСl ВеСl2 + Н2О ВеО + 2NaOH + Н2О Na2[Ве(ОН)4] При сплавлении ВеО + 2КOH К2ВеО2 + Н2О Са+2 – регулятор внутриклеточных процессов: сокращение мышц, регуляции сердечного ритма, передача нервного импульса, участвует в свертывании крови, влияет на кислотно-основный баланс, оказывает влияние на активность эндокринной системы. Противовоспалительное действие. Избыток Са+2 – опасность остановки сердца, увеличивается свертываемость крови Mg+2 – биологические антагонисты ионов Са+2: поддерживает осмотическое давление внутри клеток; образует комплекс с АТФ, белками; входит в состав ферментов; с их участием формируются рибосомы, активируется процесс синтеза белка; способствует понижению артериального давления крови; усиливает перестатику кишечника; усиливает секрецию желчи. Са(С6Н11О6)2 – глюконат кальция – восполнение недостатка кальция СаСl2*6Н2О – кровеостанавливающее, противовоспалительное действие, антидот при отравлениях солями магния СаСО3 – антоцидное средство, при повышении кислотности желудочного сока МgO – «жженая магнезия» - антоцидное средство при повышенной кислотности желудочного сока МgO с МgO2 – «магний перекись» 85% и 15% антоцидное и бактериальное средство MgSO4*Н2О – «горькая соль» - успокаивающее, снотворное, слабительное средство Mg(ОН)2*MgCO3*H2О – «белая магнезия» - антоцидное, легкое слабительное средство 56. Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока. К d-блоку относятся 32 элемента, расположенные в ПТ с N по VII период с III по V группу побочных подгрупп. В побочных подгруппах сверху вниз увеличивается энергия ионизации, т.к. в этом направлении отмечается уменьшение радиуса, что объясняется тем, что валентные электроны уходят на предвнешний уровень => десжатие, поэтому в любой подгруппе химическая активность убывает сверху вниз. Все атомы d-элементов за исключением IIв группы имеют незавершенный электронный d-слой, этим объясняется набор разных степеней окисления d-элементов. 57. Общая характеристика d-элементов. Изменение химической активности d-элементов в подгруппах в направлении сверху вниз. Степень окисления, закономерности изменения кислотно-основных и окислительно-восстановительных свойств d-элементов зависимости от степени окисления. Роль d-элементов в организме. Характерные степени окисления для d-элементов, встречающихся в организме. Строение биокластеров. К d-блоку относятся 32 элемента, расположенные в ПТ с N по VII период с III по V группу побочных подгрупп. В побочных подгруппах сверху вниз увеличивается энергия ионизации, т.к. в этом направлении отмечается уменьшение радиуса, что объясняется тем, что валентные электроны уходят на предвнешний уровень => десжатие, поэтому в любой подгруппе химическая активность убывает сверху вниз. Все атомы d-элементов за исключением IIв группы имеют незавершенный электронный d-слой, этим объясняется набор разных степеней окисления d-элементов. Соединения с высшей степенью окисления проявляют кислотные и окислительные свойства. Низшая степень окисления обуславливает основные и восстановительные свойства d-элементов. Амфотерные свойства типичны для соединений с промежуточной степенью окисления. В группах с увеличением заряда ядра увеличивается устойчивость соединений с высшей степенью окисления. Сu – «металл жизни» микроэлемент, концентрируемый в печени, мозге, мышцах, надпочечниках. Ag – в организме, антисептик. В медицине используют AgNO3 – ляпис – обладает вяжущим противовоспалительным и антисептическим действием Au – противовоспалительное средство, лечит инфекционный полиартрит, туберкулез, кожные и венерические заболевания. Zn – повышает иммунитет Cr – регуляция синтеза жиров и обмена углеводов; влияние на усвояемость глюкозы и уровень сахара в крови; профилактика атеросклероза Мо+6, Мо+5 – содержатся в организме, входит в состав ферментов; катализирует окисление ксантина и гипоксантина до мочевой кислоты и альдегидов. Мn+2 – в организме образует комплекс с нуклеиновыми кислотами и аминокислотами, входит в состав ферментов, участвует в синтезе витамина С и В12 Степень окисления Сu +1,+2; Ag +1,+2; Au +3; Zn +2; Cr +2,+3,+6; Мо +6; Мn +2,+3,+4,+6,+7 Биокластеры – белковые молекулы образуют с d- элементами бионеорганические комплексы. Ион металла(металл-комплексообразователь) располагается внутри полости кластера, взаимодействуя с электроотрицательными атомами связывающих групп белка. 58. Общая характеристика d-элементов VIБ группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений в степени окисления +2,+3,+6. Биологическая роль Cr+3, Мо+6. Ксантиоксидаза и альдегидоксидаза – ферменты, содержащие Мо+6. (n - 1)dаnsв, где а = от 1 до 10, в = от1 до 2 Для стабилизации d-структуры у Сr Мо наблюдается «проявление» электронов на d-подуровне. Сr: …3d54s1 +2,+3,+6 Мо: …5d46s2 +6 W: …5d46s2 +6 По группе сверху вниз: радиус уменьшается; энергия ионизации увеличивается; химическая активность уменьшается. В низшей степени окисления – основные и восстановительные свойства Сr образует CrO, Cr(OH)2 В промежуточной степени окисления – амфотерные свойства Cr2O3 ему соответствуют Cr(OH)3, Н3СrО3 – ортохромистая кислота; НСrО2 – метахромистая кислота. В высшей степени окисления кислотные и окислительные свойства CrО3. Cr – регуляция синтеза жиров и обмена углеводов; влияние на усвояемость глюкозы и уровень сахара в крови; профилактика атеросклероза. Мо+6, Мо+5 – содержатся в организме, входит в состав ферментов: ксантидегидрогенеза и ксантиоксидаза(КОКС); катализирует окисление ксантина и гипоксантина до мочевой кислоты и альдегидов. R – СООН + КОКС* Мо+6 + Н2О Н3О…ОСR – КОКС*Мо+4 ООН + КОКС*Мо+6 + 2Н+ 59. Общая характеристика элементов VII Б группы. Электронные формулы для марганца, технеция, рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2,+4,+6,+7. Окислительная активность перманганат- иона в зависимости от среды. Биологическая роль Мn+2 и соединения марганца, применяемые в медицине. Mn: …3d54s2 +2,+3,+4,+6,+7 Те: …4d55s2 +4,+7 Rе: …5d56s2 +4,+7 Mn+2: MnO, Mn(OH)2, [Mn(H2O)4]CI2 Mn+4: MnO2, Mn(OH)4 – амфотерное; ОВ двойственность: Н4МnО4 и Н2МnО3 орто- и метамарганцеватистая Mn+6: MnO3, Н2МnО4 – марганцеватистая; К2 МnО4 – манганат, неустойчивый окислитель Mn+7: Mn2O7, НМnО4 – марганцовая; КМnО4 – перманганат калия, сильный окислитель. Мn+2 – в организме образует комплекс с нуклеиновыми кислотами и аминокислотами, входит в состав ферментов, участвует в синтезе витамина С и В12; содержится в красной свекле, картофеле, печени. КМnО4 – 5% дезинфицирующее, кровоостанавливающее , противоожоговое действие MnSO4 – лечение анемии MnCI2 – лечение атеросклероза 60. Элементы VIII группы. Семейство железа. Характерные степени окисления +2,+3,+6. Характерные комплексные соединения для Fe+2, Fe+3. Биологическая роль Fe+2, Fe+3 и Со+2. Препараты железа, используемые в медицине. Общая характеристика d-элементов I Б группы. Электронные формулы и степени окисления меди, серебра и золота. Координационные числа, тип гибридизации атомных орбиталей, структура соединений. Отношение этих элементов к кислотам, кислороду и сере. Биологическая роль Сu+2. Оксигеназы и гидроксилазы. Церуллоплазмин. Их роль в биохимических процессах. Общая характеристика элементов I Б группы: электронная формула: (n - 1)d9s2 для стабилизации – «провал» электронов (n - 1)d10s1 Сu: …3d104s1 +1,+2 Ag: …4d105s1 +1,+2 Аu: …5d106s1 +3 Эти элементы образуют комплексные соединения с координационным числом =2 и 4, что соответствует sp и sp3 гибридизации. CuCI2 + 2NH3 [Cu(NH₃)₂]CI Au(OH)₃ + NaOH  Na[Au(OH)₄] Na[Au(OH)₄]Cu, Au, Ag – малоактивные металлы Cu, Ag – взаимодействуют с концентрированными HNO₃, H₂SO₄ Au – растворяется в «царской водке» Сu – «металл жизни» микроэлемент, концентрируемый в печени, мозге, мышцах, надпочечниках, содержится более, чем в 25 ферментах – оксигеназы(Е1) и гидроксилазы(Е) Ионы Cu содержится в белке церуллоплазмине, он катализирует окисление Fe+2 до Fe+3. Связывает Cu+2 и транспортирует по организму. 61. Характеристика d-элементов II Б группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Изменение кислотно-основных свойств от цинка к ртути. Строение комплексных соединений. Гидроксиды данных элементов и их свойства. Биологическая роль Zn+2. Карбоангидраза, строение активного центра металлофермента, биологическая роль. Карбопепсидаза. Механизм участия карбопепсидазы в реакциях гидролиза пептидных связей. Токсическое действие на организм Hg+2, Cd+2. Соединения цинка и ртути, применяемые в медицине. Zn: … 3d104s2 +2 Cd: …4d105s2 +2 Hg: …5d106s2 +1,+2 По группе сверху вниз Радиус уменьшается; восстановительные свойства уменьшаются; основные свойства уменьшаются Zn – амфотерный металл, склонен к комплексообразованию с координационным числом =7, 4 и 6. Амфотерные свойства оксида цинка: ZnО + 2НСl + 3Н2О [Zn(H₂O)₄]Cl ZnО + 2NaOH + Н2О Na₂[Zn(OH)₄] Амфотерные свойства Cd(OH)₂: Cd(OH)₂ + 6NH₃ [Cd(NH₃)₆](OH)₂ Cd(OH)₂ + 2НСl CdCl₂ + 2H₂O Zn – повышает иммунитет. Карбоангидраза – катализирует обратимую гидратацию CO₂, отвечает за углеводный обмен. Карбоксипептидаза – катализирует процесс гидролиза пептидных связей. О О R₁ - C + Н₂O КОП Zn R₁ - С + R₂ - NH₂ NH ОН l R₂ HgCl – сильный яд: дезинфицирующее средство, дубление кожи 62. Общая характеристика р-элементов, их расположение в периодической системе элементов. Строение электронных уровней для р-элементов. Характер изменения свойств р-элементов по периодам и подгруппам. Наиболее характерные степени окисления. Правило «четности». Органогенные р-элементы. Микроэлементы среди р-семейства. 30 элементов, lllа – Vll, находятся во ll и lll малых периодах, lV – Vl больших периодов. У р-элементов валентными являются s и p электроны внешнего уровня, число их равно номеру группы. Общее электронное строение: ns²npа, а = от 1 до 6. При движении в периодах слева на право: атомные радиусы уменьшаются; величина энергия ионизации возрастает – приводит к нарастанию неметаллических и окислительных свойств В главных подгруппах сверху вниз в связи с ростом радиуса величина энергии ионизации уменьшается т.е. металлические и восстановительные свойства возрастают. р-элементы проявляют положительную степень окисления = номеру группы. Для р-элементов выполняется правило «четности»: элементы не четных групп проявляют нечетную степень окисления, а элементы четных групп проявляют четную степень окисления. Р-элементы начиная с lVА группы проявляют отрицательную степень окисления(номер группы - 8) При переходе вниз по группе устойчивость максимальной положительной степени окисления уменьшается и возрастает устойчивость низших степеней окисления. Органогенные р-элементы: С, N, P, O, S Микроэлементы среди р-семейства: Аs, Se 63. Свойства р-элементов III А группы. Изменение активности в подгруппе. Борные кислоты. Бура. Амфотерный характер алюминия, оксида и гидроксида алюминия. Соединения, характерные для таллия. Биологическая роль AI+3 и его соединений, применяемых в медицине. В: …2s²2p¹ +3 AI: …3s²3p¹ +3 Ga: …4s²3d¹⁰4p¹ +3 In: …5s²4d¹⁰5p¹ +3 Tl: …6s²4f¹⁴5d¹⁰6p¹ +3, +1 В2О3 + Н2О 2НВО2 – метаборная В2О3 + 3Н2О  2Н3ВО3 – ортоборная 2Н3ВО3 – ортоборная2В2О3 + Н2О  Н2В4О7 - тетраборная Н2В4О7 - тетраборная4 Н3ВО3 + 2NaOH = Na₂B₄O₇ + 7H₂O Бура AI – типичный амфотерный элемент AI₂O₃, AI(OH)₃ - амфотерные свойства Металлические свойства AI выражены сильнее, чем у В 2AI + 6HCl + 12H₂O 2[Al(H₂O)₆]Cl₃ + 3H₂ - основные свойства 2Al + 6NaOH + 6H₂O 2Na₃[Al(OH)₃] + 3Н₂ - кислотные свойства Al+3 – входит в состав ферментов; недостаток приводит к недостатку витамина В1; избыток тормозит синтез гемоглобина. Фармакологическое действие солей Al основано на том, что Al+3 образуют с белками комплексы, выпадающие в виде гелей, препятствует проникновению микроорганизмам, снижает воспалительную реакцию. KAl(SO₄)₂*12H₂O – для промывания ран, примочек, спринцеваний при воспалительных заболеваниях слизистых оболочек. (CH₃COO)₃Al – 8% раствор – жидкость Бурова, вяжущее и противовоспалительное действие Al₂O₃*SiO₂*H₂O – белая глина, в стоматологии – состав пломбировочного материала 64. Свойства р-элементов lV А группы. Электронные формулы и степени окисления для углерода, кремния, германия, олова и свинца. Изменение химической активности в подгруппе, кислотно-основных и окислительно-восстановительных свойств соединений данных элементов. Оксиды р-элементов lV А группы и соответствующие им кислоты. Угольная, кремневая, поликремневая, оловянная, свинцовая кислота. Токсическое действие на организм свинца и его соединений. С: …2s²2p² +2, +4, -4 Si: …3s²3p² +4,-4 - неметаллы Ge: …4s²3d¹⁰4p² +4,+2 Sn: …5s²4d¹⁰5p² +4,+2 - амфотерные Pb: …6s²4f¹⁴5d¹⁰6p² +4,+2 - типичный металл СО2 SiO₂ - H₂SiO₃ - все кремневые кислоты очень слабые, растворимые в воде силикаты подвержены гидролизу SnO₂ – H₂SnO₃ PbO₂ - H₂PbO₃ Pb попадая в организм с пищей, воздухом, водой Pb депонирует в скелете. Pb взаимодействует и блокирует sh-группы белков в молекулах ферментов образуется альбуминат свинца. Альбуминаты не способны участвовать в биохимических процессах. Pb+2 вытесняет естественные ионы металлов, ингибируя активность фермента. 65. Свойства р-элементов V А группы. Электронные формулы, характерные степени окисления. Закономерности изменения свойств элементов в подгруппе. Фосфор, кислородные соединения, соответствующие им кислоты. Свойства солей. Окислительно-восстановительная активность Р+5, Р+3 и Р-3. Состав и биологическая роль АТФ и АДФ. N: …2s²2p³ +5,+3,-3,-2,-1,0,+1,+2,+4 Р: …3s²3p³ +5,+3,-3 Аs: …4s²3d¹⁰4p³ +5,+3,-3 Sb: ...5s²4d¹⁰5p³ +5,+3 Bi: …6s²4f¹⁴5d¹⁰6p³ +5, +3 – типичный металл Р- существует в нескольких аллотропных модификаций. Наиболее изучен белый и красный фосфор. Р+3 – окислитель и восстановитель Р2О3 + 3Н2О = 2Н3РО3 фосфористая кислота(фосфиты) Р+5 – окислитель Р2О5 + 3Н2О = 2Н3РО4 фосфорная кислота Р2О5 + 2Н2О = Н4Р2О7 пирофосфорная АТФ и АДФ – производные ди- и трифосфорных кислот АТФ – бионеорганическое соединение, т.к. состоит из органической части – аденозина и неорганической – трех связанных в цепь фосфатных групп. АДФ - бионеорганическое соединение, т.к. состоит из органической части – аденозина и неорганической – двух связанных в цепь фосфатных групп. АТФ функционирует в клетке как промежуточный продукт, переносящий энергию и сопрягающий реакции, сопровождающиеся выделением и потреблением энергии. 66. Мышьяк, сурьма и висмут. Характерные степени окисления для мышьяка, сурьмы и висмута. Оксиды их кислотно-основный характер. Кислоты и соли мышьяка, сурьмы. Мышьяковистая и мышьяковая кислоты. Арсениты и арсенаты. Токсическое действие As+3. Биологическое действие As+5. Реакция Марша. Аs: …4s²3d¹⁰4p³ +5,+3,-3 Sb: ...5s²4d¹⁰5p³ +5,+3 Bi: …6s²4f¹⁴5d¹⁰6p³ +5, +3 As₂O₃ - амфотерный Н₃AsO₃ - мышьяковистая кислота As₂O₅ - кислотный H₃AsO₄ - мышьяковая кислота Арсениты и арсенаты – соли мышьяка. Соединения As+5, As+3 очень токсичны(легко вступают в реакцию с белками) As – накапливается в ногтях и волосах Определение мышьяка в биологическом материале приводит в приборе по реакции Марша: 2AsH₃ = 2As + 3Н2 На стенке прибора образуется «мышьяковое зеркало» - качественная реакции 67. Свойства р-элементов VI А группы. Электронные формулы и степени окисления. Степени окисления для кислорода. Активные формы кислорода, механизм действия на организм, ферментная антиоксидантная защита. Устойчивость водородных соединений элементов VI А группы. Окислительно-восстановительный характер соединений элементов данной группы. О: …2s²2p⁶ -2,+2 S: …3s²3p⁴ -2,+2,+4,+6 Se: …4s²3d¹⁰4p⁴ -2,+4,+6 Те: …5s²4d¹⁰5p⁴ -2,+4,+6 Po: …6s²4f¹⁴5d¹⁰6p⁴ Активные формы О: О2 + ē О2º(супероксидный анион) О2º + О2º + 2Н+ Н2О2 + О2 Н2О2 + О2º 2ОН⁰ + О2 ОН⁰ + О2º О2* + ОН- О – состав всех биологических объектов Н2О2 + Fe+2 Fe+3 + ОН- + ОН. – реакция Фентона С увеличением радиусов ионов Э-2 и соответствующим ослаблением связей Э – Н. в том же направлении растет восстановительная способность Н2Э. в водных растворах Н2Э проявляют слабокислые свойства. Кислоты Н2ЭО3 в свободном состоянии неустойчивы. Соли этих кислот и сами кислоты проявляют окислительно-восстановительную двойственность. Кислоты состава Н2ЭО4 более устойчивы и в реакциях ведут себя как окислители. 68. Свойства серы и её соединений. Действие тяжелых металлов на серосодержащие ферменты. Свойства сероводорода, его токсичность. Сернистая, серная и тиосерная кислоты. Их соли. Оксиды и кислоты селена и теллура. S – типичный неметалл; входит в состав аминокислот и белков; меркаптогруппа Na₂S₂O₃*5H₂O – тиосульфат натрия – противовоспалительное, противотоксическое действие Ионы тяжелых металлов, попадающие в организм, образуют плохо растворимые сульфиты. CN- взаимодействуя с серой образует менее токсичные тиоционаты. H₂S – бесцветный газ с неприятным запахом. Весьма токсичное вещество, т.к. является ингибитором фермента цитохромоксидазы. Он блокирует перенос электронов с цитохромидазы на кислород. При растворении SO₂ в воде образуется сернистая кислота H₂SO₃. Кислота образует соли двух типов: средние – сульфиты(Na₂SO₃) и кислые – водородсульфиты(NaHSO₃). SO₂ - газ с удушливым запахом, весьма ядовит. Серная кислота H₂SO₄. Атмосферная влага с растворенными SO₂ и H₂SO₄ выпадает в виде кислотных дождейю Тиосерная кислота H₂S₂O₃. Соль тиосерной кислоты натрий тиосульфат Na₂SO₃ - противотоксическое противовоспалительное действие. SeO₃ и TeO₃ - кислотные оксиды. Селеновая кислота H₂SeO₄ и теллуровая H₂TeO₄ - кристаллические вещества с сильными окислительными свойствами. 69. Галогены. Электронные формулы. Степени окисления. Изменение химической активности в подгруппе. Водородные соединения галогенов. Хлорная вода. Жавелевая вода. Хлорная известь. Кислородные соединения хлора. Биологическая роль галогенов и применение их соединений в медицине. F: …2s²2p⁵ -1 Cl: …3s²3p⁵ -1,+1,+3,+5,+7 Br: …4s²3d¹⁰4p⁵ -1,+1,+3,+5,+7 I: …5s²4d¹⁰5p⁵ -1,+1,+3,+5 Окислительные свойства от F к l уменьшаются. Водные растворы галогенидов образуют кислоты. HF |
