Ответы на зачет по общей химии. 1. место химии в формировании представлений о строении и законах функционирования различных систем человеческого организма. Связь химии с биологией, медициной и формацией. Основные этапы развития химии. Вклад отечественных ученых в развитие общей химии
 Скачать 188.85 Kb. Скачать 188.85 Kb.
|
|
38. Предмет и основные понятия химической кинетики. Роль кинетики в решении медико-биологических проблем. Скорость химической реакции. Средняя и истинная скорость. Единицы измерения. Способы определения скорости реакции. Химическая кинетика – учение о скоростях химических реакций их механизме и закономерностях протекания во времени. В биологических процессах важным является замедление процесса – ингибирование. Простые реакции – продукт образуется в результате непосредственного взаимодействия молекул реагентов. Сложные реакции – конечный продукт получается в результате осуществления двух и более простых реакций. Скорость химической реакции – показывает изменение концентраций реагирующих веществ в единицу времени в единице реакционного пространства. В химической кинетике пользуются понятием средней скорости: Vср = ± 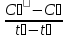 = ± = ± 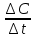 С₂, С₁ - конечная и начальная концентрации t₂, t₁ - разность времени [моль/л*мин], [моль/л*с], [моль/л*сут] В ходе реакции её скорость меняется непрерывно, поэтому поэтому лучше пользоваться истинной скоростью: Vср = ± 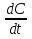 - изменение концентрации за бесконечно малый промежуток времени. Способы определения скорости реакции: - производят наблюдения за изменением концентрации исходных веществ или накоплением их продуктов взаимодействия. Химические, физические и биохимические методы. Измерить скорость реакции можно найдя концентрации реагирующих веществ в разные моменты времени с помощью химического анализа. Очень трудоемкая работа, поэтому чаще определяют какую-либо физико-химическую величину в зависимости от концентрации, затем строят график: Калибровочный график В современной кинетике широко применяются физические методы, относящиеся к спектральным (поглощение световой энергии пропорциональной количеству вещества в системе). Метод электронного парамагнитного резонанса(ЭПР) и ядерного магнитного резонанса(ЯМР) 39. Влияние концентрации на скорость химической реакции. Закон действующих масс. Влияние концентрации на скорость реакций определяется законом действующих масс. Закон Гольдберга и Воаге: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов . аА + вВ ↔ сС + dD V = k*[A]a + [B]b [A] и [B] – молярные концентрации реагентов а, в – степени концентрации, равные стехиометрическим коэффициентам, только для простых реакций в случае многостадийных реакций: V = k*[A]na + [B]nb na, nb – постоянные, не зависящие от концентрации числа, называемые показателями порядка реакций по реагентам А,В определяются экспериментально, имеют значение от 0 до 2. 40. Порядок реакции. Реакции первого, второго, нулевого порядка. Физический смысл константы скорости реакции. Молекулярность элементарного акта реакции. Условия несовпадения порядка и молекулярности реакции. Вывод кинетического уравнения для реакции первого порядка. Время полураспада для реакций первого порядка. Порядок реакции – показатель степени концентрации реагирующего вещества в кинетическом уравнении реакции. Общий порядок химической реакции – величина равная сумме показателей степени концентрации реагентов в кинетическом уравнении реакции. n = na + nb k – константа скорости реакции, показывает какая доля из общего числа в расчете на один моль вещества приводит к химическому взаимодействию; зависит от природы реагирующих веществ, температуры среды, налия катализатора, но не зависит от концентрации реагирующих веществ. Существуют реакции нулевого порядка: скорость =const Существуют реакции I, II и III порядка. Реакции нулевого порядка протекают с постоянной скоростью и не зависят от концентрации реагирующих веществ. Для многостадийных процессов порядок реакции определяется самой медленной(лимитирующей) стадией. Если вещество взято в избытке, то оно не участвует в определении порядка реакции, т.к. его концентрация практически не меняется. Молекулярность – число молей веществ, участвующих в элементарном акте взаимодействия.
Порядок и молекулярность совпадают только для простых реакций. Знание порядка реакции необходимо т.к. по нему определяется кинетическое уравнение для расчета константы скорости реакции. Вывод кинетического уравнения I порядка: А  В Вt₀ = 0, [А] = С₀ - x, [В] = 0 - исходная концентрация ч/з t: [А] = С₀ - x, [В] = x - прореагировало V = k₁ * [С₀ - x] 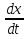 = k₁* [С₀ - x] = k₁* [С₀ - x] 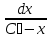 = k₁* = k₁*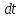 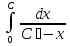 = =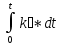 - 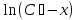 = k₁ * t + I, I = - = k₁ * t + I, I = - 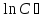 , - , -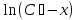 = k₁ * t - = k₁ * t - 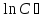 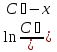 = k₁ * t , k₁ = = k₁ * t , k₁ = 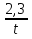 * *  , , 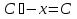 k₁ = 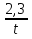 * * 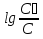 [k = с-1, мин-1, час-1 [k = с-1, мин-1, час-1в кинетике часто пользуются понятием полураспада реакции – время необходимое для того, чтобы прореагировала половина исходного количества вещества. 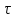 ½ = ½ = 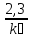 * * 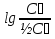 = = 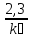 * * 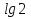 = = 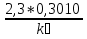 = = 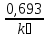 Период полураспада реакции первого порядка не зависит от концентрации. 41. Кинетическое уравнение реакции второго порядка. Расчет константы скорости для реакций второго порядка. Период полураспада для реакций второго порядка. Понятие о фармакокинетике. Кинетическое уравнение реакции второго порядка: kII = 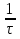 ( (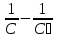 ) моль-1*м*с-1 ) моль-1*м*с-1период полураспада для реакций второго порядка: 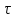 ½ = ½ = 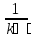 * * 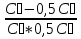 = = 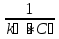 42. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. 1879г. – Вант-Гофф установил, что при повышении температуры на 10⁰С скорость гомогенной химической реакции увеличивается в 2 – 4 раза. Vt2 = Vt1 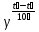 kt2 = kt1 kt2 = kt1 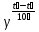 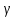 – температурный коэффициент константы скорости реакции (2 – 4) – температурный коэффициент константы скорости реакции (2 – 4)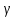 = = 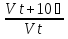 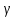 = = 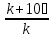 Vt, kt - скорость и константа при температуре 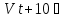 и и 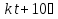 - при - при 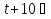 43. Теория активных соударений Аррениуса. Энергия активации. Уравнение Аррениуса в экспоненциальном и дифференциальном виде. Связь величины энергии активации со скоростью реакции. Точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса. 1899г. – Аррениус выдвинул теорию активации: во взаимодействие вступают только те молекулы, которые обладают определенным запасом энергии, необходимым для осуществления той или иной реакции. Энергия активации(Еа) – избыточная энергия которую необходимо передать 1молю вещества чтобы перевести все молекулы в активное состояние. Нормальное температурное поведение скорости различных реакций определяется следующей зависимостью константы скорости от температуры: К = 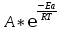 Еа и А – постоянные не зависящие от температуры величины Т – абсолютная температура Для биохимических процессов, когда трудно определить константу, уравнение Аррениуса можно представить: V = 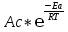 Ас = АСАna САnв Ас = АСАna САnвУравнение Аррениуса в дифференциальной форме: 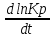 = = 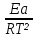 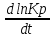 = = 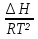 Решая уравнение Аррениуса совместно с уравнением изобары получим: Еа = ∆Н + RT При незначительных значениях RT: Еа = ∆Н Расчет Еа по уравнению Аррениуса: lg 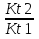 = = 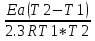 Ea = 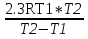 * lg * lg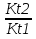 44. Понятие о теории переходного состояния. Катализ и катализаторы. Механизм действия гомогенного катализа. Энергия активации затрачивается на ослабление связей между атомами исходных веществ при этом вещества переходят в устойчивые состояния – активированный комплекс. Н I НН Н – I - старые связи не разорвались, а новые не образовались I + I 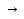 Н I НН Н – I Исходные активированный продукты вещества комплекс реакции Катализ – изменение скорости реакции с помощью катализатора. Катализаторы – вещества, изменяющие скорость реакции и остающиеся после химической реакции в неизменном количестве и качестве. Катализ:
Иногда катализатор образуется в ходе химической реакции – автокаталитические реакции (явление автокатализа) Катализ:
2SO2 г + О2 г 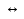 2SО3 г катализаторы: NO, NO2 2SО3 г катализаторы: NO, NO2
45. Биологические катализаторы – ферменты. Особенности ферментативного катализа. Уравнение Михаэлиса - Ментен и его анализ. Фермент – белковый катализатор, способный специфически активировать субстрат. Субстрат – вещество, которое специфически активируется данным ферментом. Ферментативный катализ:
По своей эффективности биологические катализаторы превосходят в млн раз эффективнее химических катализаторов. 2Н2О2 2Н2О + О2 Еа = 75кДж/моль 2Н2О2 каталаза 2Н2О + О2 Еа – 23кДж/моль Такое снижение Еа приводит к увеличению скорости в 3*1011раз
Каждый фермент действует на строго определенную реакцию или группы реакций – субстратная и групповая специфичность. Субстратная специфичность включает в себя стериоспецифичность, т.е. проявление каталитической активности только в отношении одного из стериоизомеров. Ферменты с групповой специфичностью обеспечивают превращение разных субстратов, имеющих определенные структурные фрагменты Пример: пищеварительные ферменты(пепсин, трипсин) расщепляют пептидные связи самых разных белков
Пример: пепсин работает при значениях рН 1,5 – 3,5
Если температура превышает эти пределы, активность фермента быстро снижается. Уравнение Михаэлиса-Ментена: Vст = 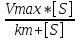 Vmax – max скорость реакции в условиях насыщения фермента Kmax – константа Михаэлиса [S] – концентрации субстрата 46. Комплексные соединения. Состав и строение, исходя из теории лигандообменных равновесий А. Вернера. Соединения первого порядка способны вступать в дальнейшее взаимодействие с образованием более сложных соединений уже высшего порядка – комплексные соединения. Комплексные соединения – вещества молекулы, которых состоят из иона(центральный атом) непосредственно связанного с определенным числом других молекул(лиганды). Строение комплексных соединений - 1893г. Вернер Координационная теория Вернера: Комплексные соединения характеризуются наличием центрального иона(комплексообразователь), который окружен определенным числом других частиц(лиганды) внутренняя сфера 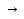 [МLn]Xm - внешняя сфера [МLn]Xm - внешняя сфера[Fe3+(CN)6]-3 - заряд внутренней сферы координационное число(n) центральный ион(М) лиганд(L) Число лигандов определяется координационным числом(n). n – как правило в 2раза больше заряда комплексообразователя. Центральный ион с окружающими его лигандами образует внутреннюю сферу комплекса. Заряд внутренней сферы комплекса определяется алгебраической суммой зарядов комплексообразователя и лигандов. Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве – координационное комплексное соединение. К внутренней сфере комплекса присоединяется определенное число противоположно заряженных частиц, которые составляют внешнюю сферу комплексного соединения. У ряда комплексов внешняя сфера отсутствует – нейтральные комплексы. 47. Природа химической связи в комплексных соединениях. Примеры sp, sp3, dsp2, d2sp3 гибридизация атомных орбиталей у комплексообразователя. Внешне- и внутриорбитальные комплексы. Структура комплексов в зависимости от типа гибридизации комплексообразователя. Объяснение образования химической связи в комплексных соединениях дают методом валентных связей. Исходя из лигандов, валентные связи предполагается, что между лигандами и комплексообразователем образуется донорно-акцепторная связь за счет не поделенных электронных пар лигандов. Лиганды дающие пару электронов на образование связи – доноры. Центральный ион на орбиталях, которого располагаются электронные пары – акцептор. При координационном числе =2 комплексообразователь представляет sp – гибридные орбитали, комплексы при этом имеют линейное строение. Сu[(NH₃)₂]Cl sp – гибридизация +29Cu0: 1s22s22p63s23p63d104s1 +29Cu+1: 1s22s22p63s23p63d104s0 акцептор NH3, NH3 – доноры Если координационное число в комплексном соединении =4, то комплексообразователь представляет sp3- гибридные орбитали, тетраэдрическое строение. +29Cu+2: 1s22s22p63s23p63d94s0 - акцептор NH3, NH3, NH3, NH3 – доноры sp3- гибридизация Комплексы могут иметь одинаковое координационное число, но будут иметь различный тип гибридизации в зависимости от поляризующего действия лигандов. Комплексы, в которых лиганды располагаются на внешних орбиталях комплексообразователя – внешнеорбитальные комплексы(они парамагнитны, т.к. имеют не спаренные электроны на предвнешнем уровне). Пример соединения d2sp3 – гибридизации: [Fe+2(CN)6]4- Fe+2: 1s22s22p63s23p63d64s0 акцептор CN, CN, CN, CN, CN, CN – доноры Внутриорбитальные комплексы (диамагнитны, т.е. все электроны на предвнешнем уровне спарены) |
