Микробиология мпф 2015-2016 экз. 1. Микробиология предмет изучения, цели и задачи. Исторические этапы развития медицинской мб
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
|
58. Виды изменчивости микробов. Модификации, виды, примеры Различают генотипическую (наследуемую) изменчивость и фенотипическую (ненаследуемую, модификационную). Наследуемая изменчивость осуществляется в виде мутаций и рекомбинаций. Модификации представляют собой фенотипические ненаследуемые изменения, которые возникают у бактерий в результате воздействия факторов внешней среды. Впервые сообщения об изменении культуральных свойств микробов появились в работах Поль де Крайфа (1921), наблюдавшего расщепление культуры кроличьей септицемии на вирулентные и авирулентные штаммы. Сущность этого явления состоит в том, что при рассеве на плотной питательной среде бактериальной культуры из одного типичного штамма (вида) в основном появляются два типа колоний, отличающихся друг от друга определенными формами. S-форма (гладкая) является нормальным типом колоний для многих грамотрицательных бактерий, кишечной и других групп; R-форма (шероховатая)―измененный тип колоний. Бактерии ки-шечно-тифозно-дизентерийной группы вирулентны в S-форме колоний, а в R-форме не обладают вирулентными свойствами. Бактерии чумы, туберкулеза, сибирской язвы вирулентны в R-форме, а бру-целлы ― в S-форме. В условиях культивирования микробов возможен переход от S-формы к R-форме. При этом кап-сульные бактерии теряют капсулы, лишаются биохимической активности и становятся неполноценными в антигенном отношении, приобретая неспецифические антигены. Подвижные бактерии теряют жгутики. Переход S-формы в R-форму происходит в основном через промежуточные О и слизистые М-колоиии. В процессе расщепления культур еще наблюдаются карликовые (D-dwarf), G-колонии (gonidial), появляющиеся как дочерние колонии на поверхности или на краю нормально развивающихся. В условиях нарушения температурного режима, старения культуры, повышенной концентрации солей, применения антибиотиков и'фагов понижается вирулентность, изменяются антигенные и им-муногенные свойства, появляются антибиотикоустойчивые и фаго-устойчивые штаммы, аэробы становятся факультативными анаэробами, утрачивают некоторые имеющиеся ферменты или приобретают новые ферменты. Если культивировать кишечные палочки па среде с добавлением лактозы, то у нее появляется новый, фермепт р-галактоза. Изменение метаболизма у бактерий можно вызвать ультрафиолетовым облучением и рентгеновскими лучами. Изменяя параметры среды обитания, можно установить пределы и границы отклонения микробных клеток. Таким образом, широк диапазон феиотипических изменений. В основе этих изменений лежит прежде всего приспособительная активность обменных функций. Адаптация―это закон живого, и по этому закону живут и развиваются микроорганизмы. 59. Генетические рекомбинации у бактерий: трансформация Трансформация заключается в том, что ДНК, выделенная из бактерий в свободной растворимой форме, передается бактерии-реципиенту. При трансформации рекомбинация происходит, если ДНК бактерий родственны друг другу. В этом случае возможен обмен гомологичных участков собственной и проникшей извне ДНК. Впервые явление трансформации описал Ф. Гриффите (1928). Он вводил мышам живой невирулентный бескапсульный R-штамм пневмококка и одновременно убитый вирулентный капсульный S-штамм пневмококка. Из крови погибших мышей был выделен вирулентный пневмококк, имеющий капсулу убитого S-штамма пневмококка. Таким образом, убитый S-штамм пневмококка передал наследственную способность капсулообразования R-штамму пневмококка. О. Эвери, К. Мак-Леод и М. Мак-Карти (1944) доказали, что трансформирующим агентом в этом случае является ДНК. Путем трансформации могут быть перенесены различные признаки: капсулообразование, устойчивость к антибиотикам, синтез ферментов. Изучение бактериальной трансформации позволило установить роль ДНК как материального субстрата наследственности. При изучении генетической трансформации у бактерий были разработаны методы экстракции и очистки ДНК, биохимические и биофизические методы ее анализа. 60. Генетические рекомбинации у бактерий: трансдукция, виды. Использование в генной инженерии Трансдукция — передача ДНК от бактерии-донора к бактерии-реципиенту при участии бактериофага. Различают неспецифическую (общую) трансдукцию, при которой возможен перенос любого фрагмента ДНК донора, и специфическую — перенос определенного фрагмента ДНК донора только в определенные участки ДНК реципиента. Неспецифическая трансдукция обусловлена включением ДНК донора в головку фага дополнительно к геному фага или вместо генома фага (дефектные фаги). Специфическая трансдукция обусловлена замещением некоторых генов фага генами хромосомы клетки-донора. Фаговая ДНК, несущая фрагменты хромосомы клетки-донора, включается в строго определенные участки хромосомы клетки-реципиента. Таким образом, привносятся новые гены и ДНК фага в виде профага репродуцируется вместе с хромосомой, т.е. этот процесс сопровождается лизоге-нией. Если фрагмент ДНК, переносимый фагом, не вступает в рекомбинацию с хромосомой реципиента и не реплицируется, но с него считывается информация о синтезе соответствующего продукта, такая трансдукция называется абортивной. 61. Генетические рекомбинации у бактерий: конъюгация Конъюгация бактерий состоит в переходе генетического материала (ДНК) из клетки-донора («мужской») в клетку-реципиент («женскую») при контакте клеток между собой. Мужская клетка содержит F-фактор, или половой фактор, который контролирует синтез так называемых половых пилей, или F-пилей. Клетки, не содержащие F-фактора, являются женскими; при получении F-фактора они превращаются в «мужские» и сами становятся донорами. F-фактор располагается в цитоплазме в виде кольцевой двунитчатой молекулы ДНК, т. е. является плазмидой. Молекула F-фактора значительно меньше хромосомы и содержит гены, контролирующие процесс конъюгации, в том числе синтез F-пилей. При конъюгации F-пили соединяют «мужскую» и «женскую» клетки, обеспечивая переход ДНК через конъюгационный мостик или F-пили. Клетки, содержащие F-фактор в цитоплазме, обозначаются F+; они передают F-фактор клеткам, обозначаемым F" («женским»), не утрачивая донорской способности, так как оставляют копии F-фактора. Если F-фактор включается в хромосому, то бактерии приобретают способность передавать фрагменты хромосомной ДНК и называются Hfr-клетками (от англ. high frequency of recombination — высокая частота рекомбинаций), т.е. бактериями с высокой частотой рекомбинаций. При конъюгации клеток Hfr и клеток F" хромосома разрывается и передается с определенного участка (начальной точки) в клетку F", продолжая реплицироваться. Перенос всей хромосомы может длиться до 100 мин. Переносимая ДНК взаимодействует с ДНК реципиента — происходит гомологичная рекомбинация. Прерывая процесс конъюгации бактерий, можно определять последовательность расположения генов в хромосоме. Иногда F-фактор может при выходе из хромосомы захватывать небольшую ее часть, образуя так называемый замещенный фактор — F'. При конъюгации происходит только частичный перенос генетического материала, поэтому ее не следует отождествлять полностью с половым процессом у других организмов. 62. Химиотерапевтические препараты: определение, основные группы, требования, предъявляемые к препаратам. Основные химические группы антибиотиков, примеры. Классификация антибиотических веществ может быть основана на различных принципах (источники получения, химические свойства, антибактериальный спектр и пр.). Чаще всего их классифицируют по спектру действия на различные микроорганизмы Различают: 1) антибиотики, активные в отношении грамположительных микроорганизмов (группа пенициллинов и макролиды — эритромицин и олеандомицин); 2) антибиотики с широким спектром действия (ампициллин, левомицетин, тетрациклины, стрептомицин, аминогликозиды); 3) антибиотики с противогрибковым действием (нистатин, леворин, гризеофульвин); 4) противоопухолевые антибиотики. Антибиотики могут оказывать на микробы бактериостатическое и бактерицидное действие. Бактериостатическое действие антибиотиков — подавление, задержка рос-та бактерий или грибов. При использовании таких антибиотиков необходимо обеспечить постоянный уровень определенной концентрации препарата в крови, так как при ее снижении микробы начинают вновь размножаться. Бактерицидное действие антибиотиков связано с гибелью микробов. За последние 25 лет открыто множество антибиотиков с различным спектром действия. Однако для лечения инфекционных заболеваний используют не более 50, так как многие антибиотики имеют противопоказания к применению. Антибиотические вещества получают из грибов, актиномицетов, бактерий, высших растений, из клеток и тканей различных животных. Химиотерапия — специфическое антимикробное, антипаразитарное лечение при помощи химических веществ. Эти вещества обладают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма. Основоположником химиотерапии является немецкий химик, лауреат Нобелевской премии П.Эрлих, который установил, что химические вещества, содержащие мышьяк, губительно действуют на спирохеты и трипаносомы, и получил в 1910 г. первый химиотерапевтический препарат — сальварсан (соединение мышьяка, убивающее возбудителя, но безвредное для микроорганизма). В 1935 г. другой немецкий химик Г.Домагк обнаружил среди анилиновых красителей вещество — пронтозил, или красный стрептоцид, спасавший экспериментальных животных от стрептококковой инфекции, но не действующий на эти бактерии вне организма. За это открытие Г.Домагк был удостоен Нобелевской премии. Позднее было выяснено, что в организме происходит распад пронтозила с образованием сульфаниламида, обладающего антибактериальной активностью как in vivo, так и in vitro. Механизм действия сульфаниламидов (сульфонамидов) на микроорганизмы был открыт Р.Вудсом, установившим, что сульфаниламиды являются структурными аналогами парааминобензойной кислоты (ПАБК), участвующей в биосинтезе фолиевой кислоты, необходимой для жизнедеятельности бактерий. Бактерии, используя сульфаниламид вместо ПАБК, погибают. Первый природный антибиотик был открыт в 1929 г. английским бактериологом А.Флемингом. При изучении плесневого гриба Penicillium notatum, препятствующего росту бактериальной культуры, А. Флеминг обнаружил вещество, задерживающее рост бактерий, и назвал его пенициллином. В 1940 г. Г. Флори и Э. Чейн получили очищенный пенициллин. В 1945 г. А Флеминг, Г. Флори и Э. Чейн стали Нобелевскими лауреатами. В настоящее время имеется огромное количество химиотерапевтических препаратов, которые применяются для лечения заболеваний, вызванных различными микроорганизмами. 63. История открытия антибиотиков. Источники и методы получения антибиотиков. антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, поэтому важной проблемой являлась систематизация этих препаратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общепринятой. В основу главной классификации антибиотиков положено их химическое строение. 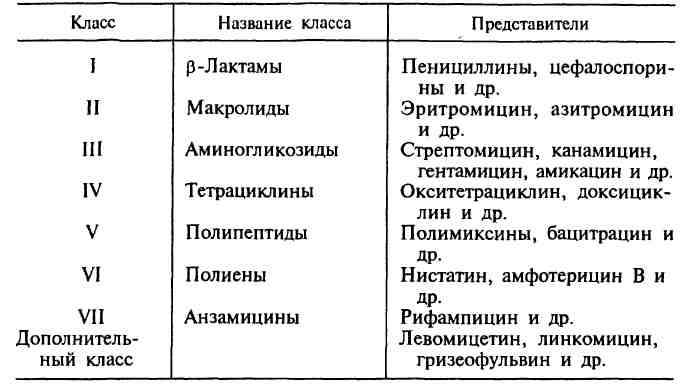 Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). Источники антибиотиков. Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некоторые вещества с селективным антимикробным действием (например, фитонциды), однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили. Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали: • Актиномицеты (особенно стрептомицеты) — ветвящиеся бактерии. Они синтезируют большинство природных антибиотиков (80 %). • Плесневые грибы — синтезируют природные бета-лактамы (грибы рода Cephalosporiumи Penicillium)Hфузидиевую кислоту. • Типичные бактерии — например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием. Способы получения. Существует три основных способа получения антибиотиков: • биологический синтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности); • биосинтез с последующими химическими модификациями (так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присоединяют определенные радикалы, в результате чего улучшаются противомикробные и фармакологические характеристики препарата; • химический синтез (так получают синтетические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Это вещества, которые имеют такую же структуру, 64. Спектр и механизмы действия химиотерапевтических препаратов и основных химических групп антибиотиков По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия. Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов. Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке. В зависимости от механизма действия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. 65. Побочное действие антибиотиков на макроорганизм. Примеры Как и всякие лекарственные средства, практически каждая группа антимикробных химиопрепаратов может оказывать побочное действие, причем и на макроорганизм, и на микробы, и на другие лекарственные средства. Осложнения со стороны макроорганизма Наиболее частыми осложнениями антимикробной химиотерапии являются: Токсическое действие препаратов. Как правило, развитие этого осложнения зависит от свойств самого препарата, его дозы, способа введения, состояния больного и проявляется только при длительном и систематическом применении антимикробных химиотерапевтических препаратов, когда создаются условия для их накопления в организме. Особенно часто такие осложнения бывают, когда мишенью действия препарата являются процессы или структуры, близкие по составу или строению к аналогичным структурам клеток макроорганизма. Токсическому действию антимикробных препаратов особенно подвержены дети, беременные, а также пациенты с нарушением функций печени, почек. Побочное токсическое влияние может проявляться как нейротоксическое (например, гликопептиды и аминогликозиды оказывают ототоксическое действие, вплоть до полной потери слуха за счет воздействия на слуховой нерв); нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, сульфаниламиды); общетоксическое (противогрибковые препараты — полиены, имидазолы); угнетение кроветворения (тетрациклины, сульфаниламиды, левомицетин/хлорамфеникол, который содержит нитробензен — супрессор функции костного мозга); тератогенное [аминогликозиды, тетрациклины нарушают развитие костей, хрящей у плода и детей, формирование зубной эмали (коричневая окраска зубов), левомицетин/хлорамфеникол токсичен для новорожденных, у которых ферменты печени не полностью сформированы («синдром серого ребенка»), хинолоны — действуют на развивающуюся хрящевую и соединительную ткани]. Предупреждение осложнений состоит в отказе от противопоказанных данному пациенту препаратов, контроле за состоянием функций печени, почек и т. п. |
