Контрольная по химии для заочников и вечерников 5 вариант. 1. Написать все возможные формулы солей, которые могут образоваться при взаимодействии Ti(OH)4 и H2Se
 Скачать 26.65 Kb. Скачать 26.65 Kb.
|
|
Вариант №5 1.Написать все возможные формулы солей, которые могут образоваться при взаимодействии Ti(OH)4 и H2Se. Ti(OH)4 + 2H2Se = 4H2O + TiSe2 Ti(OH)4 + 4H2Se = 4H2O + Ti(HSe)4 (TiOH)2Se3 Ti(OH)2Se [Ti(OH)3]2Se 2. Дать название полученным солям. Средняя соль - одна, кислая тоже одна: Ti(OH)4 + 2H2Se = 4H2O + TiSe2 (селенид титана) Ti(OH)4 + 4H2Se = 4H2O + Ti(HSe)4 (гидроселенид титана) и несколько основных солей: (TiOH)2Se3 – селенид гидроксотитана (III) Ti(OH)2Se – селенид дигидроксотитана [Ti(OH)3]2Se – селенид тригидроксотитана 3.Написать электронную формулу атома 29 элемента. Электронная формула атома меди в порядке возрастания энергий орбиталей: 1s2 2s2 2p6 3s2 3p6 4s1 3d10 Электронная формула атома меди в порядке следования уровней: 1s2 2s2 2p6 3s2 3p6 3d10 4s1 4. Оценить валентные возможности в нормальном и возбужденном состоянии для германия. Какой основной тип химической связи реализуется в реально существующих соединениях германия? В нормальном валентность равна двум (4s2,4p2) в возбуждённом, - четырём (4s1,4p3). В соединениях его связь, в основном, ковалентная полярная. II часть Написать (последовательно) химические процессы, происходящие при контакте цинка с раствором карбоната натрия. Обосновать возможность их протекания. Карбонат натрия образован сильным основанием и слабой кислотой. В водном растворе карбонат натрия подвергается гидролизу. Гидролиз обусловлен ионами  , связывающими ионы водорода. Гидролиз протекает практически только по первой ступени. , связывающими ионы водорода. Гидролиз протекает практически только по первой ступени. Ионно-молекулярное уравнение гидролиза:  Молекулярное уравнение гидролиза:  Избыток гидроксид-ионов обуславливает щелочную реакцию среды, рН > 7. Металлический цинк всегда с поверхности покрыт пленкой оксида цинка ZnO, обладающей амфотерными свойствами Оксид цинка реагирует с образовавшимся в растворе гидроксидом натрия.  Это приводит к тому, что оксидная пленка растворяется и обнажается металлический цинк. В растворе имеются катионы натрия и катионы водорода. Катионы натрия цинк не может выделить из раствора, поскольку менее активен, чем натрий. Цинк будет реагирует с водой и вытесняет катионы водорода:  Окислительно-восстановительные реакции:  1 Zn – 2ē = Zn+2, процесс окисления; 1 Zn – 2ē = Zn+2, процесс окисления;1 2H+ + 2ē = H2, процесс восстановления. Возьмем численные данные по окислительно-восстановительным потенциалам, характеризующие процессы. Для цинка это потенциал равен:  Поскольку NaOH – сильное основание (щелочь), то значение рН будет не просто больше 7, а значительно больше, поскольку в результате гидролиза Na2CO3 среда будет сильнощелочной, рН = 10  14. Возьмем величину рН=10, подставив ее в уравнение Нернста 14. Возьмем величину рН=10, подставив ее в уравнение Нернста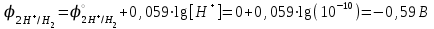 Реакция способная протекать самопроизвольно, если разность потенциалов ΔЕ, характеризующих процесс восстановления и окисления (ЭДС реакции), будет больше нуля. В данном случае: Е = -0,59 – (-0,76) = 0,17 (В) Цинк в щелочной среде способен вытеснить водород из воды. В результате окислительно-восстановительной реакции, наряду с водородом, образуется и гидроксид цинка Zn(OH)2, который, как и оксид цинка ZnO, обладает амфотерными свойствами. В дальнейшем, гидроксид цинка будет взаимодействовать со щелочью, которая есть в системе:  Суммарная реакция:  |
