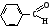альдегиды и кетоны. Электронное строение карбонильной группы. Реакционные центры в карбонилсодержащих соединениях
 Скачать 3.26 Mb. Скачать 3.26 Mb.
|
 БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ КАРБОНИЛЬНЫХ БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ КАРБОНИЛЬНЫХСОЕДИНЕНИЙ (АЛЬДЕГИДОВ И КЕТОНОВ) ЭЛЕКТРОННОЕ СТРОЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ. РЕАКЦИОННЫЕ ЦЕНТРЫ В КАРБОНИЛСОДЕРЖАЩИХ СОЕДИНЕНИЯХ Карбонильные соединения — органические вещества, содержащие в своей  Некоторые представители альдегидов и кетонов:
Атом углерода карбонильной группы находится в cостоянии sp2- гибридизации. Его конфигурация плоская, валентные углы между тремя -связями равны 120. -Связь образуется за счет перекрывания рz АО углерода и рz АО кислорода в плоскости, перпендикулярной плоскости -связей.
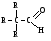
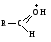
Связь С = О ковалентная, поляризованная. Электронная плотность связи смещается к более электроотрицательному атому кислорода. На атоме углерода возникает частичный положительный заряд. На ру АО кислорода находится неподеленная пара электронов. Таким образом, для карбонильной группы будут характерны реакции нуклеофильного присоединения АN. Реакционные центры:  РАЗЛИЧИЯ В РЕАКЦИОННОЙ СПОСОБНОСТИ АЛЬДЕГИДОВ И КЕТОНОВ Реакционная способность альдегидов и кетонов объясняется особенностями распределения электронной плотности, характером заместителей, связанных с карбонильной группой, пространственной доступностью реакционных центров.
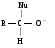
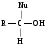
Снижение реакционной способности в реакциях АN 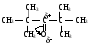 У кетонов, имеющих два радикала, обладающих +I эффектом, снижена электрофильность атома углерода, и АN реакции идут медленнее. При наличии объемных заместителей у кетонов создаются пространственные затруднения для атаки нуклеофила, и протекание АN реакций становится невозможным.  ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ. Вследствие электрофильности атома углерода связь С—Н в карбонильной группе поляризуется и легко окисляется даже слабыми окислителями, такими как оксиды и гидроксиды металлов в щелочной среде, см. табл.3. Кетоны, в отличие от альдегидов, окисляются сильными окислителями (НNО3, К2Сr2О7 в Н2SO4 и др.). Реакция окисления идет с разрывом углеродной цепи, при этом образуется смесь карбоновых кислот. Согласно правилу Попова, углеродная цепь разрывается преимущественно так, что карбонильная группа уходит с наименьшим радикалом. 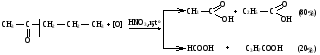 ОБЩИЙ МЕХАНИЗМ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ. СПОСОБЫ ПОВЫШЕНИЯ РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ. Полярная связь C = О в альдегидах и кетонах склонна к гетеролитическому разрыву, и реакции протекают по механизму нуклеофильного присоединения. Атом углерода имеет электрофильный характер и восприимчив к атаке нуклеофильных реагентов. 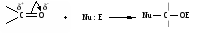 Лимитирующей стадией реакции является присоединение нуклеофила (Nu) и образование плоскостного (sр2- гибридизация) промежуточного соединения, которое затем переходит в тетраэдрический окси-анион. А затем реакция быстро заканчивается присоединением протона, обычно из растворителя. Реакции АN чувствительны к объемным заместителям, поэтому альдегиды более реакционноспособны, чем кетоны.
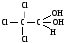
Примеры реакций нуклеофильного присоединения см. в табл.4. Скорость протекания реакций АN зависит от величины эффективного положительного заряда на атоме углерода карбонильной группы и пространственной доступности электрофильного центра. Повысить реакционную способность карбонильных соединений в АN реакциях можно двумя путями, направленными на повышение эффективного заряда на атоме углерода карбонильной группы: 1) Введением в радикал соединения сильных электроноакцепторов, как например, в 2,2,2-трихлорэтанале. 2) Использованием кислотного катализа:
В результате взаимодействия протона с основным центром образуется карбокатион. Качественные реакции на карбонильные соединения: Таблица 3
Реакции нуклеофильного присоединения (AN) к карбонильной группе альдегидов и кетонов Таблица 4
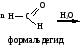
ФОРМАЛИН, ПАРАФОРМ – СВОЙСТВА И ПРИМЕНЕНИЕ В МЕДИЦИНЕ. Формалин. 40 водный раствор формальдегида в воде называется формалином. Применяется в медицинской практике как дезинфицирующее средство и консервант анатомических препаратов, так как обладает способностью денатурировать белки. При длительном хранении в формалине может выпадать белый осадок полимера формальдегида параформ:
|


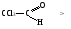
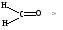
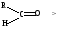

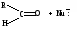
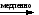
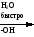
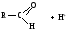

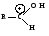
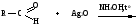
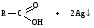 1.
1.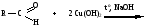
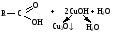 2.
2.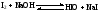
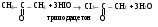
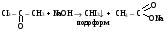 4.
4.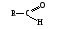
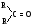
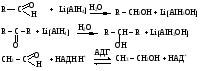 1.
1.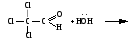
 2.
2. 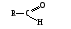
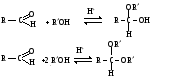
 3.
3.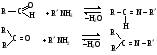
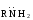 4.
4.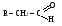
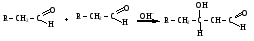
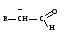 5.
5.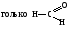
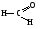
 6.
6.