цы. 1 Недостатки модели атома Томсона
 Скачать 152.23 Kb. Скачать 152.23 Kb.
|
|
1)
2) В 1913 году Франк и Герц поставили опыт, косвенно подтверждающий теорию Бора: атомы разреженного газа обстреливались медленными электронами с последующим исследованием распределения электронов по абсолютным значениям скоростей до и после столкновения. При упругом ударе распределение не должно меняться, так как изменяется только направление вектора скорости. Результаты показали, что при скоростях электронов меньше некоторого критического значения удары упруги, а при критической скорости столкновения становятся неупругими, электроны теряют энергию, а атомы газа переходят в возбуждённое состояние. При дальнейшем увеличении скорости удары снова становились упругими, пока не достигалась новая критическая скорость. Наблюдаемое явление позволило сделать вывод о том, что атом может или вообще не поглощать энергию, или же поглощать в количествах равных разности энергий стационарных состояний 3) 1 постулат Бора, который также носит название постулата стационарных состояний, гласит: каждому из стационарных (квантовых) состояний, в котором находится атомная система, соответствует определенный уровень энергии Е. Находясь в стационарном состоянии, атом не излучает. 2 постулат Бора также носит название правила частот. Он гласит, что переход атома из одного квантового состояния, характеризующегося энергией En в новое квантовое состояние, которое характеризуется энергией Em, происходит излучение или поглощение кванта энергии. Энергия кванта при этом определяется как разность энергий двух квантовых состояний: hνnm=En–Em, где h – постоянная Планка. Классическая электродинамика не могла объяснить все имевшиеся к тому времени экспериментальные данные (опыты Резерфорда, дискретные спектры атома водорода) Недостатки теории Бора. Не смогла объяснить интенсивность спектральных линий. Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других). Теория Бора логически противоречива: не является ни классической, ни квантовой. 4) 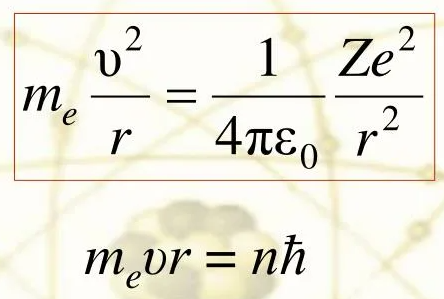 5) Главное квантовое число — целое число, для водорода и водородоподобных атомов определяет возможные значения энергии. В случаях сложных атомов нумерует уровни энергии с фиксированным значением азимутального (орбитального) квантового числа l: {\displaystyle l}0{\displaystyle n=l+1,\ l+2,\ l+3,\ \ldots .} 6) |
