контрольная химия. кр химия. 1. Произведение растворимости. Условие образования и растворения осадка
 Скачать 45.38 Kb. Скачать 45.38 Kb.
|
|
Содержание Задание 1 3 Задание 2 5 Задание 3 8 Задание 4 13 Задание 5 14 Список литературы 15 1.Произведение растворимости. Условие образования и растворения осадка. Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Например, в насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие: BaSO4 (т) = Ba2+(р) + SO42- (р). Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp = [Ba2+] [SO42-] Произведение концентраций ионов в насыщенном растворе труднорастворимого электролита при неизменной температуре является постоянной величиной. Эта величина называется произведением растворимости (ПР) Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере: ПРBaSO4 = [Ba2+] [SO42-]. Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора. Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость. Например:
В данном случае наименее растворимым является гидроксид железа (II). Для более точного выражения произведения растворимости вместо концентраций ионов труднорастворимого электролита необходимо брать активности в связи с тем, что в любом растворе имеют место межионные силы, которые искажают истинную степень диссоциации электролита. Итак с учетом активности: ПР = а(Ba2+)а(CO3 2-) Осадок образуется в тех случаях, когда ПИ ионов электролита превышает величину ПР этого соединения. ПИ > ПР образование осадка (раствор пересыщен) ПИ < ПР растворение осадка (раствор не насыщен) ПИ = ПР насыщенный раствор Условие образования осадка: [Ky+]x·[Ax-]y > ПР(KxAy). Данное условие достигают введением одноименного иона в систему насыщенный раствор - осадок. Подобный раствор является пересыщенным относительно данного электролита, поэтому из него будет выпадать осадок. Условие растворения осадка: [Ky+]x·[Ax-]y < ПР(KxAy). Это условие достигают, связывая один из ионов, посылаемых осадком в раствор. Раствор в данном случае - ненасыщенный. При введении в него кристаллов малорастворимого электролита они будут растворяться. Равновесные молярные концентрации ионов Ky+ и Ax- пропорциональны растворимости S (моль/л) вещества KxAy: 2.Титриметрический анализ. Титрование. Расчеты в титриметрическом анализе. Титриметрическим анализом называется метод количественного химического анализа, основанный на точном измерении объема раствора известной концентрации (титранта), израсходованного на реакцию взаимодействия с определяемым веществом (А). Титрант (В) добавляют к точно отмеренному объему анализируемого раствора небольшими порциями. Эта операция называется титрованием. Когда будет израсходовано количество титранта (В), эквивалентное количеству титруемого вещества (А), реакция закончится. Этот момент называется точкой эквивалентности (т. э.). При этом соблюдается так называемый закон эквивалентности (закон эквивалентов): (сHV)A =(cHV)B где cН – молярная концентрация эквивалента, моль экв/л; V – объем, мл. На практике фиксируют, как правило, конечную точку титрования (к.т.т.), т. е. такой момент, когда об окончании реакции судят по изменению окраски раствора или выпадению осадка, вызываемым какими либо из исходных соединений или продуктов реакции или специально введенными в титруемый раствор веществами – индикаторами. Требования к реакциям в титриметрическом анализе. Реакции, применяемые в титриметрическом анализе, должны удовлетворять следующим требованиям: 1. Реакция должна быть стехиометрической. Это означает, что в процессе реакции между взаимодействующими веществами должно сохраняться определенное соотношение. 2. Реакция должна протекать с достаточной скоростью, чтобы титрование можно было провести быстро. 3. Реакция должна протекать количественно. Для получения правильных результатов анализа полнота реакции в момент добавления эквивалентного количества титранта должна составлять не менее 99,9 %. 4. При титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным. 5. Необходимым условием для применения титриметрического анализа является возможность тем или иным способом фиксировать точку эквивалентности. Классификация титриметрических методов анализа. Титриметрические методы подразделяют по типу реакции, лежащей в основе метода, на четыре больших группы. Из этих групп выделяют частные методы, связанные с применением того или иного титранта.
Способы титрования. В титриметрическом анализе различают прямое, обратное и косвенное титрование. Прямое титрование. Прямое титрование основано на том, что к определенному объему раствора определяемого компонента по каплям приливают из бюретки стандартный раствор реагента (титранта). Окончание реакции узнают по изменению окраски индикатора или другим способом. Определение содержания HCl в растворе соляной кислоты с помощью NaOH представляет собой пример прямого титрования. Зная концентрацию раствора титранта и его количество, израсходованное на реакцию с определяемым веществом, можно легко вычислить содержание вещества. Обратное титрование. Если по каким-либо причинам прямое титрование невозможно (например, из-за малой скорости реакции), то применяют метод обратного титрования (титрование по остатку). Этот прием состоит в том, что к определенному объему раствора определяемого компонента приливают точно измеренный объем стандартного раствора D, взятый в избытке. Избыток не вошедшего в реакцию стандартного раствора D оттитровывают стандартным раствором B (титрантом). Косвенное титрование. В некоторых случаях прибегают к особому приему титрования, называемому косвенным, или титрованием заместителя. Сущность его заключается в том, что к определенному объему анализируемого раствора прибавляют какой-либо вспомогательный реагент, реагирующий с определяемым компонентом с выделением эквивалентного количества нового вещества (заместителя), которое оттитровывают раствором титранта. Титрование как при определении концентрации растворов, так и при выполнении количественных определений можно проводить двумя способами: методом отдельных навесок и методом пипетирования. В методе отдельных навесок берут отдельные, близкие по величине навески анализируемого вещества и, растворив каждую из них в произвольном объеме воды, целиком титруют В методе пипетирования для титрования берут не весь раствор, а только часть его (аликвоту), отмеренную пипеткой. Расчеты при приготовлении растворов. Стандартные растворы. В титриметрическом анализе растворы с точно известной концентрацией называют рабочими, или стандартными. Их можно приготовить несколькими способами: а) по точной навеске исходного вещества; б) по приблизительной навеске вещества с последующим определением точной концентрации (стандартизацией) приготовленного раствора по соответствующему стандартному раствору; в) по стандарт-титру (фиксаналу). В первом способе в качестве исходных веществ для приготовления раствора можно применять только химически чистые, устойчивые соединения, состав которых строго соответствует химической формуле. Такие вещества называют установочными, или первичными стандартами. Стандартные растворы таких веществ приготавливают растворением точной навески в воде и разбавлением полученного раствора до требуемого объема. Зная массу (m) растворенного в воде химически чистого соединения и объем (V) раствора, легко вычислить титр (Т) приготовленного раствора: T m/V(г/мл). При выполнении расчетов следует учитывать некоторые математические правила. Если точность анализа не ограничивается заранее, то следует иметь в виду, что концентрация вычисляется до четвертой значащей цифры после запятой, процентное содержание – до сотых долей. Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчетами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять. Часто в расчетах применяют поправочный коэффициент k, который показывает, во сколько раз практическая концентрация, полученная при стандартизации раствора, больше или меньше заданной (теоретической): k=cпр./стеор. 3.Хроматография. Классификация хроматографических методов (по механизму разделения веществ, агрегатному состоянию фаз, способу перемещения фаз и др.). Подвижная и неподвижная фазы, их краткая характеристика. Хроматография — наиболее часто используемый аналитический метод. Новейшими хроматографическими методами можно определять газообразные, жидкие и твердые вещества с молекулярной массой от единиц до 106 . Это могут быть изотопы водорода, ионы металлов, синтетические полимеры, белки и др. С помощью хроматографии получена обширная информация о строении и свойствах органических соединений многих классов. Применение хроматографических методов для разделения белков оказало огромное влияние на развитие современной биохимии. Хроматографию с успехом применяют в исследовательских и клинических целях в самых разных областях биологии и медицины, в фармацевтике и криминалистике: дня терапевтического мониторинга в связи с ростом нелегального употребления наркотиков, идентификации антибиотиков и отнесения их к той или иной группе антибактериальных препаратов, для определения наиболее важных классов пестицидов и для мониторинга окружающей среды. Такие достоинства как универсальность, экспрессность и чувствительность делают хроматографию важнейшим аналитическим методом. Причина успеха хроматографического метода обусловлена возможностью разделения с его помощью сложных смесей, анализ которых обычными методами затруднителен, например, смесей углеводородов, аминокислот, ионов редкоземельных элементов. Сущность метода. Газовая хроматография (ГХ) — процесс разделения компонентов смеси, основанный на различии в равновесном распределении компонентов между двумя фазами —подвижной и неподвижной. Неподвижной фазой обычно служит твердое вещество (его часто называют сорбентом) или пленка жидкости, нанесенная на твердое вещество. Неподвижную фазу обычно помещают в стеклянную (или металлическую) трубку, называемую колонкой. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу. Сущность метода ГХ состоит в следующем. Анализируемая смесь (обычно — раствор) летучих компонентов переводится в парообразное состояние и смешивается с потоком инертного газа-носителя, образуя с ним подвижную фазу — ПФ. Эта смесь проталкивается далее новой порцией непрерывно подаваемого газа-носителя и попадает в хроматографическую колонку, заполненную неподвижной (стационарной) твердой или жидкой фазой — НФ. Разделяемые компоненты распределяются между ПФ и НФ в соответствии с их коэффициентами распределения К, определяемыми формулой: K= 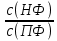 где с(НФ)и с(ПФ) — соответственно содержание (в г/мл) данного компонента в неподвижной и подвижной фазах, находящихся в динамическом равновесии. Равновесный обмен хроматографируемого вещества между НФ и ПФ осуществляется в результате многократного повторения актов сорбция-десорбция по мере движения ПФ вдоль НФ внутри хроматографической колонки. Поток газа-носителя увлекает с собой разделяемую парообразную смесь вдоль хроматографической колонки, так что процессы сорбция-десорбция разделяемых компонентов повторяется многократно, причем каждый раз в системе устанавливается динамическое равновесие разделяемых веществ между ПФ и НФ. Эти многократные переходы разделяемых веществ из ПФ в НФ и обратно совершаются по всей длине хроматографической колонки до тех пор, пока пары разделяемых веществ не покинут колонку вместе с газом-носителем. Поскольку сродство различных разделяемых веществ к НФ различно, то в процессе сорбционных—десорбционных переходов компоненты перемещаются вдоль колонки с разной скоростью. Чем больше коэффициент распределения вещества, тем дольше оно находится в НФ, тем позже покидает хроматографическую колонку. В конце концов из хроматографической колонки вместе с газом-носителем выходят зоны (объемы) парообразных хроматографируемых веществ, разделенных полностью или частично. Если для двух компонентов смеси коэффициенты распределения одинаковы, то они не разделяются. Если же их коэффициенты распределения 5 различны, то разделение происходит, причем первым покидает колонку тот компонент, у которого коэффициент распределения наименьший. Пары разделенных компонентов вместе с газом-носителем поступают в детектор хроматографа, генерирующий электрический сигнал — тем больший, чем выше концентрация компонента в парогазовой смеси. Электрический сигнал усиливается и фиксируется регистратором хроматографа в виде хроматогратмы, записываемой на диаграммной ленте или на мониторе компьютера (если таковым снабжен хроматограф). Эти хроматограммы и используются для качественной и количественной обработки результатов анализа разделяемой смеси компонентов. Хроматография — гибридный аналитический метод, сочетающей разделение и определение. Метод позволяет разделять многокомпонентную смесь, идентифицировать компоненты и определять ее количественный состав. Поэтому детектирование сигнала (а также запись и обработка его) занимает важное место. В отличие от ряда других методов, основанных на распределении компонентов между фазами, хроматография — это динамический метод, обеспечивающий многократность актов сорбции—десорбции разделяемых компонентов, так как разделение происходит в потоке подвижной фазы. Этим обусловлена большая эффективность хроматографического метода по сравнению с методами сорбции и экстракции в статических условиях, поэтому хроматографическими методами возможно быстрое разделение сложных смесей, например аминокислот или редкоземельных элементов. Классификация методов хроматографии. В основу общепринятых классификаций многочисленных хроматографических методов положены следующие признаки: агрегатное состояние подвижной и неподвижной фаз, механизм взаимодействия сорбент—сорбат, способ получения хроматограмм, техника выполнения (форма слоя сорбента), цель хроматографирования. По агрегатному состоянию фаз хроматографию разделяют на газовую и жидкостную. Газовая хроматография включает газожидкостную и газотвердофазную, жидкостная — жидкостно-жидкостную, жидкостнотвердофазвую и жидкостно-гелевую. Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе — неподвижной. По механизму взаимодействия сорбента и сорбата можно выделить несколько видов хроматографии: распределительная хроматография основана на различии в растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различии в растворимости веществ в подвижной и неподвижной жидких фазах; ионообменная хроматография — на разной способности веществ к ионному обмену; адсорбционная хроматография — на различии в адсорбируемости веществ твердым сорбентом; эксклюзионная хроматография — на различии в размерах и формах молекул разделяемых веществ, аффинная хроматография — на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов. Существуют пары веществ, реагирующих в растворах с высокой избирательностью, например антитело и антиген, фермент и его субстрат или ингибитор, гормон и соответствующий рецептор, и т. п. Если одно из соединений пары удерживается ковалентной связью на носителе, то последний можно использовать для избирательного извлечения второго соединения пары. Этим видами не исчерпываются все механизмы разделения, например, существует осадочная хроматография, основанная на образовании отличающихся на растворимости осадков разделяемых веществ с сорбентом, адсорбционно-комплексообразовательная, основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Следует помнить, что классификация по механизму весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам. По способу получения хроматоргамм различают фронтальный, элюентный и вытеснительный способ. Фронтальный способ наиболее прост по выполнению. Через хроматографическую колонку с сорбентом непрерывным потоком пропускают раствор исследуемого вещества или газовую смесь. Если компоненты различаются по сорбируемости, то соответственно этому они располагаются в колонке. Однако 7 они разделяются не полностью. В чистом виде может быть выделен лишь первый, наиболее слабо сорбирующийся компонент, который движется вдоль слоя сорбента впереди остальных. За зоной первого компонента следует в непосредственном контакте зона, содержащая первый и второй компоненты. Третья зона содержит смесь первого, второго, третьего и т.д. компонентов. В некоторый момент времени сорбент насытится и наступит «проскок», т. е. из колонки начнет выходить первый, наиболее слабо сорбирующийся компонент. Если пропускать жидкость или газ, выходящие из колонки, через детектор концентраций и наносить показания его в течение всего опыта на график, то полученная выходная кривая будет иметь форму ступенчатой кривой. Число ступеней равно числу разделяемых компонентов смеси. Элюентный (проявительный) способ выгодно отличается от фронтального тем, что он позволяет полностью разделить многокомпонентную смесь. В отличие от фронтального способа исследуемую смесь вводят в колонку в виде порции раствора или газа, а не непрерывно, как при фронтальном способе. После введения такой порции колонку промывают растворителем или газом-носителем (проявляют). На выходе из колонки детектор фиксирует непрерывно концентрацию, а связанный с ним регистрирующий прибор записывает выходную кривую в виде ряда пиков, число которых соответствует числу разделенных компонентов. Вытеснительный способ отличается от фронтального и элюентного тем, что после введения пробы исследуемой смеси колонку промывают растворителем или газом-носителем, к которым добавлены растворимое вещество или вещество в газообразном (парообразном) состоянии. Это вещество должно адсорбироваться сильнее любого из компонентов разделяемой смеси и называется вытеснителем, так как оно, обладая наибольшей адсорбируемостью, вытесняет более слабо адсорбирующиеся компоненты. Благодаря эффекту адсорбционного вытеснения, открытому Цветом, происходит вытеснение компонентов из адсорбента в последовательности, соответствующей их адсорбируемости, и компоненты полностью разделяются: при этом зоны компонентов движутся по слою адсорбента с одинаковой скоростью, соприкасаясь между собой, по направлению к выходу из колонки. К моменту полного насыщения адсорбента вытеснителем детектор запишет ступенчатую выходную кривую, отличающуюся от фронтальной кривой тем, что каждая ступень соответствует чистому компоненту. Высота ступени характеризует данный компонент с качественной стороны, а длина ступени пропорциональна количественному содержанию данного компонента в исследуемой смеси. Обязательным условием для хорошего разделения в противоположность элюентному способу является резко выраженная выпуклая форма изотерм адсорбции разделяемых компонентов и вытеснителя. А это условие выполнимо лишь в случае применения высокоактивных адсорбентов: активированных углей березового БАУ, каменноугольного антрацита АГ-2. норита и др. По технике выполнения выделяют колоночную хроматографию, когда разделение проводится в специальных колонках, и плоскостную хроматографию, когда разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография). По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию широко используют для исследования растворов, каталитических процессов, кинетики химических процессов и т. п. Хроматография в зависимости от механизма сорбции. Хроматография подразделяется на молекулярную; ситовую; хемосорбционную; ионообменную. В молекулярной хроматографии природой сил взаимодействия между неподвижной фазой (сорбентом) и компонентами разделяемой смеси являются межмолекулярные силы типа сил Ван-дер-Ваальса. К хемосорбционной хроматографии относят осадочную, комплексообразовательную (или лигандообменную), окислительно-восстановительную. Причиной сорбции в хемосорбционной хроматографии являются соответствующие химические реакции. Распределение сорбатов между подвижной и неподвижной фазам: адсорбционная хроматография, распределительная хроматография, ионообменная хроматография, осадочная хроматография, аффинная хроматография и эксклюзионная хроматография. 4.Вычислить титр 0,25 н. раствора Ca(OH)2 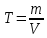 Пусть V р-ра = V мл, тогда n(Ca(OH)2)= 0,25 Vмоль, а m(Ca(OH)2) = = 0,25·74 = 18,5 Vграмм Ответ: T= 18,5 V V= 18,5 г/мл 5. Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнениях реакций HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O. H2SO4 + Cu2S → CuSO4 + SO2 + H2O. 14H+N+5O3-2 + Cu2+1S-2 → 2Cu+2S+6O4-2 + Cu+2(N+5O3-2)2 + 10N+4O2-2 + + 6H2+O-2
Cu2S - 14ē → Cu2+ + S+6 HNO3- окислитель, процесс восстановление Cu2S- восстановитель, процесс окисление 6H2S+6O42- + Cu2+1S-2 → 2Cu+2S+6O42- + 5S+4O22- + 6H2+O2-
S+6+ 2ē → S+4 Cu2S – восстановитель, процесс окисление H2SO4 – окислитель, процесс восстановление Список использованной литературы 1) Хаханина, Т. И. Аналитическая химия: учебник и практикум для СПО / Т. И. Хаханина,.Н. Г. Никитина - Москва: Юрайт, 2017. – 394 с. – ISBN 978-5-534-01463-1. 2) Апарнев, А. И. Аналитическая химия: учебное пособие для СПО / А. И. Апарнев, Г. К. Лупенко, Т. П. Александрова.- Москва: Юрайт,2019. – 107 с. – ISBN 978-5-534-07838-1. - URL: https://www.biblio-online.ru/viewer/analiticheskaya-himiya-438415#page/13 3)Ю.Я. Харитонов. Аналитическая химия, ч. 2. 4)Ю.А. Золотов. Основы аналитической химии, ч.1. 5)В.Б. Алексеевский. Физико-химические методы анализа. 6)Б.В. Столяров, И.М. Савинов, А.Г. Витенберг. Руководство к практическим работам по газовой хроматографии. |
