курсовая материаловедение. 1. Производство метанола 4 Методы получения 6
 Скачать 145.76 Kb. Скачать 145.76 Kb.
|
|
СОДЕРЖАНИЕ Введение 3 1. Производство метанола 4 2. Методы получения 6 3. Технологические свойства получения метанола 7 4. Свойства метанола и его применение 10 5. Коррозийная активность метанола и его соединений 13 6. Коррозия металлов при синтезе метанола 14 7. Требование к хранению метанола и работе с ним 15 Заключение 17 Список литературы 18 ВВЕДЕНИЕ Производство метанола относится к числу коррозионноопасных процессов. Коррозия металла, вызываемая действием некоторых газов при определенных условиях, может служить причиной различного рода аварий и разрушений технологического оборудования и трубопроводов. Коррозиционные процессы отличаются большой сложностью и специфичны для каждого производства. Скорость и глубина коррозии зависят от зависят от химической активности и концентрации корродирующего вещества, от температуры и давления среды, материала аппарата, наличия или отсутствия влаги, а также веществ, ускоряющих или замедляющих процесс коррозии. Металлы и сплавы вследствие химического или электрохимического воздействия внешней среды изменяют структуру и подвергаются поверхностному разрушению. такое явления называется коррозией. 1. Производство метанола. Метанол по значению и объемам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью. Области применения: для получения пластических масс, синтетических волокон, синтетического каучука, в качестве растворителя, для микробиологического синтеза и т.д. Метанол впервые был обнаружен Р. Бойлем в 1661 году в продуктах сухой перегонки древесины (отсюда название метанола – древесный спирт). В чистом виде выделен в 18344 году Ж. Дюма и Э. Пелиго, установившими его формулу. Промышленное производство метанола из водорода и оксида угдерода (II) впервые было осуществлено в 1923 году и с тех пор непрерывно совершенствуется. В нашей стране производство метанола впервые организовано в 1934 году в объеме 30 т в сутки на Новомосковском химическом комбинате из водяного газа газификацией кокса. В качестве сырья для получения метанола могут использоваться: природный газ, синтез-газ производства ацетилена, газы нефтепереработки, твердое топливо. Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2, СО, СО2, может изменить структуру сырьевой базы производства метанола, и неудобный для транспортировки уголь будет превращен в удобный для хранения, транспортировки и использования метанол. Синтез метанола основан на обратимых реакциях, описываемых уравнениями: СО + 2Н2 СО2 +3Н2 Реакции (5.4.) и (5.5.) – обратимы, экзотермичны и протекают с уменьшением объема. С термодинамической точки зрения для смещения равновесия в сторону образования метанола необходимо проводить процесс при низких температурах и высоком давлении. Однако, для увеличения скорости реакции необходимо повышение температуры. При этом выбирая температурный режим, следует учитывать образование побочных продуктов: метана, высших спиртов, кетонов и эфиров. Некоторые побочные реакции: СО + 3Н2 = СН4 + Н2О (7.6.) 2СО + 4Н2 = (СН3)2О + Н2О (7.7.) 4СО + 8Н2 = С4Н9ОН + 3Н2О (7.8.) 2СО = СО2 + С (7.9.) т.е. процесс получения метанола является сложным. Побочные реакции обуславливают бесполезный расход синтез-газа и удорожают очистку метанола. Применяемый для синтеза метанола катализатор должен обладать высокой селективностью, т.е. максимально ускорять образование метанола при одновременном подавлении побочных реакций. Для синтеза метанола предложено много катализаторов. Лучшими оказались катализаторы, основными компонентами которых являются оксид цинка или медь. Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие катализаторы – необратимо. Необходима также тщательная очистка газа от карбонила железа, который образуется в результате взаимодействия оксида углерода с железом аппаратуры. На катализаторе карбонил железа разлагается с выделением элементного железа, что способствует образованию метана. Процесс получения метанола осуществляется либо на цинк-хромовом катализаторе при давлении 30 МПа, либо на низкотемпературном медьсодержащем катализаторе при давлении 5 МПа. Цинк-хромовый катализатор работает в области температур 370-3900С, медьсодержащий – 220-2800С. Таким образом, процесс получения метанола является гетерогенно-каталитическим. Лимитирующая стадия – адсорбция водорода на поверхности катализатора. Для смещения равновесия реакции вправо процесс проводят с избытком водорода, при следующем соотношении исходных компонентов- Н2: СО= 2,15-2,30. Кроме того, водород ускоряет процесс, обладая высокой теплопроводностью, позволяет проводить процесс в узком температурном интервале, гидрирует продукты уплотнения на катализаторе, чем повышает срок его службы. С возрастанием объемной скорости газа выход метанола падает. Такая закономерность основана на том, что с увеличением объемной скорости уменьшается время контакта газа с катализатором и, следовательно, концентрация метанола в газе, выходящем из реактора. С увеличением объемной скорости подачи сырья содержание метанола в газе снижается, однако за счет большего объема газа, проходящего в единицу времени через тот же объем катализатора, производительность последнего увеличивается. На практике процесс синтеза метанола осуществляют при объемных скоростях 20 000-40 000 ч-1. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержится только –4% метанола. С целью возможно более полной переработки синтез-газа необходимо его возвращение в цикл после выделения метанола и воды. При циркуляции в синтез-газе накапливаются инертные примеси, что приводит к снижению давления в системе и повлечет за собой снижение выхода и скорости процесса. Поэтому концентрацию инертных примесей регулируют частичной отдувкой циркуляционного газа. Отдувка проводится с таким расчетом, чтобы количество инертов, поступающих со свежем синтез-газом, было равно количеству инертов, удаляемых с отдувкой. 2. Методы получения. Долгое время метанол получали исключительно сухой перегонкой древесины. Этот способ достаточно трудоемкий и дорогой, так как из 1м3 березовых дров можно получит лишь 5-6кг метанола. Производство метанола синтезом из оксида углерода и водорода впервые было организовано в Германии в 1923г. Метанол получают различными методами, отличающимися исход ным сырьем, способами его переработки в технологический газ, а также условиями проведения синтеза метанола. В н.в. основной способ получения метанола – синтез из оксида углерода и водорода (эта смесь называется синтез-газом). Смесь окиси углерода и водорода производят путем конверсии метана. Синтез метанола по физико-химическим условиям его проведения и по технологическому оформлению аналогичен синтезу аммиака. Как азото-водородную смесь, так и синтез-газ можно получить конверсией природного газа. В обоих процессах взаимодействие смесей тщательно очищенных газов происходит в присутствии катализатора. Из-за малого выхода конечных продуктов и тот и другой процессы являются непрерывно циклическими, причем реакцию никогда не ведут до полного превращения. Такая аналогия дала возможность вести оба синтеза на подобных установках, которые монтируют в составе одного завода. 3. Технологические схемы производства метанола. Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза. Газ предварительно очищается от карбонила железа, сернистых соединений, подогревается до температуры начала реакции и поступает в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс. 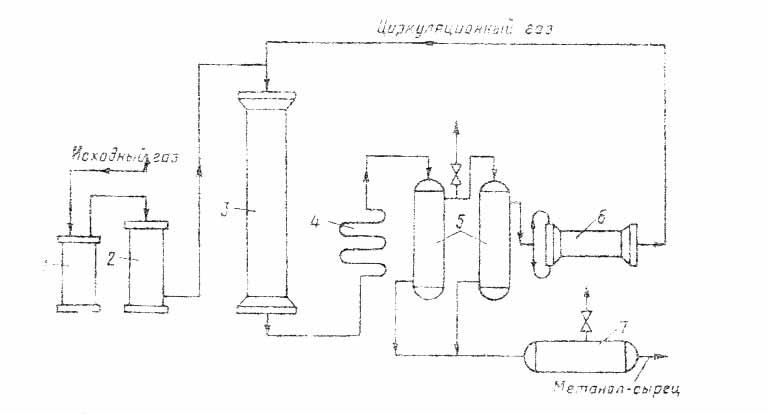 Схема агрегата синтеза с совмещенной насадкой колонны: 1, 2 –фильтры (масляный и угольный), 3 –колонна синтеза, 4 –холодильник-конденсатор, 5 –сепараторы, 6 –компрессор, 7 –сборник. Сжатый до 32 МПа синтез-газ проходит очистку в масляном фильтре 1 и в угольном фильтре 2, после чего смешивается с циркуляционным газом и поступает в колонну синтеза 3. Из колонны синтеза выходят метанол-сырец и непрореагировавший синтез газ (Н2 + СО). Смесь направляется в холодильник-конденсатор 4, где охлаждается до 300С и продукты синтеза конденсируются. Метанол-сырец отделяют в сепараторе 5, направляют в сборник 7 и выводят на ректификацию. Газ проходит второй сепаратор 5 для выделения капель метанола, компримируется до давления синтеза турбоциркуляционным компрессором 6 и возвращается на синтез. Продувочные газы выводят перед компрессором и используют в качестве топлива. Смешанный газ, пройдя кольцевой зазор между катализаторной коробкой и корпусом колонны 3, поступает в межтрубное пространство теплообменника, расположенного в нижней части колонны. В теплообменнике газ нагревается до 3300С и по центральной трубе, в которой размещен электроподогреватель, поступает в верхнюю часть колонны и проходит последовательно пять слоев катализатора. 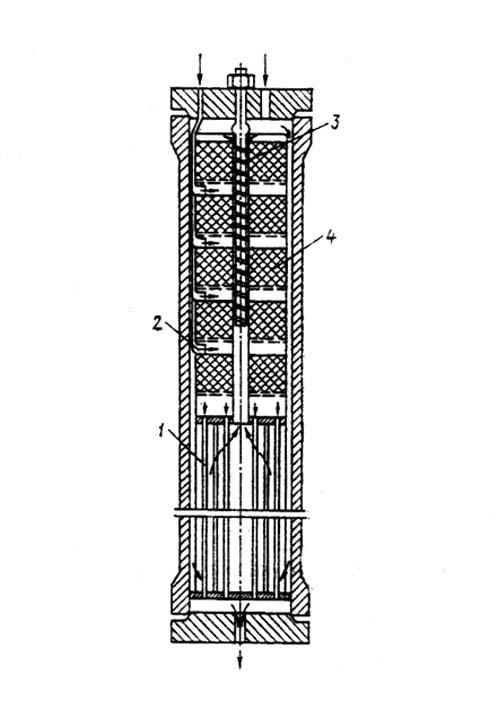 Колонна синтеза метанола: 1 –теплообменник, 2 –холодный байпас, 3 –электроподогреватель, 4 –катализатор. После каждого слоя катализатора, кроме последнего, в колонну вводят определенное количество холодного циркуляционного газа для поддержания необходимой температуры. После пятого слоя катализатора газ направляется в теплообменник, где охлаждается до 1300С и выходит из колонны. Размещение теплообменника внутри корпуса колонны, подача смешанного газа в колонну синтеза метанола через кольцевой зазор между катализаторной коробкой и корпусом колонны, значительно снижает потери тепла в окружающую среду ( принцип наилучшего использования энергии). Процесс производства метанола при низком давлении включает практически те же стадии, но имеет некоторые особенности. 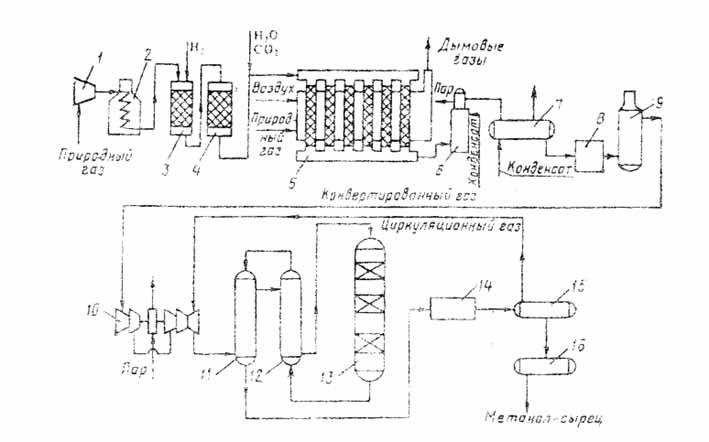 Схема производства метанола при давлении 5 МПа: 1, 10 –турбокомпрессоры, 2 –подогреватель природного газа, 3 –реактор гидрирования сернистых соединений, 4 –адсорбер, 5 –трубчатый конвектор, 6 –котел-утилизатор, 7, 11, 12 –теплообменники, 8, 14 –холодильники-конденсаторы, 9, 15 –сепараторы, 13 –колонна синтеза, 16 –сборник. Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4 : Н2О : СО2 = 1 : 3,3 : 0,24. Смесь направляют в трубчатый конвектор 5, где на никелевом катализаторе происходит пароуглекислотная конверсия при температуре 850-8700С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках. Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280-2900С. Затем теплоту газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35-400. Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до 220-2300С. Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов. Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращается на синтез, продувочные газы отдают на сжигание в трубчатую печь. Вследствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата. 4. Свойства метанола и его применение Метанол по значению и масштабам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью. Он широко применяется для получе ния пластических масс, синтетических волокон, синтетического каучу ка. Высокой растворимостью газов в метаноле широко пользуются в промышленности, применяя метанол и его растворы в качестве поглотителя для извлечения примесей из технологических газов. Метиловый спирт – важный вид сырья для получения формальдегида, ингибиторов, антидетонационных смесей, антифризов, лаков, красок и других продуктов. В чистом виде применяется как высокооктановая добавка к топливу. Метанол (метиловый спирт) СН3ОН представляет бесцветную легкоподвижную жидкость с температурой кипения 650С, температурой кристаллизации –97.90С и плотностью 0.792 т/м3. Критическая температура метанола 239.650С. Метанол горюч. Температура вспышки 80С, пределы взрываемости паров в воздухе 5.5-36.5%. Метанол смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и др. органическими растворителями. Пары сухого метанола образуют с воздухом взрывчатые смеси. Метанол токсичен, вызывает отравление через органы дыхания, кожу и при приеме внутрь, действуя на нервную и сосудистую систему. ПДК составляет 5 мг/м3. Прием внутрь 5-10 см3 приводит к тяжелому отравлению, вызывает слепоту, доза 30 см3 – смертельна. Метанол – сильный яд кумулятивного действия, оказывает также слабое наркотическое действие. Известно несколько способов получения метанола: сухая перегонка древесины и лигнина, термическое разложение солей муравьиной кислоты, синтез из метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа. Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 25—35 МПа на цинк-хромовом катализаторе (ZnO/Cr2O3) при температуре 320—450 °C. Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах, промотированных цинком, хромом и др., при 200—300 °C и давлении 3,5—5,5 МПа, разработанный в Англии. Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях:
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:{\displaystyle {\mathsf {CO+2H_{2}\rightarrow CH_{3}OH}}} До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ неактуален. Молекулярная формула — CH4O или CH3—OH, структурная: 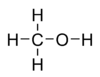 Производство метанола (в тыс. тонн):
В органической химии метанол используется в качестве растворителя. Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др. Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Благодаря высокому октановому числу, позволяещему увеличить степень сжатия до 16, увеличивая тем самым удельную мощность двигателя; метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:{\displaystyle {\mathsf {2CH_{3}OH+3O_{2}\rightarrow 2CO_{2}+4H_{2}O}}} Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия. Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено в России запрещено использование метилового спирта в средствах по уходу за автотранспортом, а также продажа населению указанных средств, содержащих метанол При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы(метиловый спирт, гликоли). Используется в топливных элементах. Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку. Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53. Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол): 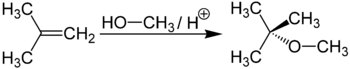 Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98. Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля. 5. Коррозийная активность метанола и его соединений. Смеси трихлорбензола и метанола в условиях насыщения их хлористым водородом обладают также высокой коррозионной активностью. Метанол аналогично воде хорошо растворяет хлористый водород, образуя агрессивную среду (НС СН3ОН). Среды, содержащие влажный технический метанол, более агрессивны по отношению к металлам и сплавам, чем среды с обезвоженным метанолом. Это объясняется тем, что технический метанол содержит до 5% Н2О и при пропускании хлористого водорода образуется одновременно два коррозионных агента — НС -СН3ОН и соляная кислота. Коррозионная активность бензино-метанольных смесей значительно ниже, чем у чистого метанола, однако в ряде случаев существенна и сильно зависит от присутствия воды. Например, в смесях с содержанием 10—15% метанола сталь, латунь и медь не корродируют, алюминий же корродирует медленно с изменением цвета. Метанол привлекает прежде всего широкими сырьевыми возможностями Его можно производить из газа, угля, древесины, биомассы, различного рода отходов и др. Использовать метанол можно непосредственно как топливо или как промежуточное сырье для получения различных соединений. Добавление 5% метанола в бензин нефтяного происхождения не вызывает каких-либо трудностей в эксплуатации двигателей и уже сейчас практикуется в некоторых странах. Наряду с преимуществами метанол имеет и недостатки, над преодолением которых в настоящее время работают и у нас в стране и за рубежом. К недостаткам метанола следует отнести его высокую токсичность, меньшую теплоту сгорания, высокую теплоту испарения, коррозионную активность, гигроскопичность и др. Тем не менее широкие сырьевые ресурсы позволяют считать метанол перспективным топливом. Ведутся работы по применению метанола не только в двигателях с принудительным зажиганием , но и в дизелях. Чистые метанол, аммиак и амины не проявляют коррозионной активности по отношению к углеродистой стали. Агрессивность исходной и, особенно, реакционной смеси обусловлена побочными продуктами, образующимися в небольших количествах в процессе синтеза. Растворы хлористого водорода в метаноле обладают высокой коррозионной активностью. Они более агрессивны по отношению к металлам и сплавам, чем водные растворы той же концентрации. С увеличением содержания хлористого водорода в метаноле скорость коррозии металлов возрастает. 6. Коррозия металлов при синтезе метанола. В условиях синтеза метанола, как и при синтезе аммиака, наблюдается водородная коррозия металла деталей насадок колонн синтеза и, кроме того, специфический процесс карбонильной коррозии, обусловленный образованием парообразного пентакарбонила железа по реакции По масштабам производства водород среди газов занимает одно из первых мест. Его годовое производство исчисляется миллиардами кубометров. В промышленности он используется преимущественно в каталитических процессах, где особенно нежелательны примеси, которые отравляют катализаторы, вызывают коррозию оборудования, побочные реакции. К таким процессам относится синтез аммиака, углеводородов, метанола и высших спиртов, хлористого водорода, реакции гидрирования, оксосинтез и др. В ракетной технике водород в жидком виде применяется как топливо. Широко используется в исследованиях космоса (в США более трети всего производимого в стране чистого водорода), при термической обработке металлов, в порошковой металлургии, при отжиге вольфрамовых нитей в электровакуумной промышленности он служит защитной и восстановительной атмосферой. Запатентован способ приготовления никеля в смеси с металлами из группы серебра или железа, восстановленного водородом при 550°. Свицин предложил способ приготовления стабильного никелевого катализатора для гидрогенизации жиров, осажденного электролитическим путем на меди или железе. Айки приготовил активный никелевый катализатор путем электролитической коррозии, Никелевый катализатор для синтеза метанола можно получить, добавляя 5 г муравьинокислого никеля в раствор, содержащий 50 г муравьинокислого хрома в 350 см кипящей воды, к которой добавлено 150 г активированного угля. Смесь выпаривается до получения сухого остатка, предпочтительно в открытой чашке. Никелевый катализатор для превращения нитробензола в анилин готовят перемешиванием раствора уксуснокислого никеля с водородом под давлением 30 —40 ат, при температуре 60 —80° и промыванием полученного осадка. Смесь кизельгура и углекислого кальция смешивают с мелкодисперсным никелем, восстановленным водородом при 100 градусов по Цельсию, под давлением 40 атмосфер. Современные способы производства синтеза аммиака, мочевины, метанола, процессы переработки нефти и получения искусственного жидкого топлива, процессы гидрогенизации и т. п. проводятся не только при высоких температурах, но и при высоких давлениях. Некоторые газовые среды, которые при обычных температурах и давлениях не вызывают коррозии даже углеродистых сталей, при высоких температурах и давлениях становятся весьма агрессивными для многих металлов и высоколегированных сплавов. Так, технология получения синтетической соляной кислоты связана с воздействием на конструкционные материалы хлора при 800° С. Колонны синтеза аммиака работают при 500—600° С и давлениях до 100 Мн/л1 . Синтез метанола и изобутапола также осуществляется в аппаратах высокого давления и при высоких температурах и т. д. Таким образом, в процессе этерификации коррозионная активность среды возрастает из-за введения полярных растворителей — метанола, воды, которые способствуют повышению константы ионизации Н2504, и образования промежуточных продуктов синтеза — муравьиной и уксусной кислот. К факторам, снижающим скорость коррозии, относятся понижение температуры на стадии этерификации до 87—95 °С и образование эфира(ММА). Коррозионная активность ацетона, диметило-вого эфира, метилакрилата, метилизобутирата по отношению к металлам не выше, чем у ММА, поэтому указанные примеси в составе сред идут под общим названием органические примеси. 7. Требование к хранению метанола и работе с ним. Хранение осуществляется в полностью герметичных резервуарах, исключающих возгорание и контакт с персоналом. Резервуары должны быть заземлены, снабжены вентиляцией, устройствами для предотвращения парообразования и окружены защитными насыпями или рвами. Не допускайте совместного хранения метанола с несовместимыми веществами. В диапазоне температур окружающего воздуха безводный метанол не вызывает коррозии большинства металлов, за исключением свинца и магния. Однако покрытия из меди (или её сплавов), цинка (включая оцинкованную сталь) или алюминия непригодны для резервуаров, поскольку они подвергаются медленному воздействию метанола. Как правило, требованиям удовлетворяют сварные резервуары. Они должны быть спроектированы и смонтированы в соответствии с технологией, предусмотренной для применяемого материала. Рекомендуемым материалом для конструкции являются мягкие сорта стали. Резервуары с использованием медных сплавов (включая медные покрытия), цинка (включая оцинкованную сталь), алюминия или пластика для хранения метанола непригодны. В местах хранения, использования и проведения работ с метанолом не допускается курение и разведение открытого огня. Пользуйтесь электрооборудованием, снабженным защитой от искрообразования. Убедитесь, что всё оборудование надежно заземлено. ЗАКЛЮЧЕНИЕ Для хранения больших количеств метанола пригодны обычные ем кости-хранилища с плоскими днищами. Они должны быть обору дованы необходимыми защитными приспособлениями, поскольку продукт легко воспламеняется. В качестве конструкционных материалов для хранилищ пригод ны обычные углеродистые стали. Конечно, необходимо учитывать, что обводненный метанол может вызывать их коррозию, ибо вода растворяет ржавчину. Поэтому на стенки емкостей-хранилищ реко мендуется наносить защитные покрытия (из цемента или обожжен ных лаков). Устойчивы к метанолу полиэтилен и полипропилен, а при не слишком высоких температурах — полиизобутилен, поли эфиры и поликарбонаты [117] (но не полиамиды). Из числа эла стомеров к метанолу устойчивы стирол-бутадиеновый, хлор-бута диеновый каучуки, хлорированный бутил-каучук, а также сополи мер этилена и пропилена (но не нитрильиый каучук). Для перевозки чистого метанола рекомендованы емкости из алюминия: метанол, содержащий воду, корродирует их только вы ше 50 °С. Проблемы коррозии приобретают особое значение в слу чае хранения и транспортирования технического метанола из-за присутствия продуктов его окисления — формальдегида и муравьи ной кислоты. СПИСОК ЛИТЕРАТУРЫ 1. chem21.info Сайт "Справочник химика 21 века" представляет набор выдержек (цитат) из более чем 10 тысяч книг и учебников по химии. 2. Материаловедение и технологии конструкционных материалов: учебное пособие. Сибирский федеральный университет • 2015 год3. Ю. П. Солнцев Материаловедение: Учебник для вузов / Ю. П. Солнцев, Е. И. Пряхин - ХИМИЗДАТ, 2007г 4. https://ru.wikipedia.org/wiki 5. http://ru-ecology.info/term/16653/ 6. . Конструкционные материалы – Справочник. Арзамасов Б.Н. Брострем В.А. Буше Н.А. Бфков Ю.А. М.:Машиностроение 1990г. |
