Химия ответы на вопросы. 1. Строение вещества и реакционная способность. Строение атома
 Скачать 352.12 Kb. Скачать 352.12 Kb.
|
0,70в), то фактически в указанных условиях будет выделяться и цинк. Таким образом, при электролизе на катоде легче всего будут разряжаться те ионы, для которых суммарное значение потенциала и перенапряжение наиболее велико. |
| |
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
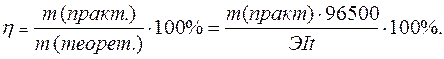
37. Электролитическое получение и рафинирование металлов.
Электролитическим рафинированием получают металлы высокой степени чистоты (99,95—99,995%). Такие металлы по сравнению с технически чистыми металлами обладают более высокими электрической проводимостью, пластичностью, светоотражательной способностью, а некоторые металлы, например алюминий, отличаются высокими антикоррозионными свойствами.
Сущность электролитической очистки металла от примесей заключается в анодном растворении в электролите технического металла (Мет) и получении металла в чистом виде (Меч) катодным восстановлением его катионов из электролита.
38. Основы гальванических методов нанесения металлических покрытий.
Гальваника - это технологический процесс получения металлических покрытий путем осаждения требуемого элемента на поверхность детали из раствора солей.
Гальванические покрытия могут быть получены химическим и электрохимическим способом. Электрохимическим называется способ получения металлического неорганического покрытия в электролите под действием электрического тока от внешнего источника. Химическим называется способ получения металлического неорганического покрытия в растворе солей без наложения на него электрического тока.
Процесс электролиза состоит из следующих этапов:
получение в электролите ионов осаждаемого металла;
перенос полученных ионов к детали-катоду;
переход ионов металла в атомарное состояние;
осаждение атомов на поверхности детали;
формирование кристаллической решетки.
39. Аккумуляторы.
Аккумуляторы — это химические источники тока с обратимым процессом: они могут отдавать энергию, преобразуя химическую энергию в электрическую, или накапливать энергию, преобразуя электрическую энергию в химическую.
40. Коррозия металлов. Основные виды коррозии.
Корро́зия, ржавление, ржа — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
Равномерная – охватывает всю поверхность равномерно
Неравномерная
Избирательная
Местная пятнами – корродируют отдельные участки поверхности
Язвенная (или питтинг)
Точечная
Межкристаллитная – распространяется вдоль границ кристалла металла
Растрескивающая
Подповерхностная
41. Классификация коррозионных процессов.
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
42. Электрохимическая коррозия.
Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
Анодного – металл в виде ионов переходит в раствор.
Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
43. Методы борьбы с коррозией металлов: защитные покрытия, легирование, электрохимическая защита.
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия.
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
44. Ингибиторы коррозии.
Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла . Ингибитором коррозии может быть как одно соединение, так и смесь нескольких.
По типу среды ингибиторы коррозии различают:
- ингибиторы нейтральных коррозионных сред;
- атмосферной коррозии;
- ингибиторы кислых сред;
- сероводородной коррозии;
- ингибиторы нефтяных сред.
Классификация ингибиторов коррозии по механизму действия:
- пассивирующие ингибиторы;
- адсорбционные ингибиторы.
