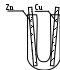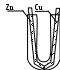Шаблон отчета к ЛР8 (1). Коррозия и защита металлов
 Скачать 111.5 Kb. Скачать 111.5 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №8 по дисциплине «Химия» Тема: Коррозия и защита металлов
Санкт-Петербург 2020 Цель работы: сформулировать цель работы. Основные теоретические положения Коррозия это – это Химическая коррозия – … Электрохимическая коррозия – Металл (или участок металла) с более отрицательным электродным потенциалом выступает в качестве анода. На аноде протекает процесс окисления/восстановления металла, который можно записать: Me0 – nē Men+ Менее активный металл (участок металла) является катодом. На катоде протекает процесс окисления/восстановления. Катодные процессы протекают с участием молекул и ионов среды, и отличаются в зависимости от среды, в которой протекает коррозия: – в кислой среде: … – в кислой среде с участием растворенного кислорода: … – в нейтральной и щелочной среде: … – в нейтральной и щелочной среде с участием растворенного кислорода: … Основные методы защиты от коррозии: (перечислить не менее 3х разных методов, привести примеры). Протокол наблюдений Студентам, выполнившим работу очно, привести подписанный протокол наблюдений. Студентам, кто НЕ выполнял работу очно протокол приводить не надо, но в обработке результатов написать наблюдения. Обработка результатов Опыт 14.2. Коррозия двух контактирующих металлов 14.2.1 Записать уравнения возможных реакций, полуреакции окисления и восстановления. Объяснить, почему реакция цинка с кислотой протекает, а с медью – нет.
14.2.2 Записать уравнения возможных реакций при контакте пластин цинка и меди, указать какой металл является анодом, а какой катодом, расписать анодный и катодный процессы. Объяснить, почему выделение водорода наблюдается и на медной пластине, а также, почему процесс выделения водорода интенсифицируется.
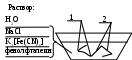
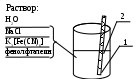
Опыт 14.3. Влияние механических напряжений в металле на его коррозию. Записать катодный и анодный процессы, отметить на каком участке проволоки какой процесс протекает (подтвердить качественной реакцией на ионы Fe2+ и ионы OH-). Объяснить, почему процесс окисления железа активнее протекает на деформированных участках.
Опыт 14.4. Влияние неравномерной аэрации на процесс коррозии Записать катодный и анодный процессы, отметить на каком участке пластины какой процесс протекает (подтвердить качественной реакцией на ионы Fe2+ и ионы OH-). Объяснить, почему процесс окисления железа протекает на погруженном в раствор участке, а процесс восстановления у поверхности.
Опыт 14.5. Действие стимулятора коррозии Записать уравнения химических реакций, полуреакции окисления и восстановления. Объяснить, почему вытеснение меди из раствора CuCl2 протекает быстрее, чем из раствора CuSO4.
Опыт 14.6. Защитное действие оксидной пленки Записать уравнение образования жидкого сплава ртути и алюминия – амальгамы алюминия. Записать уравнение реакции алюминия с водой, полуреакции окисления и восстановления. Объяснить, почему реакция протекает только в месте образования амальгамы алюминия и не протекает на всей поверхности алюминиевой пластины.
Опыт 14.8. Анодное и катодное покрытия Для каждой пластины указать какой металл является анодом, а какой катодом, расписать анодный и катодный процессы. Записать качественную реакцию на ионы Fe2+. Какое покрытие является катодным, какое – анодным? Какое покрытие продолжает защищать металл при нарушении целостности?
Опыт 14.9. Протекторная защита Для свинцовой пластины: запишите уравнение химической реакции, полуреакции окисления и восстановления; качественную реакцию на ионы Pb2+. Для пары пластин: запишите уравнение химической реакции, определите какой металл является анодом, а какой – катодом и напишите анодный и катодный процессы. Объясните суть протекторной защиты.
Опыт 14.10. Влияние ингибитора на коррозию металла Запишите уравнение химической реакции, полуреакции окисления и восстановления; качественную реакцию на ионы Fe2+. Объясните, почему в присутствии уротропина реакция протекает менее активно.
Выводы: при формулировании выводов к работе обратите внимание на названия опытов, которые были проделаны. |