Пособие по Коррозии. Учебное пособие _Коррозия и защита оборудования от коррозии _. Учебное пособие Коррозия и защита оборудования от коррозии 2013 г. Закирова Е. В. Преподаватель спецдисциплин
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Министерство образования и Науки Самарской области ГБОУ СПО «НОВОКУЙБЫШЕВСКИЙ НЕФТЕХИМИЧЕСКИЙ ТЕХНИКУМ» Учебное пособие Коррозия и защита оборудования от коррозии 2013 г. Закирова Е.В. Преподаватель спецдисциплин. Коррозия и защита оборудования от коррозии: Учеб. пособие. Изд-во Пенз. гос. ун-та, 2013. - с.: 55 ил., 20 табл. Изложены теоретические основы химической и электрохимической коррозии. Рассмотрена коррозия металлов в атмосферных условиях, в почве и под водой, а также показано влияние внутренних, внешних, механических факторов и конструктивных особенностей химических машин и аппаратов на скорость электрохимической коррозии. Дана характеристика химического сопротивления металлических и неметаллических конструкционных материалов. Приведена классификация методов защиты от коррозии по механизму действия и способам защиты. Описаны металлические и неметаллические защитные покрытия, ингибиторы коррозии, электрохимическая защита. Даны конкретные примеры защиты химических машин и аппаратов от коррозии в различных условиях. Пособие предназначено для студентов специальностей 240113 «Химическая технология органических веществ», 240134 «Переработка нефти и газа», 150415 «Сварочное производство», 150411 «Монтаж и техническая эксплуатация промышленного оборудования» , но может быть полезно для студентов вечернего отделения и других специальностей, интересующихся вопросами коррозионных разрушений и защитой от них. СОДЕРЖАНИЕ ВВЕДЕНИЕ 1 КЛАССИФИКАЦИЯ ПРОЦЕССОВ КОРРОЗИИ………………………… 2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ 2.1 Возникновение электродного потенциала 2.2 Строение двойного электрического слоя 2.3 Термодинамика коррозионных электрохимических процессов 2.4 Коррозионные гальванические элементы и электродные реакции 2.5 Механизм растворения металлов 2.6 Пассивность металлов 2.7 Влияние различных факторов на скорость электрохимической коррозии 3 КОРРОЗИЯ МЕТАЛЛОВ В РАЗЛИЧНЫХ УСЛОВИЯХ 3.1 Атмосферная коррозия 3.2 Подземная коррозия 3.3 Морская коррозия 3.4 Коррозия в расплавленных солях 3.5 Биохимическая коррозия 4 ЛОКАЛЬНАЯ КОРРОЗИЯ 4.1 Межкристаллитная коррозия 4.2 Точечная (питтинговая) коррозия 4.3 Контактная коррозия 4.4 Щелевая коррозия 5 ХИМИЧЕСКАЯ КОРРОЗИЯ 5.1 Газовая коррозия 5.2 Химическая коррозия в неэлектролитах 6 КЛАССИФИКАЦИЯ МЕТОДОВ ЗАЩИТЫ КОНСТРУКЦИЙ ОТ КОРРОЗИИ 7 КОРРОЗИОННОСТОЙКИЕ И ЖАРОСТОЙКИЕ КОНСТРУКЦИ- ОННЫЕ МАТЕРИАЛЫ 7.1 Характеристика коррозионной стойкости металлов 7.2 Коррозионностойкое легирование металлов 7.3 Жаростойкое легирование металлов 7.4 Классификация коррозионноустойчивых сплавов 7.5 Коррозионностойкие сплавы на основе железа 7.6 Коррозионная стойкость медных сплавов 7.7 Коррозионная стойкость алюминиевых сплавов 7.8 Поведение металлов и сплавов в агрессивных химических средах 7.9 Неметаллические конструкционные материалы. Процессы старения 8 МЕТАЛЛИЧЕСКИЕ ЗАЩИТНЫЕ ПОКРЫТИЯ 9 НЕМЕТАЛЛИЧЕСКИЕ ЗАЩИТНЫЕ ПОКРЫТИЯ 10 ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ УМЕНЬШЕНИЕМ АГРЕССИВНОСТИ КОРРОЗИОННОЙ СРЕДЫ 10.1 Обработка коррозионной среды 10.2 Ингибиторы коррозии 11 ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА 12 МЕТОДЫ ИССЛЕДОВАНИЯ И КОНТРОЛЯ КОРРОЗИОННЫХ ПРОЦЕССОВ 12.1 Классификация методов коррозионных исследований 12.2 Критерии оценки коррозионных эффектов 12.3 Методы коррозионных испытаний 14.4 Мониторинг коррозионных процессов СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ ВВЕДЕНИЕ Современное развитие химической промышленности, разработка новых технологических процессов, протекающих в агрессивных средах, предъявляют к конструкционным материалам высокие требования. Наиболее важными конструкционными материалами являются металлы и их сплавы. В процессе эксплуатации изделий, вследствие химического или электрохимического взаимодействия их с окружающей средой происходит коррозия, что приводит к разрушению металлических конструкций, аппаратов, трубопроводов и др. Коррозия начинается с поверхности металла и, при дальнейшем раз- витии этого процесса, распространяется вглубь. Средой, в которой про- исходит коррозия металлов, являются различные жидкости и газы. Коррози- онный процесс протекает на границе двух фаз: металл – окружающая среда, т. е. является гетерогенным процессом взаимодействия жидкой или газооб- разной среды с металлом. Широкое применение в химической промышлен- ности находят сплавы железа, меди, алюминия, никеля, титана и др. Даль- нейшее развитие техники выдвигает проблему применения таких металлов, как тантал, цирконий, рений, германий, торий, иридий. Масштабы коррозии и убытки, причиняемые ею, станут очевидными, если учесть, что около 10% всего производимого металла безвозвратно теря- ется вследствие разрушающего действия коррозии. Экономические потери от коррозии можно разделить на прямые и косвенные. Прямые потери вклю- чают стоимость заменяемых металлических конструкций и механизмов или их частей, стоимость коррозионностойких металлов и сплавов, применяемых вместо материалов, имеющих те же механические свойства, но нестойких к коррозии, стоимость различных видов защиты от коррозии и т. д. К косвен- ным потерям относятся расходы, связанные с простоем оборудования во время замены части машины или аппарата, разрушаемых коррозией, с загрязнением выпускаемых изделий продуктами коррозии и др. Повышение цен на энергоресурсы и металлы до мирового уровня при- вело к резкому сокращению и объемов, и областей применения нержавею- щих сталей, титана. Одновременно повышается интерес к современным по- лимерным коррозионностойким материалам в области химического машино- строения. Химические, физические и биологические загрязнения природной среды приводят к заметной интенсификации коррозионных процессов. Понятия о необходимости и достаточности противокоррозионной защиты должны кор- ректироваться с учетом экологической обстановки. С другой стороны, коррозионные повреждения часто оказываются при- чиной крупномасштабных загрязнений окружающей среды. Лидерами здесь являются нефтедобыча, транспорт нефтепродуктов, нефтехимическая и хи- мическая промышленности. Общие убытки, причиняемые народному хозяй- ству от коррозии металлов, огромны. Для правильной постановки практиче- ской работы по защите химических машин и аппаратов от коррозии необ- ходимо знание теории процессов коррозии и методов борьбы с ней. 1 КЛАССИФИКАЦИЯ ПРОЦЕССОВ КОРРОЗИИ Коррозией называют процесс разрушения металлов при химическом, электрохимическом и биохимическом взаимодействии их с окружающей средой. Коррозия металлов классифицируется по механизму и условиям протекания процесса и характеру коррозионного разрушения. По механизму протекания процесса различают химическую, электрохимическую и биохимическую коррозию. Химическая коррозия – взаимодействие металла и коррозионной среды, при котором окисление металла и восстановление окисленного компонента коррозионной среды (деполяризатора) протекают в одном акте. Это процесс, протекающий за счет гетерогенной химической реакции. По условиям протекания к этому виду относятся: — газовая коррозия, т.е. окисление металла в газовой среде при высокой температуре и невозможности конденсации влаги на поверхности металла; — коррозия в неэлектролитах, т.е. в жидкостях, непроводящих электри- ческий ток. Электрохимическая коррозия – взаимодействие металла с коррозионной средой (раствором электролита), при котором окисление металла и восстановление окисленного компонента коррозионной среды (деполяризатора) протекают не в одном акте. При этом виде коррозии одновременно протекают две реакции – окисления и восстановления, локализованные на определенных участках поверхности корродирующего металла. При электрохимической коррозии процесс растворения металла сопровождается появлением электрического тока, т.е. передвижением электронов по поверхности металла и ионов в растворе электролита от одного участка к другому. По условиям протекания к этому виду коррозии относятся: — атмосферная коррозия во влажной газовой или воздушной атмосфере; — коррозия в электролитах – жидкостях, проводящих электрический ток; — почвенная или подземная коррозия металлических сооружений, на- ходящихся под землей; — электрокоррозия под действием внешнего источника тока, т.е. коррозия изделий, находящихся под землей, вызванная блуждающими токами; — контактная коррозия металлов – разрушение металла в растворе электролита вследствие контакта с другим металлом, имеющим более положительный электродный потенциал, чем потенциал основного металла; — коррозия под напряжением – разрушение металла при одновременном воздействии агрессивной среды и механических напряжений. Различают коррозионное растрескивание, коррозионную усталость, коррозию при трении и коррозионную кавитацию. Биохимическая коррозия – это процесс, связанный с воздействием микроорганизмов на металл. При этом металл разрушается вследствие того, что он служи питательной средой для микроорганизмов, или под действием продуктов, образующихся в результате их жизнедеятельности. Биохимическая коррозия, как правило, протекает в растворах электролитов, поэтому параллельно может протекать и электрохимическая коррозия. Коррозия, в зависимости от природы металла, агрессивности среды и других факторов, приводит к различным видам разрушений. По характеру коррозионного разрушения различают общую, или сплошную, местную и растрескивающуюся коррозию (рисунок).  Характер коррозионных разрушений Общая, или сплошная, коррозия охватывает всю поверхность металла, находящуюся под воздействием агрессивной среды, и может быть равномерной (а), например, коррозия углеродистой стали в растворах серной кислоты, и неравномерной (б), например, коррозия этой же стали в присутствии хлор-ионов. Местная коррозия охватывает отдельные участки поверхности металла. Она подразделяется на: коррозию пятнами (в), которая занимает относительно большие участки поверхности и распространяется неглубоко; коррозию язвами (г), которая поражает металл на большую глубину и на ограниченной площади; точечную, или питтинговую (д), которая поражает металл в отдельных точках на большую глубину, в некоторых случаях насквозь; межкристаллитную коррозию (е) – коррозию по границам кристаллитов металла; распространяется на обширной поверхности металла и на большую глубину. Этот вид коррозии опасен тем, что внешний вид металлического изделия не изменяется, но при этом металл теряет прочность и пластичность. Растрескивающаяся коррозия (ж) – это коррозия металла при одновременном воздействии на металл коррозионной среды и механических напряжений, при этом скорость коррозии металла резко возрастает. Неравномерная коррозия более опасна, чем равномерная, так как вызывает в отдельных местах значительное уменьшение сечения. Приведенная классификация условна, потому что реальные формы коррозионных разрушений могут находиться между характерными типами, показанными на рисунке. 2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ 2.l Возникновение электродного потенциала Электрохимическая коррозия металлов представляет собой самопроиз- вольное разрушение металла вследствие электрохимического взаимодейст- вия его с электролитом. Это гетерогенная реакция, протекающая на поверх- ности металла. Причиной электрохимической коррозии является термодина- мическая неустойчивость металла в данных коррозионных условиях. Для понимания механизма электрохимической коррозии необходимо установить, какие процессы наблюдаются на границе металл – раствор. На границе двух соприкасающихся фаз при определенных условиях может воз- никнуть разность потенциалов или, как принято говорить, скачок потенциа- ла, например электродный потенциал – на границе металл – раствор; кон- тактный потенциал – на границе двух различных металлов; контактный по- тенциал второго рода – на границе металл – газ; диффузионный потенциал – на границе двух растворов, имеющих различную концентрацию растворен- ного вещества, и др. Скачок потенциала между двумя фазами определяется переходом заря- женных частиц из одной фазы в другую или избирательной адсорбцией за- ряженных или полярных частиц одной фазы на поверхности другой с обра- зованием двойного электрического слоя. Рассмотрим механизм возникновения электродного потенциала. Элек- тродом называется металл, погруженный в раствор электролита. Что же про- исходит на поверхности металла при погружении его в раствор собственных ионов? В металле и растворе имеются одинаковые ионы – ионы металла. В ме- талле эти ионы находятся в узлах кристаллической решетки и удерживаются в ней благодаря энергии связи ионов решетки. Чтобы вывести ион из кри- сталлической решетки, необходимо затратить работу, равную энергии связи ионов, которую также можно назвать работой выхода иона из металла. В растворе ионы металла окружены полярными молекулами воды, т. е. находятся в гидратированном состоянии. Чтобы вывести ион металла из рас- твора необходимо совершить работу, равную энергии гидратации, т. е. энер- гии связи иона металла с молекулами воды.  Рис. 2.1 Схема изменения энергии при испарении катиона металла в вакуум и при переходе в раствор: а – момент погружения металла в раствор его соли; б – момент установления равновесия Установление электродного потенциала на металле зависит от соотно- шения энергии кристаллической решетки и энергии гидратации ионов. На- ходящиеся на поверхности металла катионы имеют запас потенциальной энергии, отвечающей значению энергии в точке 1 (нижняя) на рис. 2.1. От- рыв катиона от поверхности металла с переходом в вакуум требует значи- тельной энергии (пунктирная кривая 1-1), соответствующей энергии испаре- ния Qисп. Полярные молекулы воды (или другого растворителя), ориентиру- ясь вокруг поверхностных катионов металла, облегчают переход катионов в раствор с освобождением энергии гидратации, так как уровень энергии гид- ратированного иона ниже, чем катиона в вакууме, на величину Qгидр. По- тенциальная энергия катионов, находящихся в растворе, в пределах двойного электрического слоя отвечает точке 2. Для перехода в раствор поверхностный катион металла должен преодо- леть лишь энергетический барьер Qа. Разность уровней потенциальных энер- гий в точках 1 и 2, равная А, соответствует работе процесса перехода ионов металла в раствор. Для перехода из раствора в металл гидратированный ка- тион должен преодолеть энергетический барьер Qк. При взаимодействии металла и раствора протекают два сопряженных процесса: 1. Переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс): Me + mН2O = Меn+ · mН2O + ne. 2. Переход ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (катодный процесс): Меn+ · mН2O + ne = Ме + mН2O. Независимо от энергетических соотношений в процессах, наступает динамическое равновесие между металлом и раствором его соли. 2.2 Строение двойного электрического слоя Как было показано ранее, на границе металл – раствор образуется двой- ной электрический слой. Ионы, скопившиеся у поверхности металла при ус- тановлении равновесия, не могут покинуть приэлектродный слой и удалить- ся от него вглубь раствора. Этому препятствует электростатическое притя- жение между ионами и избыточным зарядом на поверхности металла. Одна- ко двойной электрический слой может образоваться и без перехода заряжен- ных частиц из фазы в фазу. В этом случае образование двойного слоя воз- можно за счет избирательной адсорбции ионов одной фазы на поверхности другой, например специфическая адсорбция анионов хлора из водного раст- вора соли на поверхности какого-либо инертного металла. Это приводит к появлению в прикатодном слое избыточного отрицательного заряда и поло- жительного заряда в близлежащем слое раствора. Строение двойного слоя и изменение потенциала с увеличением рас- стояния от поверхности металла для растворов, не содержащих поверхност- но-активных веществ, показаны на рис.2.2,а; для растворов, содержащих по- верхностно-активные анионы — на рис.2.2,б. Двойной электрический слой подразделяется нa плотную часть δδ0, толщина которой равна среднему радиусу ионов электролита, и диффузную часть, где концентрация ионов постепенно падает, достигая концентрации, свойственной данному раствору в целом. 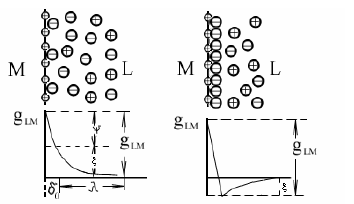 а б Рис. 2.2 Строение двойного электрического слоя: а – при отсутствии в растворе поверхностно-активных веществ; б – при их наличии В плотной части двойного слоя ионы удерживаются не только электростатическими силами, но и силами специфической адсорбции. Поэтому в растворах, содержащих поверхностно – активные ионы, их число в плотной части двойного слоя может быть не эквивалентным заряду поверхности металла, а превосходить его на некоторую величину, зависящую от свойств ионов и заряда металла. Таким образом, следует различать две модели двойного электрического слоя, одна из которых относится к растворам, не содержащим поверхностно- активных веществ (рис.2.2,а), другая — к растворам, содержащим специфи- чески адсорбирующиеся ионы (рис.2.2,б). |
