Пособие по Коррозии. Учебное пособие _Коррозия и защита оборудования от коррозии _. Учебное пособие Коррозия и защита оборудования от коррозии 2013 г. Закирова Е. В. Преподаватель спецдисциплин
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
3.4 Коррозия в расплавленных солях Расплавленные соли широко используются в промышленности при производстве электролитическим способом ряда металлов (алюминий, литий, натрий, магний и др.) в качестве нагревающих сред при термической обработке, как теплоносители в теплоэнергетике. Металлы, соприкасаясь с расплавленными солями, взаимодействуют с ними и подвергаются коррозионному разрушению. При погружении металлов в расплавленные соли, являющиеся электролитами, в результате взаимодействия между ними возникает разность электрических потенциалов (электродные потенциалы в расплавленных солях). Значения этих потенциалов зависят от природы анионов расплава и существенно отличаются от электродных потенциалов в водных растворах по величине и расположению в электрохимическом ряду напряжений. Для некоторых металлов (серебро, цинк, свинец и др.) установлено, что в расплавах своих солей они ведут себя обратимо. Коррозия металлов в расплавленных солях является электрохимической и состоит из двух сопряженных электродных процессов: - анодного (окисление металла); - катодного (ассимиляция электронов деполяризатором). При высоких температурах в расплавленных солях углеродистые стали, помимо их коррозионного растворения, подвергаются обезуглероживанию кислородом воздуха, влаги. Обычно чем агрессивнее расплав в коррозионном отношении, тем сильнее в нем идет обезуглероживание сталей. На скорость коррозии в расплавленных солях оказывают влияние вид соли, кислород и различные добавки. Пропускание через расплав соли кислорода, воздуха или водяного пара приводит к увеличению скорости коррозии, так как облегчается катодный процесс. Коррозию сталей в расплавах солей снижает добавка таких веществ, как графит, активированный уголь, бура и другие восстановители, понижающие окислительную способность расплавов. Для защиты металлов от коррозии в расплавленных солях используются следующие методы: применение менее агрессивных расплавов; снижение содержания в расплавах вредных примесей; максимальное снижение скоростей конвективных потоков; электрохимическая катодная защита. 3.5 Биохимическая коррозия Биохимическая коррозия вызывается в основном бактериями, находящимися в почве, водоемах, грунтовых водах. Биохимическая коррозия носит сезонный характер и наиболее интенсивна в весенний период, когда создаются наилучшие условия для развития и существования бактерий. Бактерии, вызывающие коррозию, подразделяются на аэробные и анаэробные. Аэробные бактерии существуют и развиваются только при условии наличия кислорода, анаэробные бактерии развиваются при отсутствии кислорода. Аэробные бактерии, способствующие коррозии, подразделяются на бактерии – окислители серы и железо-бактерии, осаждающие железо. Первые лучше всего развиваются в кислой среде (рН 0–6). Сущность их действия состоит в том, что они могут окислять серу до серной кислоты, местная концентрация которой может доходить до 10 %. Железобактерии хорошо развиваются в интервале рН 4–10. Они поглощают железо в ионном состоянии и выделяют его в виде нерастворимых соединений. Эти соединения неравномерно распределены по поверхности металла и имеют отличный от основного металла электродный потенциал. Возникающая электрохимическая гетерогенность поверхности усиливает коррозию. Анаэробные бактерии в основном бывают сульфат-восстанавливающими. Они развиваются при рН 5–9. В результате жизнедеятельности бактерии восстанавливают сульфат-ионы в сульфид-ионы. Эти бактерии активно поглощают водород, выделяющийся при катодном процессе. Присутствие в коррозионной среде сульфидов и сероводорода ускоряет коррозию. Находящиеся в растворе ионы двухвалентного железа связывают выделяющийся сероводород. На поверхности металла образуется налет сульфида железа, который облегчает протекание реакции. Коррозия имеет питтинговый характер. 4 ЛОКАЛЬНАЯ КОРРОЗИЯ Локальной коррозией называют коррозию, при которой разрушение металлов и сплавов происходит на отдельных участках, в то время как остальная часть поверхности изделия почти не разрушается. К локальной коррозии относятся межкристаллитная, точечная, контактная и щелевая. 4.1 Межкристаллитная коррозия К межкристаллитной коррозии склонны нержавеющие стали, алюминиевые и никелевые сплавы. Этот вид коррозии один из наиболее опасных видов местной коррозии, вызывающий избирательное разрушение по границам зерен, в результате происходит потеря пластичности и прочности сплава, т. е. преждевременное разрушение изделий. Причиной склонности сплавов к межкристаллитной коррозии является электрохимическая неоднородность структуры сплава, когда границы зерен или приграничные зоны являются более электрохимически отрицательными по сравнению с зерном. Наиболее обоснованной причиной возникновения межкристаллитной коррозии нержавеющих сталей следует считать обеднение хромом границ зерен вследствие выделения на них фаз, богатых хромом. Это происходит при отпуске закаленных нержавеющих сталей. При отпуске нержавеющих сталей по границам зерен выпадает карбид хрома, в результате чего содержание хрома в твердом растворе в приграничной зоне резко уменьшается. Дальнейший рост карбидов происходит вследствие диффузии углерода и хрома из твердого раствора к границам зерен. При температуре отпуска скорость диффузии углерода намного выше скорости диффузии хрома, поэтому в образовании карбидов участвует почти весь углерод твердого раствора, а хром, находящийся в твердом растворе около границ зерен. В результате этого через некоторый промежуток времени отпуска стали по границам зерен образуется обедненная хромом область, в которой содержание хрома составляет менее 12%, поэтому ее коррозионная стойкость ниже, чем зона зерна, что и определяет склонность аустенитных сталей к межкристаллитной коррозии. При достаточно большой продолжительности отпуска, по мере уменьшения концентрации углерода, скорость диффузии хрома начинает превышать скорость диффузии углерода, в результате чего содержание хрома в обедненной зоне растет и ее коррозионная стойкость увеличивается. Таким образом, при отпуске стали при определенной температуре, через некоторое время появляются обедненные хромом зоны и сталь приобретает склонность к межкристаллитной коррозии, а при достаточно большой продолжительности отпуска склонность стали к межкристаллитной коррозии снижается. Температура отпуска играет важную роль в появлении у стали склонности к межкристаллитной коррозии. При низких температурах отпуска скорости диффузии углерода и хрома малы, и поэтому время появления склонности стали к межкристаллитной коррозии велико. С повышением температуры отпуска скорость диффузии углерода из зерен к границам увеличивается, в результате чего время отпуска до появления склонности у стали к межкристаллитной коррозии уменьшается и достигает минимального значения при некоторой температуре. При дальнейшем повышении температуры отпуска скорость диффузии хрома в обедненные зоны увеличивается, что приводит к увеличению времени до появления у стали склонности к межкристаллитной коррозии. При высоких температурах отпуска происходит коагуляция карбидов хрома, что снижает скорость межкристаллитной коррозии. На склонность нержавеющих сталей к межкристаллитной коррозии большое влияние оказывает содержание в них углерода. С повышением содержания углерода в стали количество выпадающего по границам зерен карбида хрома увеличивается и склонность ее к межкристаллитной коррозии повышается. Легирование хромоникелевых аустенитных нержавеющих сталей элементами, имеющими большее сродство к углероду, чем хром, и связывающими углерод в устойчивые карбиды, резко понижает их склонность к межкристаллитной коррозии. К таким элементам относятся титан, ниобий, тантал. Разновидностью межкристаллитной коррозии является ножевая коррозия, возникающая в очень узкой зоне от нескольких сотых до десятых долей миллиметра на границе "сварной шов – основной металл". Это явление также объясняется обеднением границ зерен хромом в результате некоторых режимов нагрева, особенно при сварке. Для предотвращения ножевой коррозии рекомендуется применять низкоуглеродистые стали, оптимальный режим сварки или подвергать сварные соединения стабилизирующему отжигу. Ножевой коррозии могут быть подвержены и нержавеющие стали, содержащие титан и ниобий. Это связано с тем, что в узкой околошовной зоне, нагретой до высоких температур (около 1300°С), карбиды титана, ниобия и хрома переходят в раствор, а при быстром охлаждении, вследствие контакта с ненагретым металлом, не успевают выделиться, в результате чего углерод остается в твердом растворе, и создаются условия выпадения карбидов хрома при нагреве стали при температуре 600 − 700° С. 4.2 Точечная (питтинговая) коррозия Питтинговая коррозия - один из опасных видов локального коррозионного разрушения, характерного для условий, когда пассивное состояние поверхности металла или сплава может частично нарушаться. При этом коррозии подвергаются весьма ограниченные участки металла, а вся остальная поверхность находится в устойчивом пассивном состоянии, что приводит к появлению точечных язв или глубоких питтингов. Обычно такой коррозии подвергаются легкопассивирующиеся металлы и сплавы: хромистые и хромоникелевые стали, алюминий и его сплавы, никель, титан и др. Питтинговая коррозия возникает в растворах, содержащих окислители (например кислород) и одновременно активирующие анионы (Cl−, Br−, I−), например, в растворах хлорного железа, в морской воде, в смесях азотной и соляной кислот и др. Основное условие образования питтинга - смещение электрохимического потенциала, за счет наличия окислителей в растворе, положительнее некоторого критического значения, так называемого потенциала питтингообразования, при этом поверхность питтинга является анодом и разрушается с высокой скоростью вследствие контакта с остальной поверхностью, находящейся в пассивном состоянии и представляющей собой, благодаря относительно большой площади, почти неполяризуемый катод. При развитии питтинговой коррозии следует различать три стадии: возникновение, развитие питтинга и репассивация. Возникновение питтинга связано с нарушением пассивного состояния на отдельных участках поверхности металлов и сплавов в результате воздействия анионов активаторов. На этих участках происходит ускоренное разрушение оксидных пленок, что вызывает местное активирование. Нарушение пассивного состояния на отдельных участках приводит к увеличению скорости коррозии. Такими участками могут быть неметаллические включения (например сульфиды), границы зерен, участки с пониженной концентрацией хрома в твердом растворе, которые могут образовываться при термообработке, и др. Возникновение точечной коррозии металлов и сплавов в сильной степени зависит от природы анионов и их концентрации. Наиболее сильными анионами-активаторами являются Cl−, Br−. Такие анионы, как OH−, CrO42−, NO3−, SO42−, ClO3− затрудняют возникновение точечной коррозии нержавеющей стали в растворе хлорида натрия. На возникновение точечной коррозии оказывают влияние состав сплава, природа металла, состояние поверхности и т. д. Например, с повышением содержания никеля и хрома сопротивление сталей точечной коррозии повышается. Термическая обработка повышает склонность сталей к точечной коррозии. Так, например, отпуск нержавеющих хромоникелевых сталей вызывает склонность к межкристаллитной коррозии и понижает сопротивление стали к точечной коррозии. Рост питтинга связан с работой коррозионного гальванического элемента, в котором анодом является питтинг, а катодом - остальная поверхность металла, находящаяся в пассивном состоянии. Эффективной работе такого коррозионного элемента благоприятствует нахождение питтингов в активном состоянии, чему способствует понижение рН раствора. Скорость коррозии в питтингах различна. В большинстве из них процесс коррозии с течением времени замедляется, в части питтингов коррозия прекращается совсем, и лишь в небольшой части она развивается вглубь металла. Явление прекращения роста питтингов называется репассивацией. Для защиты от точечной коррозии используют электрохимические методы, ингибиторы и легирование металла. Так, легирование сталей хромом, кремнием, молибденом повышает их стойкость к точечной коррозии. 4.3 Контактная коррозия Контактной коррозией называется электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите. При этом возникает коррозионный гальванический элемент, работа которого влияет на скорость коррозии контактирующих металлов. Работа коррозионного элемента определяется сопротивлением анодного и катодного процессов и омическим сопротивлением. С увеличением разности между стационарными потенциалами катода и анода, уменьшением омического сопротивления и сопротивления катодного и анодного процессов контактная коррозия возрастает. Как правило, коррозия металла, имеющего более отрицательный потенциал (анод) увеличивается, а скорость коррозии металла с более положительным потенциалом (катод) снижается по сравнению со скоростью в отсутствие контакта. На контактную коррозию металлов большое влияние оказывают площади катодов и анодов, состав среды, перемешивание нейтрального раствора и др. Контактная коррозия может проявляться и в атмосферных условиях. При этом максимальная скорость коррозии наблюдается на участках, непосредственно прилегающих к месту контакта. По мере удаления от места контакта плотность тока коррозионного элемента падает и, следовательно, скорость контактной коррозии снижается. Для защиты от контактной коррозии в основном применяются следующие методы: − подбор контактируемых металлов и сплавов с минимальной разницей потенциалов; − изоляция металлов в местах контакта; − введение в закрытые системы ингибиторов, снижающих коррозию контактируемых металлов. 4.4 Щелевая коррозия Щелевой коррозией называется усиление коррозии в щелях и зазорах между металлами, прокладочными материалами и металлом, в морских условиях (между слоем микроорганизмов и обшивкой корабля). Наиболее чувствительны к щелевой коррозии пассивирующиеся металлы (нержавеющие стали, алюминиевые сплавы, титан и др.). Механизм щелевой коррозии состоит в следующем. С течением времени из-за затруднения доступа окислителя и расходования его в процессе коррозии в щели снижается концентрация окислителя и, тем самым, снижается скорость катодного процесса. Происходит уменьшение катодного тока, при этом потенциал катода смещается в отрицательную сторону, что приводит к переходу поверхности металла щели в активное состояние и скорость его растворения увеличивается. Появление в растворе продуктов коррозии и их гидролиз приводят к подкислению раствора. В зависимости от вида контроля электрохимической коррозии затруднение доступа кислорода может вызывать увеличение или уменьшение скорости коррозии металла в зазоре. Если скорость коррозии контролируется анодным процессом, то торможение доступа кислорода вызывает увеличение скорости коррозии металла в зазоре. Если же скорость коррозии контролируется катодным процессом, затруднение доступа кислорода вызывает уменьшение скорости коррозии металла в зазоре. Особенно чувствительны к щелевой коррозии металлы и сплавы, пассивное состояние которых связано с наличием в электролите растворенного кислорода и других пассиваторов. Затруднение доступа этих веществ в зазор приводит к снижению их концентрации ниже критического значения, в результате чего металл переходит из пассивного в активное состояние и происходит щелевая коррозия. Нержавеющие стали в условиях, когда в зазоре, вследствие затруднения доступа окислителя, они находятся в активном состоянии, подвергаются интенсивной щелевой коррозии. Снижение рН раствора до 3,5 - 4,0 способствует усилению щелевой коррозии. 5 ХИМИЧЕСКАЯ КОРРОЗИЯ Многие металлические конструкции подвергаются коррозионному разрушению при воздействии на них сухих газов (воздуха, продуктов горения топлива при высоких температурах и др.), а также жидких неэлектролитов (нефть, бензин, жидкая сера, бром и др.). В этом случае протекает гетерогенная химическая реакция газообразной или жидкой среды с металлом, при которой окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Это химическая коррозия. Наиболее распространенным видом химической коррозии является газовая коррозия – это коррозия металлов в газах при высоких температурах. Газовая коррозия имеет место при высокотемпературной обработке металлов (ковка, штамповка, прокатка, термообработка и др.), при эксплуатации многих металлических изделий (газовые турбины, химические аппараты, двигатели внутреннего сгорания и др.). Эксплуатируемые при высоких температурах металлические изделия должны сохранять высокие механические свойства: длительную прочность и сопротивление текучести (жаропрочность), а также сопротивляться коррозионному воздействию (жаростойкость). 5.1 Газовая коррозия При газовой коррозии происходит непосредственное взаимодействие атомов металла и кислорода с образованием пленки оксида данного металла. Молекулы кислорода, достигшие поверхности металла, адсорбируются на ней. Различают два типа адсорбции: − физическую; − химическую, или хемосорбцию. Обычно кислород хемосорбируется на поверхности металла с высоким тепловым эффектом, близким к тепловому эффекту образования оксида. Поэтому адсорбцию кислорода можно рассматривать как химическое взаимодействие, приводящее к образованию зародышей новой фазы – оксида металла. Следовательно, адсорбция кислорода является начальной стадией окисления металла. Процесс окисления протекает следующим образом. Вначале на чистой поверхности металла происходит физическая адсорбция кислорода, которая приводит к ослаблению связей между атомами в молекуле кислорода. Молекулы диссоциируют, и атомы кислорода оттягивают электроны от атомов металла. Наступает стадия химической адсорбции, когда смещение электронов к кислороду с образованием О2− равносильно образованию зародышей оксида. Таким образом, при взаимодействии кислорода с металлом образуется оксидная пленка. Образование оксида может происходить на поверхности металла, на поверхности или внутри оксидной пленки. При этом поверхность металла является анодом и на ней протекает реакция ионизации атомов металла. Положительные ионы металла и освободившиеся электроны перемещаются в пленке раздельно (рис. 5.1). 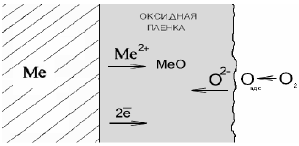 Рис. 5.1 Схема процесса химического окисления металла Электроны перемещаются со значительно большей скоростью, диффузия ионов металла протекает по дефектным местам кристаллической решетки или по ее междоузлиям. На скорость перемещения электронов и ионов оказывают влияние удельная электропроводность оксидной пленки и размеры ионов металла, атомов и ионов кислорода. Адсорбировавшиеся из газовой фазы молекулы кислорода диссоциируют на внешней поверхности оксида. Атомы кислорода диффундируют внутрь оксидной пленки, где, принимая электроны, превращаются в ионы О2− . Ионы кислорода продолжают диффундировать вглубь навстречу ионам металла. Таким образом, внешняя поверхность пленки, на которой кислород принимает электроны, является катодом. Следовательно, встречная диффузия ионов металла и кислорода протекает в электрическом поле. В одних случаях пленки могут расти до заметных толщин, в других они будут чрезвычайно тонкими, порядка нескольких молекулярных слоев. Скорость газовой коррозии в значительной степени меняется в зависимости от внутренних и внешних факторов. К внутренним факторам относятся природа металла, состав сплава, его структура, обработка поверхности, наличие напряжений. Состав сплава влияет на скорость газовой коррозии сталей. Значительное повышение устойчивости к газовой коррозии происходит при легировании сталей хромом, алюминием, кремнием, что связано с образованием на поверхности оксидных пленок с высокими защитными свойствами. Высокой жаростойкостью обладают сплавы никеля с хромом – нихромы, содержащие 80% никеля и 20% хрома. Углерод не вызывает заметных изменений в скорости коррозии. Структура сплава в незначительной степени влияет на скорость газовой коррозии. Так, например, хромоникелевая сталь 12Х18Н9Т имеет более высокую жаростойкость, чем сталь Х18Н5Т с более высоким содержанием хрома. Это связано с тем, что на сталях Х18Н5Т образуются менее совершенные пленки, чем на 12Х18Н9Т. Характер обработки поверхности металла влияет на скорость газовой коррозии лишь в начальной стадии окисления: гладкие поверхности имеют несколько меньшую скорость газовой коррозии. К внешним факторам относятся температура, состав газовой среды, скорость движения газа, условия нагревания и т.д. С повышением температуры скорость окисления металлов значительно возрастает. Металлы при высоких температурах могут взаимодействовать с кислородом, парами воды, оксидом углерода (IV), оксидом серы (IV). Защитные свойства образующихся пленок различны, что влияет на скорость окисления металлов в указанных средах. Значительное увеличение скорости окисления металлов наблюдается при повышении концентрации кислорода в атмосфере инертных газов, содержащих небольшие примеси кислорода. Скорость движения газа заметно влияет на скорость коррозии в начальной стадии окисления. Однако при очень больших скоростях движения газовой среды возникает опасность эрозионного разрушения оксидных пленок, что может сильно увеличить скорость коррозии. Наличие резких колебаний температуры в процессе нагревания может привести к разрушению защитных оксидных пленок. Коэффициент термического расширения оксида, как правило, значительно ниже, чем для чистого металла. Вследствие этого резкие колебания температуры способствуют возникновению добавочных внутренних напряжений и механическому разрушению оксидной защитной пленки. |
