1.5_Гонноченко. Решение При растворении Agscnв раствор переходят ионы Ag и scn в соответствии с уравнением Agscn Ag scn
 Скачать 37.73 Kb. Скачать 37.73 Kb.
|
|
Раздел 1.Общие теоретические основы аналитической химии Индивидуальное задание №1.Гетерогенные равновесия в системе «осадок-раствор» 5. Вычислите растворимость в воде в единицах моль/л и г/л: AgSCN и Ag2CO3. Решение: При растворении AgSCNв раствор переходят ионы Ag+ и SCN−в соответствии с уравнением AgSCN = Ag++SCN- 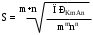 Если S1 моль AgSCN перешло в раствор, то [Ag+] = [SCN-] = S1. Для AgSCN (m =1, n=1) растворимость будет равна: ПР(АgSCN) = [Ag+] [SCN-] = c12  6,5 ∙ 10−5моль/л. 6,5 ∙ 10−5моль/л. S(г/л) = S (моль/л) ∙ М (AgSCN) = 6,5 ∙ 10−5 моль/л · 165,95 г/моль = 0,01078 г/л. Поскольку при растворении из одного моля AgSCN образуется 1 моль ионов Ag+ и 1 моль SCN−, то [Ag+] = S = 6,5 ∙ 10−5 моль/л; [SCN−] = S = 6,5 ∙ 10−5моль/л или [Ag+] = S = 0,01078 = 0,28032 г/л; [SCN−] = S = 0,01078г/л. 2. Ag2CO3→ 2Ag+ + CO32- Растворимость рассчитывается в соответствии с формулой (1): 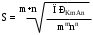 Для Ag2CO3 (m =2, n=1) растворимость будет равна: S = 2+1√ ПРAg2CO3/22 ∙ 11 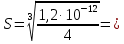 6,69 ∙ 10−5моль/л. 6,69 ∙ 10−5моль/л. S(г/л) = S (моль/л) ∙ М (Ag2CO3) = 6,69 ∙ 10−5 моль/л · 275,74 г/моль = 0,01844 г/л. Поскольку при растворении из одного моля Ag2CO3 образуется 2 моля ионов Ag+ и 1 моль CO32−, то [Ag+] = 2S = 2· 6,69 ∙ 10−5 = 13,38·10−5моль/л; [CO32−] = S = 6,69 ∙ 10−5моль/л или [Ag+] = 2S = 2·0,01844 = 0,03688г/л; [CO32−] = S = 0,01844г/л. 7. Образуется ли осадок Mg(OH)2, если к 5 мл 0,005М раствора MgCl2добавить 5 мл 0,001М раствора NaOH? Решение: За счет увеличения объёма при сливании растворов вдвое следует учитывать уменьшение начальных концентраций также вдвое, т.е. концентрация раствора MgCl2 станет равной 0,005М:2 – 0,0025М/л, а концентрация NH4 OH - равной 0,001М:2 – 0,0005 М/л. Уравнения записываются в следующем виде: Mg+2 + 2OH- Mg(OH)2 ПР(Mg(OH)2)=[ Mg+2] •[OH-]2 . Для ответа на вопрос, выпадает ли в осадок Mg(OH)2 , нужно знать концентрацию ионов Mg+2 и OH- . Концентрацию ионов магния и ионов OH- принимаем равной 0,0025 моль/л и 0,0005 моль/л соответственно, учитывая, что хлорид магния и гидроксид натрия являются сильными электролитами и диссоциируют полностью. 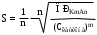 Используя значения концентраций [ Mg+2] =0,0025 моль/л и [ OH-]= 5•10-4моль/л для вычисления произведения начальных концентраций по выражению для ПР, получим: [Mg+2] •[OH-]2 =0,0025•(5•10-4)2 = 6,25•10-10 . Полученную величину сравниваем с табличным значением ПР(Mg(OH)2)= 5,2•10-12 . Очевидно, что рассчитанное произведение концентраций превышает табличное значение ПР(Mg(OH)2), следовательно, раствор пересыщен, и осадок должен выпадать. 8. При какой концентрации PO43−-ионов начнется выпадение осадка Ag3PO4 из раствора, содержащего 0,1М AgNO3? Решение: Произведение растворимости Ag3PO4 равно 1,3 ∙ 10-20 г/л-1. Рассчитаем концентрацию ионов, катионов и анионов, в растворе AgNO3Растворимость нитрата серебра рассчитываем с учетом произведения растворимости AgNO3⇔ Ag + + NO3− ПР = [Ag+][NO3-] = s ∙ s ПР = 1,3 ∙ 10-20 S = (ПР)0,1 = (1,3 ∙ 10-20)0,1 = 1,027 ∙ 10-10моль/л 1,027 ∙ 10-10∙ 143,5 = 1,47 ∙ 10-8 г/л При концентрации PO43−-ионов свыше 1,47 ∙ 10-8 г/л начнется выпадение осадка Ag3PO4 из раствора, содержащего 0,1М AgNO3 9. Вычислите и сравните растворимость (моль/л) AgCl в воде и в 0,05М AgNO3. Решение: Растворимость хлорида серебра в воде рассчитываем с учетом произведения растворимости  AgCl⇔ Ag + + Cl− ПР = [Ag+][Cl-] = s ∙ s ПР = 1,11 ∙ 10-10 S = (ПР)0,05 = (1,11 ∙ 10-10)0,05 = 1,005 ∙ 10-5моль/л 1,005 ∙ 10-5 ∙ 143,5 = 1,4 ∙ 10-3 г/л Нитрат серебра содержит одноименный с осадком катион, поэтому растворимость хлорида серебра в растворе нитрата серебра рассчитываем согласно произведению растворимости s = (1,11 ∙ 10-10)/(1,005 ∙ 10-5 + 0,00001) = 1,08 ∙ 10-7 моль/л 1,08 ∙ 10-7 ∙ 143,5 = 1,56 ∙ 10-5 г/л Растворимость хлорида серебра в растворе 0,05 М нитрата серебра меньше его растворимости в чистой воде в 15000 раз. 1,4 ∙ 10-3/1,56 ∙ 10-5 = 90 раз 10. Вычислите и сравните растворимость (моль/л) Mg(OH)2 в воде и в 0,05М KCl. Решение: Растворимость кальция гидроксида в чистой воде составляет Mg(OH)2 = Mg2+ + 2OH- ПР (Mg(OH)2)=[Mg2+][OH-]2 = s ∙ (2s)2 = 4s3 = 7,1 ∙ 10-12 растворимость в воде S = 1,2 ∙ 10-4 моль/л В присутствии сильного электролита нужно учитывать ионную силу. Т. к. ионы К+ и Cl-в растворе будут преобладать, то ионную силу можно считать, учитывая только их концентрации I=1/2(0,05 ∙ 12+0,05 ∙ 12)=0,05 В таблице коэффициентов активности находим, что при 0,01 γ=0,8103 ПР=[Mg2+][OH-]2 ∙ γ(Mg2+) ∙ γ(OH-]2=7,1 ∙ 10-12 Тогда растворимость кальция гидроксида в 0,05 М растворе калия хлорида равна: S =1,5 ∙ 10-4 моль/л Растворимость кальция гидроксида в растворе 0,05 М хлорида калиябольше его растворимости в чистой воде в 1,25 раз. 1,5 ∙ 10-4/1,2 ∙ 10-4 = 1,25 раз |
