II. Практическая часть Цель работы
 Скачать 21.39 Kb. Скачать 21.39 Kb.
|
|
II. Практическая часть Цель работы: научиться вычислять различные виды концентраций, а также изготавливать растворы различных концентраций. Приборы и реактивы: мерный цилиндр на 50 мл, химический стакан на 100 мл; мерная колба на 50 мл; пипетка на 25 мл; ареометр; стеклянная палочка; сульфат натрия безводный кристаллический; сульфат алюминия кристаллогидрат Аl2(SO4)3·18Н2O. Опыт № 1 : «Приготовление 10%-го раствора сульфата натрия» 1)Рассчитать навеску, необходимую для приготовления 50 г 10%-го раствора сульфата натрия, и объем воды, который потребуется для этого. 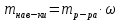 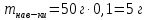 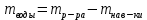 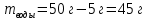 С учетом того, что плотность воды равняется 1г/мл, то объем воды численно приравнивается к ее массе. Из этого следует, что объем воды равен 45 мл. 2)Приготовить раствор: взять навеску данной соли на технических весах; перенести ее в химический стакан и добавить необходимый объем воды; перемешивать раствор до полного растворения соли. 3) Полученный раствор перенести в мерный цилиндр и измерить ареометром плотность. 4) По показаниям ареометра определить точную концентрацию раствора, используя таблицу. Результат занести в отчет: 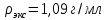 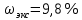 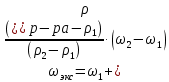 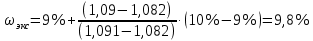 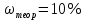 5) Вычислить молярную концентрацию раствора: 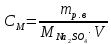 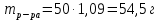 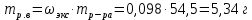 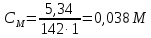 6) Определить относительную ошибку опыта 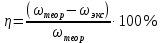  Опыт №3 : «Приготовление 1,5 н. раствора сульфата алюминия из кристаллогидрата» 1) Рассчитать, сколько граммов кристаллической соли Аl2(SO4)3×∙18Н2O требуется для приготовления 50 мл 1,5 н. раствора сульфата алюминия в расчете на безводную соль. 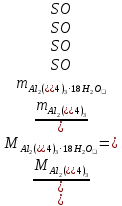 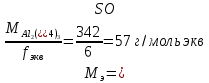 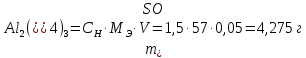  2) Взвесить расчетное количество кристаллогидрата на технических весах; с помощью микро-воронки перенести навеску сульфата алюминия в мерную колбу на 50 мл, смывая кристаллы соли дистиллированной водой; налить колбу до половины и, перемешивая раствор, добиться полного растворения соли; довести водой уровень раствора до метки, последние капли добавлять при помощи пипетки. 3) Полученный раствор перенесем в мерный цилиндр и измерим ареометром плотность 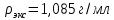 4) Найти точную концентрацию полученного раствора 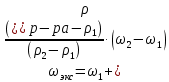 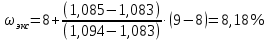 5) Пересчитать массовую долю на нормальную концентрацию. Это будет практическое значение нормальности раствора 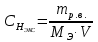 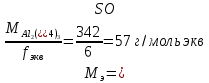 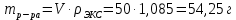 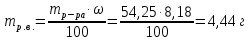 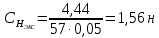 6) Найти относительную ошибку опыта, считая теоретическое значение нормальной концентрации раствора равным 1,5 н. 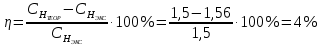 Вывод: в ходе данной лабораторной работы были получены растворы различный концентраций, вычислены молярная и нормальная концентрации экспериментальных растворов; погрешность обусловлена визуальными измерениями и погрешностью при измерениях. |
