Пособие по Коррозии. Учебное пособие _Коррозия и защита оборудования от коррозии _. Учебное пособие Коррозия и защита оборудования от коррозии 2013 г. Закирова Е. В. Преподаватель спецдисциплин
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
2.3 Термодинамика коррозионных электрохимических процессов Основной причиной коррозии металлов является их термодинамическая неустойчивость. Стремление металлов переходить из металлического со- стояния в ионное (т. е. растворяться) для разных металлов неодинаково и наиболее точно может быть охарактеризовано изменением свободной энер- гии при протекании соответствующей реакции окисления в данной среде. Известно, что при самопроизвольном процессе свободная энергия может только убывать. Следовательно, если в данных условиях при переходе из ме- таллического состояния в ионное наблюдается уменьшение свободной энер- гии, то коррозионный процесс может протекать самопроизвольно. И наобо- рот, увеличение свободной энергии в процессе ионизации металла свидетельствует о невозможности протекания данного процесса самопроизвольно (табл. 2.1). Таблица 2.1 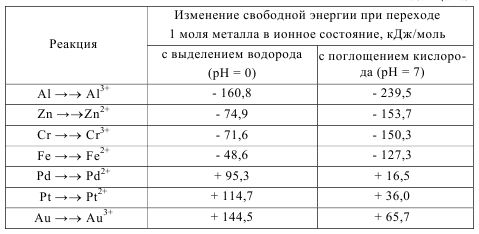 Как видно из табл. 2.1, палладий, платина, золото являются термодина- мически устойчивыми металлами. Остальные металлы в большей или мень- шей степени имеют тенденцию переходить в окисленное состояние. Термодинамически устойчивые металлы в природе, как правило, нахо- дятся в самородном состоянии. Это – благородные металлы. Все технически важные металлы – неблагородные. В природе они встречаются в виде руд и солей, т. е. в окисленном состоянии. Термодинамическая устойчивость ме- таллов дает приближенную оценку коррозионной стойкости металлов. При электрохимической коррозии изменение свободной энергии можно выразить следующим образом: ΔG = – EnF, где ΔG – изменение свободной энергии, кДж/моль; Е – ЭДС гальванической системы, В; п – степень окисления металла; F – число Фарадея. Электрохи- мическая коррозия возможна, если ΔG < 0, т. е. изменение свободной энер- гии имеет отрицательное значение, следовательно, если электродный потен- циал металла имеет более отрицательное значение по сравнению с потенциа- лом деполяризатора. Для электрохимического растворения металла необходимо присутствие в электролите окислителя – деполяризатора. Термодинамические данные определяют только возможность протекания коррозионного процесса, но не реальную скорость коррозии. 2.4 Коррозионные гальванические элементы и электродные реакции Электрохимической коррозией называется самопроизвольное разрушение металла под действием электрического тока, возникающего вследствие работы короткозамкнутых гальванических элементов на поверхности металла при ее электрохимической неоднородности. 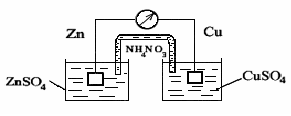 Рис. 2.3 Схема гальванического элемента Рассмотрим работу обыкновенного гальванического элемента, состав- ленного из цинкового и медного электродов, погруженных в растворы со- лей их ионов с активностью 1г-ион/л (рис. 2.3): Zn⎪ZnSO4⎪⎪CuSO4⎪Cu. До замыкания электродов на цинке и меди устанавливаются равновес- ные потенциалы: Zn – 2е =↔ Zn2+, Е0 = – 0,76 В; Сu – 2е =↔ Cu2+, Е0 = + 0,337 В; При замыкании электродов за счет разности потенциалов в цепи потечет ток. Цинк, как более активный металл, будет растворяться (Zn – 2е ↔→ Zn2+) и посылать электроны во внешнюю цепь. На меди будет происходить процесс присоединения этих электронов катионами меди из раствора (Сu2+ + 2е →↔ Cu). Эффективность такого гальванического элемента определяется разностью потенциалов электродов. Электрод (в данном случае цинковый), имеющий более отрицательный потенциал, называется анодом. Анодный процесс – это процесс окисления. Электрод (в данном случае медный), имеющий более положительный потенциал, называется катодом. Катодный процесс – это процесс восстановления. Таким образом, причиной появления тока в гальваническом элементе является разность потенциалов металлов. На поверхности любого металла, находящегося в электролите, также возникают короткозамкнутые гальванические элементы, для работы кото- рых, очевидно, требуется разделение поверхности на катодные и анодные участки, характеризующиеся различными значениями потенциалов. В связи с этим принято говорить об электрохимической гетерогенности, т. е. неоднородности поверхности. Причины возникновения электрохимической неоднородности могут быть различными: — неоднородность металлической фазы – наличие макро- или микровключений, различная концентрация твердого раствора, неодинаковая степень обработки поверхности металла и т. д.; — неоднородность защитных пленок на поверхности металла – наличие несплошных окисных пленок, пористость защитных пленок, неравномерное распределение на поверхности продуктов коррозии (соли и гидроксиды); — неоднородность внутренних напряжений в металле; — неоднородность жидкой фазы – различие в концентрациях собствен- ных ионов металла в электролите, различных солей, ионов водорода, кисло- рода и других окислителей; — неоднородность физических условий – различие температур на участках поверхности металла, неравномерное распределение внешнего электрического поля, неодинаковая освещенность поверхности металла и др. При работе коррозионного гальванического элемента одновременно протекают анодный и катодный процессы. В табл. 2.2 приведены некоторые катодные реакции и их стандартные окислительно-восстановительные потенциалы. Таблица 2.2 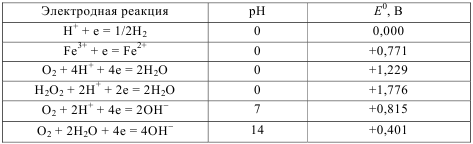 Наибольшее значение в большинстве случаев электрохимической кор- розии металлов имеют следующие катодные реакции: кислородная деполяризация О2 + 2Н2О + 4е = 4ОН−; водородная деполяризация H+ + e = 1/2 H2. В реальных условиях, вследствие гетерогенности поверхности металла, короткозамкнутые двухэлектродные гальванические элементы встречаются крайне редко. Поверхность корродирующего металла представляет собой многоэлектродный, т. е. состоящий из нескольких, отличающихся друг от друга по потенциалам электродов, гальванический элемент. Если в двухэлектродном элементе распределение катодных и анодных участков вполне определенное, то в многоэлектродном элементе это распределение зависит от многих факторов. Электрод с наиболее отрицательным потенциалом будет анодом, а с наиболее положительным – катодом. Тип электродов с промежуточными потенциалами зависит от значения электродных потенциалов с крайними значениями, площади электродов, их поляризуемости и от сопротивления проводников, соединяющих электроды. Например, в трехэлектродном элементе Zn|раствор|Fe⎪раствор|Сu цинковый электрод является анодом, медный – катодом. Тип железного электрода зависит от его положения. Если железный электрод находится вблизи анода, то он является катодом, если ближе к катоду – анодом. Если один электрод (например катод) имеет сравнительно большую поверхность 29по сравнению с другими электродами, т. е. в процессе работы он мало поляризуется, то остальные электроды, как правило, превращаются в электроды противоположного знака (аноды). 2.5 Механизм растворения металлов Первопричиной растворения металлов является их термодинамическая неустойчивость. Самопроизвольный переход металлов в окисленное состоя-ние при взаимодействии с электролитами может протекать по химическому и электрохимическому механизму. Растворение металла по химическому механизму происходит в одну стадию на одном и том же участке поверхности металла независимо от по- тенциала без участия свободных электронов, т.е. металл вступает с окисли- телем в химическое взаимодействие, например, растворение железа, хрома и его сплавов в 0,1Н серной кислоте: Fe + 2H2O → Fe2+ + 2 OH- + H2↑ 2Cr + 6H2O → 2Cr3+ +6OH- +3H2↑ или растворение алюминия в 50%-ной уксусной кислоте: 4Al + 3 O2 + 12H+ → 4Al3+ + 6H2O. Растворение металла по электрохимическому механизму протекает с участием свободных электронов. При этом процессы ионизации атомов ме- талла и восстановление окислительного компонента коррозионной среды протекают на разных участках поверхности металла. Скорости этих процес- сов зависит от величин электродных потенциалов участков металла. Этот ме- ханизм растворения имеет место в большинстве случаев коррозии металлов в электролитах. Разделение процесса растворения металла в электролите на два сопря- женных процесса – анодный и катодный – облегчает его протекание в срав- нении с химическим взаимодействием. По электрохимическому механизму растворения металла окислитель является только деполяризатором, который отнимает валентные электроны металла, но не вступает с ним в химическое взаимодействие. Вторичные процессы образования продуктов коррозии мо- гут иметь место, но они необязательны. Термодинамические данные не позволяют оценить реальную скорость электрохимической коррозии, которая определяется конкретными условиями протекания процесса. Поэтому необходимо рассмотреть кинетику этого про- цесса, состоящего из двух сопряженно протекающих реакций – анодной и катодной. Обе реакции связаны тем, что количество электронов, освободив- шихся при ионизации металла, должно быть одинаковым с количеством электронов, взаимодействующих с деполяризатором. Рассмотрим вначале механизм растворения чистых металлов. Реакцию растворения металла в чистом виде можно записать: Me →→ Men+ + ne. При этом фактическое конечное состояние катиона в растворе может быть самым разнообразным. Это могут быть гидратированные катионы, а также возможно возникновение связей между катионами и анионами, при- сутствующими в растворе. Стадия переноса заряда заключается в переходе атомов металла, адсорбированных на самой металлической поверхности и обладающих большей подвижностью по сравнению с атомами кристалличе- ской решетки, в катионы в непосредственной близости от поверхности. Поверхность реальных поликристаллических твердых металлов состоит из поверхностей отдельных кристаллитов и пронизана узкими переходными участками, где кристаллическая структура сильно нарушена границами зе- рен. Кроме того, в металле всегда присутствуют примеси. Местами с относи- тельно повышенной вероятностью перехода атомов металла из решетки на поверхность могут служить дефекты поверхности металла, образующиеся в результате механической обработки, и другие повреждения. Поэтому в це- лом топография распределения активных участков поверхности твердого ме- талла, подвергающихся растворению с наибольшей скоростью, сложна. Обычно наиболее легкий переход осуществляется с тех мест, где имеются дефекты структуры, “уступы”, на которых ослаблена связь некоторых ато- мов с соседними атомами по кристаллической решетке. Считается, что таких активных мест 108–1012 на каждом сантиметре поверхности, что составляет от 10−7 до 10−3 от общего количества поверхностных атомов. 2.6 Пассивность металлов В ряде случаев происходит резкое снижение скорости растворения металла. Скорость коррозии многих металлов резко уменьшается при введении в состав раствора сильных окислителей. Металл переходит в пассивное состояние. Пассивность металла – это состояние относительно высокой коррозионной стойкости, вызванное торможением анодного процесса электрохимической коррозии. Для ряда металлов становится возможным не растворение металла в виде катионов, а образование на поверхности защитных оксидных пленок. Металлы становятся пассивными. При возникновении пассивного состояния анодный процесс растворения металла тормозится образовавшейся оксидной пленкой. Образование оксидной пленки на поверхности металла резко увеличивает общее сопротивление цепи, вследствие чего уменьшается коррозионный ток. Явлениями пассивности объясняется малая скорость коррозии нержавеющих сталей, алюминия, титана и других металлов и сплавов в определенных условиях. По степени уменьшения способности пассивироваться в нейтральных средах металлы могут быть расположены в следующий ряд: Ti Al Cr Mo Ni Co Fe Mn Zn Cd Sn Pb Cu Этот ряд характеризует не общую коррозионную устойчивость, а только степень повышения коррозионной стойкости, определяемой возникновением пассивного состояния. Существует гипотеза пленочно-адсорбционной природы пассивности нержавеющих сталей, согласно которой на поверхности нержавеющих сталей имеется тонкая и плотная защитная пленка. Но под пленкой и в порах находятся атомы или ионы кислорода или другие окислители, хемосорбированные металлами, поэтому поверхность приобретает потенциал, близкий к окислительно-восстановительному потенциалу коррозионой среды, а активные участки пленки (поры) становятся анодами. Кислород или комплексы окислителя внедряются в металл на анодных участках и служат переходным слоем от металла к защитной пленке, улучшая их сцепление и переводя металл в пассивное состояние. Перевод металла в пассивное состояние можно осуществить с помощью окислителей. Переход металла в пассивное состояние под действием окислителя связан со значением потенциала, который металл приобретает в данной среде. При изменении внешних условий пассивный металл может вновь перейти в активное состояние. Этот процесс называют активацией или депассивацией. Вещества или процессы, нарушающие пассивное состояние металлов или затрудняющие наступление пассивности, называют активаторами или депассиваторами. Активаторами являются: - восстановители (Na2SO3, Na2S2O3, Н2 и др.); - восстановление поверхности металла постоянным электрическим током от внешнего источника тока; - некоторые ионы (С1-, Br-, S2-, SO42- и др.); - повышение температуры; - механическое нарушение пассивной пленки. 2.7 ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА СКОРОСТЬ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ Скорость и характер процесса электрохимической коррозии определяются внутренними, внешними, механическими и конструктивными факторами. Внутренние факторы электрохимической коррозии связаны с природой металла, его структурой, составом, состоянием поверхности, напряжениями в металле и др. Внешние факторы коррозии определяются условиями протекания коррозионного процесса, такими, как характер среды, скорость ее движения, температура раствора и др. Механические факторы – это коррозионное растрескивание, коррозионная усталость, коррозионная кавитация. Конструктивные факторы определяются конструктивными особенностями химических машин и аппаратов. Внутренние факторы коррозии К внутренним факторам относятся следующие характеристики металла: термодинамическая устойчивость, положение в периодической системе Менделеева, структура и тип сплава, наличие примесей, внутренние напряжения и др. Термодинамическую устойчивость металла можно приближенно оценивать по величине стандартных электродных потенциалов. Сдвиг потенциала в сторону более положительных значений можно рассматривать как повышение термодинамической устойчивости металла. Однако теоретическая возможность протекания данного коррозионного процесса говорит не о реальной скорости коррозии. В качестве примера рассмотрим следующий. Стандартные значения потенциалов алюминия и железа соответственно равны – 1,67 В и – 0,44 В, т. е. с термодинамической точки зрения алюминий более склонен к коррозии. Однако алюминий устойчив, а железо нестойко в разбавленной серной кислоте, что связано с образованием пассивной пленки на алюминии. Положение металла в периодической системе однозначно не характеризует его коррозионную стойкость, тем не менее в отношении коррозионного поведения наблюдаются достаточно определенные закономерности. Наиболее коррозионно-неустойчивые металлы находятся в главных подгруппах I и II групп. Это щелочные и щелочноземельные металлы. В по- бочных подгруппах I и II групп коррозионная стойкость растет по мере возрастания атомного номера (Cu – Ag – Au, Zn – Cd – Hg). В побочных подгруппах IV и VI групп и в VIII группе находятся легко пассивирующиеся металлы, причем с ростом атомного номера склонность к пассивации в первом приближении падает (Ti – Zr – Hf, Cr – Mo – W). Наиболее коррозионностойкие металлы находятся в восьмом ряду группы VIII (Os, Ir, Pt), а также Au в побочной подгруппе I группы. Структура металла оказывает различное влияние на скорость коррозии. Так, укрупнение зерна не приводит к увеличению общей коррозии, но способствует развитию межкристаллитной. Металлические сплавы по структуре можно разделить на две группы: - гетерогенные (двухфазные, с включением избыточных фаз, компози- ционные); - гомогенные (твердые растворы, интерметаллиды, аморфные сплавы). Структура сплава в значительной мере определяет характер протекания коррозионного процесса. Коррозионное разрушение сплава типа «механическая смесь» будет определяться как атомным (массовым) соотношением, так и взаимным расположением фаз, выполняющих роль катода и анода. Если фазы распределены равномерно и доля анодной составляющей невелика, то коррозия будет сплошной, равномерной. При неравномерном распределении анодной фазы коррозия будет локальной, очаги коррозии при этом будут распространяться вглубь. При электрохимической коррозии гетерогенного двухфазного сплава наблюдается чаще всего структурно-избирательная коррозия, при которой происходит преимущественное растворение электрохимически более отрицательной фазы или менее пассивирующейся и накопление на поверхности более устойчивой в коррозионном отношении, фазы. 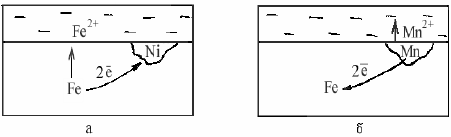 Рис. 2.4 Схемы коррозионных элементов Рассмотрим два примера: в одном случае в железе находится примесь с более положительным электродным потенциалом (рис. 2.4,а), в другом – с более отрицательным электродным потенциалом (рис. 2.4,б). В первом случае железо является более активным, и в коррозионном элементе будет играть роль анода, а никель с более положительным потенциалом будет катодом: (−) Fe → Fe2+ + 2e; (+) 2H2O + O2 + 4e →→ 4OH− (нейтр. среда). Во втором случае железо с более положительным электродным потенциалом будет играть роль катода, а марганец с более отрицательным электродным потенциалом – анода: (−) Mn →→ Mn2+ + 2e; (+) 2H2O + O2 + 4e →→ 4OH− (нейтр. среда). Таким образом, примеси с более положительным электродным потенциалом, чем потенциал основы, будут ускорять электрохимическую коррозию, а примеси с более отрицательным электродным потенциалом - замедлять. В гомогенном сплаве типа «твердый раствор» атомы различных компонентов сплава не теряют полностью своей индивидуальности. Атомы металла, более коррозионностойкого в данных условиях, остаются таковыми и в сплаве, и активность атомов сплава по отношению к коррозионному раствору не выравнивается. Это объясняется тем, что при образовании сплава типа «твердый раствор» термодинамическая активность атомов сплава незначительно отличается от термодинамической активности атомов в чистом металле. Поверхность сплава типа «твердый раствор» не является гомогенной. В этом случае в начальной стадии коррозии наблюдается компонентно-избирательная коррозия. Поверхность постепенно обогащается более электроположительными включениями. Причем обогащение поверхности твердого раствора атомами более устойчивого в данных условиях компонента происходит независимо от того, вызвана ли эта устойчивость их термодинамической стабильностью или большей склонностью к переходу в пассивное состояние. Например, поверхность сплава цинк – никель (18 % никеля) в процессе хранения в коррозионной среде постепенно обогащается атомами никеля. Также существует энергетическая неоднородность атомов в различных точках кристаллической решетки. Наибольшей энергией обладают атомы, находящиеся на углах грани и связанные только с тремя соседними атомами, которые и будут служить центром активного растворения атомов сплава. Тщательность обработки поверхности, шлифовка, полировка повышают устойчивость против коррозии. Это объясняется образованием на гладкой поверхности более совершенных, плотных пассивирующихся оксидных пленок. В условиях атмосферной коррозии большая устойчивость полированных поверхностей металла в значительной степени определяется тем, что на таких поверхностях менее вероятна конденсация влаги по сравнению с шероховатыми. |
