Пособие по Коррозии. Учебное пособие _Коррозия и защита оборудования от коррозии _. Учебное пособие Коррозия и защита оборудования от коррозии 2013 г. Закирова Е. В. Преподаватель спецдисциплин
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Коррозия металлов при кавитационном воздействии Коррозионной кавитацией называют разрушение металла в результате механического переменного воздействия агрессивной среды на металл. При определенных гидродинамических условиях нарушается сплошность движущегося потока жидкости и образуются вакуумные пузыри. Затем пузыри сокращаются и исчезают. Такое явление в жидкости называется кавитацией. При быстром заполнении жидкостью образовавшихся пузырей поверхность металла подвергается гидравлическим ударам, которые создают пульсирующие напряжения и разрушают металл. Этот вид коррозии приводит к образованию местных глубоких язв на перемешивающих устройствах в химических аппаратах и т.д. 3. КОРРОЗИЯ МЕТАЛЛОВ В РАЗЛИЧНЫХ УСЛОВИЯХ В зависимости от условий, в которых эксплуатируются изделия, элек- трохимическая коррозия подразделяется на атмосферную, подземную, мор- скую и коррозию в расплавленных солях. 3.1 Атмосферная коррозия Атмосферной коррозией называют разрушение металлов и сплавов во влажном воздухе при обычной температуре. Это самый распространенный вид коррозии. Примерно 80% металлических конструкций эксплуатируется в атмосферных условиях. Атмосферная коррозия металлов носит, в основном, электрохимический характер и протекает в тонких слоях влаги, сконденсировавшейся на поверхности металла. Основными факторами, определяющими скорость коррозии в атмосфере, являются степень увлажненности поверхности корродирующих металлов, наличие загрязнений и температура. Эти факторы изменяются в широких пределах, например, в морской атмосфере очень много солей, особенно хлорида натрия, в атмосфере промышленных районов много оксидов серы, углерода, азота и др. По степени увлажненности поверхности металла различают следующие типы атмосферной коррозии: сухая, влажная и мокрая. Сухая атмосферная коррозия – это коррозия при полном отсутствии пленки влаги на поверхности металла. Механизм сухой коррозии металлов представляет собой чисто химический процесс взаимодействия агрессивных газов с окисленной поверхностью. В сухом воздухе на поверхности металла образуются оксидные пленки, которые снижают дальнейшее окисление металла. Если в воздухе имеются другие газы, например сернистые соединения, защитные свойства пленки могут снизиться и скорость коррозии в связи с этим возрастет. Влажная атмосферная коррозия протекает при наличии на поверхности металла тончайшей невидимой пленки влаги, которая образуется в результате конденсации при относительной влажности воздуха ниже 100%. Конденсация влаги в такой атмосфере может быть различной: — Капиллярная. Капилляры, щели, зазоры способствуют конденсации влаги, так как в них имеется небольшая вогнутость мениска жидкости, следовательно, давление насыщенных паров наименьшее. С уменьшением радиуса кривизны вогнутого мениска снижается давление насыщенных водяных паров над ним. Таким образом, наличие капилляров со смачивающимися стенками приводит к конденсации водяного пара, ненасыщенного по отношению к плоскому мениску жидкости. — Адсорбционная. Конденсация протекает за счет адсорбции влаги на поверхности металла. — Химическая. Конденсация влаги происходит вследствие химического взаимодействия продуктов коррозии или соли, находящихся на поверхности металла, с водой и сопровождается образованием гидратированных соединений. Наличие пленки раствора соли способствует конденсации влаги, так как давление пара над раствором ниже, чем над чистым растворителем. Гигроскопичность соли также ускоряет конденсацию влаги. Механизм коррозии металлов во влажной атмосфере преимущественно электрохимический. На работу коррозионного микрогальванического элемента оказывает существенное влияние сопротивление пленки влаги на поверхности металла. Мокрая атмосферная коррозия – коррозия металлов при наличии на их поверхности видимой пленки влаги, протекающая при относительной влажности около 100%. Такая атмосферная коррозия наблюдается при капельной конденсации влаги на поверхности металла, а также при непосредственном попадании влаги на металл (дождь, обливание конструкций водой и т. д.). Мокрая атмосферная коррозия близка к электрохимической коррозии при полном погружении металла в электролит. На скорость атмосферной коррозии оказывает существенное влияние степень увлажненности поверхности, т. е. толщина слоя влаги. С увеличением толщины влажной пленки на поверхности металла скорость коррозии вначале резко повышается за счет увеличения электропроводности электролита, а затем незначительно снижается вследствие уменьшения скорости диффузии кислорода к поверхности металла. Влажность воздуха является одним из главных факторов, способствующих образованию на поверхности металла пленки влаги. Влажность воздуха, при которой появляется сплошная пленка влаги на поверхности металла в результате конденсации воды, называют критической влажностью. Величина критической влажности воздуха значительно изменяется в зависимости от состояния поверхности металла и состава атмосферы. Критическая влажность промышленной атмосферы составляет в среднем 60% (относительная влажность). При относительной влажности атмосферы выше критической скорость атмосферной коррозии резко увеличивается. На скорость атмосферной коррозии металлов оказывает влияние также состав пленки влаги, температура, контакт с другими металлами. Примеси в воздухе очень сильно влияют на скорость атмосферной коррозии. Состав пленки влаги на поверхности металла и степень ее агрессивности зависят от загрязненности воздуха и характера этих загрязнений. Промышленные газы (SO2, SO3, СO2, H2S, NН3, Cl2, HCl), попадая в пленку влаги на поверхности металла, увеличивают ее электропроводность, гигроскопичность продуктов коррозии, действуют как депассиваторы (например SO2, НС1). Твердые частицы (например частицы угля), попадающие на поверхность металла, способствуют адсорбции различных газов, конденсации влаги. Наиболее агрессивными являются сильно загрязненные индустриальные атмосферы, наименее активными – чистые и сухие континентальные атмосферы (табл. 3.1). Таблица 3.1 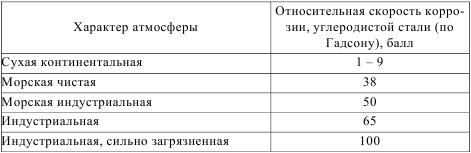 На скорость атмосферной коррозии металлов оказывают влияние резкие температурные колебания. Повышение коррозионной агрессивности при переходе от отрицательных к положительным температурам объясняется повышением скорости электрохимических процессов в связи с переходом пленки влаги на поверхности металла из твердого агрегатного состояния в жидкое. При снижении температуры вечером и ночью относительная влажность воздуха резко увеличивается, что приводит к выпадению росы на поверхности металлов и увеличению электрохимической коррозии. На скорость атмосферной коррозии значительно влияет контакт двух металлов, обладающих различными значениями электродных потенциалов. При решении вопроса о допустимости контакта между металлами или сплавами следует руководствоваться следующими данными. Все металлы и сплавы разделены на пять основных групп: 1 – магний; 2 – цинк, алюминий, кадмий; 3 – железо, углеродистая сталь, свинец, олово; 4 – никель, хром, хромистая сталь, хромоникелевые стали; 5 – медно-никелевые сплавы, медь, серебро. Контакт металлов, входящих в одну группу, считается допустимым, но металлы каждой последующей группы усиливают коррозию металлов предыдущей группы. Для защиты металлов от атмосферной коррозии широко используются следующие методы. — Легирование металлов. Для атмосферных условий эксплуатации наи- более эффективным можно считать легирование, приводящее к получению металлических сплавов с более совершенным защитным слоем продуктов коррозии, или сплавов с пониженной анодной активностью. Например, легирование стали легко пассивирующимися металлами (хром, никель, алюминий, титан) или катодными добавками (медь), облегчающими пассивирование стали в условиях атмосферной коррозии, снижает скорость коррозии. — Снижение относительной влажности воздуха. Уменьшение слоя электролита на поверхности металла путем снижения влажности воздуха консервацией приборов в герметичные чехлы с осушителем (силикагелем) приводит к замедлению работы коррозионных элементов. — Использование ингибиторов. — Применение защитных покрытий. Для защиты от атмосферной коррозии широко применяют защитные неметаллические (лакокрасочные), металлические, оксидные, фосфатные и другие покрытия. 3.2 Подземная коррозия Подземная коррозия металлических конструкций протекает в почвенных или грунтовых условиях и имеет обычно электрохимический механизм. Подземной коррозии подвержены, главным образом, металлические трубопроводы, подземные резервуары, силовые электрические кабели и др. Особенно сильное разрушение наблюдается в условиях совместного воздействия грунта и блуждающих токов. Различают следующие виды почвенной коррозии: − Подземная коррозия – коррозия в почве, вызываемая коррозионными элементами, возникающими на металле в местах соприкосновения его с коррозионной средой вследствие неоднородности металла сооружения, неодинакового состава почвы, различия температур, влажности и воздухопроводности почвы на различных участках сооружения. − Подземная биокоррозия – это коррозия, вызываемая жизнедеятельностью микроорганизмов, воздействующих на металл, обычно процесс завершается электрохимической коррозией. − Электрокоррозия – коррозия металлических подземных сооружений под действием токов утечки с рельсов электрифицированных железных дорог и других промышленных установок. Она подразделяется на коррозию блуждающими токами и коррозию внешним током. В почве содержатся влага и различные химические реагенты, поэтому она обладает ионной проводимостью и в большинстве случаев, за исключением очень сухих грунтов, механизм подземной коррозии – электрохимический. Рассмотрим пример работы коррозионного элемента в почве (рис. 3.1). 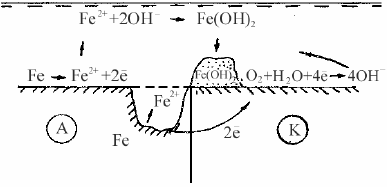 Рис. 3.1 Работа коррозионного микроэлемента На аноде протекает реакция окисления железа с образованием гидрати- рованных ионов. На катоде протекает реакция ионизации кислорода. В электролите почвы ионы Fe2+ и OH− взаимодействуют друг с другом, образуя нерастворимый осадок гидроксида железа, который затем может перейти в оксид железа: Fe2+ + 2OH− → Fe(OH)2, 2Fe(OH)2 → Fe2O3 + H2O. Анодные и катодные процессы, в большинстве случаев, протекают на различных участках, т.е. поверхность корродирующего металла состоит из некоторого числа коррозионных микроэлементов и общая скорость коррозии зависит от числа таких элементов и интенсивности их работы. Такой механизм коррозии называют гетерогенно-электрохимическим. В зависимости от условий возможны следующие виды контроля подземной коррозии металлов: преимущественно катодный контроль – во влажных грунтах; преимущественно анодный контроль – в рыхлых и сухих грунтах; смешанный катодно-омический контроль – при грунтовой коррозии металлических конструкций, вследствие работы протяженных макропар (трубопроводы). В большинстве случаев коррозия подземных сооружений протекает с преимущественным катодным контролем, обусловленным торможением доставки кислорода к поверхности металла. Критериями опасности коррозии подземных металлических сооружений, согласно ГОСТ 9.602 – 89, являются: - коррозионная агрессивность среды по отношению к металлу конструкции; - опасные действия постоянного и переменного блуждающих токов. Скорость коррозии металла в почве зависит от коррозионной активности почвы, то есть от некоторых ее свойств: структуры, пористости, влажности, минерализации грунтовых вод, кислотности, воздухопроводности, удельного электрического сопротивления и температуры среды. — Влажность почвы. Наличие влаги делает грунт электролитом и вызывает электрохимическую коррозию металлов. Увеличение влажности грунта ускоряет протекание анодного процесса, снижает сопротивление электролита и затрудняет протекание катодного процесса при значительном содержании воды в почве. Максимальная скорость подземной коррозии наблюдается в почвах, содержащих 15—25% влаги. — Воздухопроводность грунтов. Пористые грунты могут сохранять влагу в течение длительного времени и создавать благоприятные условия для аэрации (диффузии кислорода). Повышение воздухопроводности грунтов ускоряет коррозионный процесс вследствие облегчения протекания катодного процесса. — Электропроводность грунтов. Наличие в почве водорастворимых солей способствует увеличению ее электропроводности. Наиболее сильно влияют на коррозионный процесс ионы Cl−, NO3−, SO42−, НСО3−, Са2+, Mg2+ Na2+ и др. Увеличение засоленности грунта, кроме того, облегчает протекание анодного (депассивация анодных участков поверхности) и катодного процессов. — Кислотность грунта. Она колеблется в широких пределах (рН 3—9). Очень кислые грунты ускоряют коррозию металлов в результате повышения растворимости вторичных продуктов коррозии и возможной дополнительной водородной деполяризации. По величине рН различают кислые (рН 3—5), нейтральные (рН 6—8) и щелочные (рН 9—10) почвы. — Наличие микроорганизмов. Микроорганизмы, находящиеся в грунтах, могут вызывать значительное местное ускорение коррозии металлов. Наибольшую опасность представляют анаэробные сульфатредуцирующие бактерии, которые развиваются в илистых, глинистых и болотистых грунтах. — Температура грунта. Температура грунта влияет на кинетику электродных процессов и диффузию, определяющие скорость коррозии. Обычно с увеличением температуры наблюдается экспоненциальное возрастание скорости подземной коррозии металла. Различие температур на отдельных участках протяженных подземных сооружений может привести к возникновению термогальванических коррозионных элементов, усиливающих коррозию. Удельное электрическое сопротивление почвы является функцией всех рассмотренных свойств почвы и представляет один из наиболее характерных показателей коррозионной активности почв по отношению к стали. В определенных границах существует прямая зависимость: чем меньше удельное электрическое сопротивление, тем больше скорость коррозии. Эта зависимость позволяет приближенно оценить коррозионную активность почв. Согласно ГОСТ 9.602 – 89, коррозионную активность почв по отношению к стали оценивают: - по удельному электросопротивлению почвы; - по средней катодной плотности тока при смещении потенциала катода на 100 мВ отрицательнее потенциала коррозии стали. Для борьбы с подземной коррозией сооружений широко используют следующие способы: — Защитные изолирующие покрытия. Это основной метод защиты. Например, на трубопроводы наносят битумное покрытие. Применяют также покрытия на основе липких поливинилхлоридных и полиэтиленовых лент. — Катодная защита от внешнего источника постоянного тока или протекторная защита. — Искусственные среды. Для защиты от коррозии трубопроводов обрабатывают грунт, окружающий металл, различными веществами для снижения или нейтрализации его агрессивных свойств (например обработка кислого грунта известью). Иногда для создания однородного грунта по всей длине трубопровод засыпают песчаным грунтом. Однако этот метод очень трудоемкий и дорогой. Коррозия металлов блуждающим током Коррозия металлов блуждающими токами является частным, но имеющим большое практическое значение, случаем влияния электрического поля в электролите на процесс электрохимической коррозии металлов. Электрический ток в почве, ответвляющийся от своего основного пути, называют блуждающим. Источником блуждающего тока могут быть электрические железные дороги, электролизеры, сварочные аппараты, катодные установки, линии электропередач и др. Например при протекании тягового тока по рельсам вдоль них происходит падение напряжения и рельсы получают некоторый положительный потенциал относительно земли, а несовершенная изоляция рельсов от земли вызывает утечку тока в окружающий грунт. И чем больше продольное сопротивление и меньше переходное электросопротивление, тем больше суммарный ток утечки в землю. Вблизи подстанций и пунктов присоединения кабелей токоотводов к рельсам существуют участки постоянной отрицательной полярности рельсов, а на значительном удалении от них – постоянной положительной полярности. Протекающие в земле блуждающие токи, встречая на своем пути металлические сооружения, проникают в них и текут по ним на некотором протяжении, создавая анодные и катодные зоны. Переменный блуждающий ток также коррозионноопасен, но в меньшей сте- пени, чем постоянный. Интенсивность процесса коррозии металла в поле блуждающих токов, как правило, намного больше, чем интенсивность почвенной коррозии. Эти два процесса накладываются друг на друга. При этом совпадение анодных зон коррозионных элементов и блуждающих токов приводит к усилению коррозии. Нанесение защитного покрытия (лакокрасочного, битумного, полиэтиленового и др.) резко повышает сопротивление. Сопротивление изоляции подземного сооружения – наиболее существенный фактор ограничения блуждающих токов, воздействующих на сооружение. По сравнению с плохо изолированным сооружением в хорошо изолированном ток коррозии уменьшается в сотни раз. Почва является параллельным проводником, например рельсов, и, в зависимости от величины электросопротивления рельсов и грунта, ток иногда весьма значительной величины (до сотен ампер) проходит по земле. Блуждающие токи имеют радиус действия до десятков километров в сторону от токонесущих конструкций. 3.3 Морская коррозия Коррозии в морской воде подвержены металлические части морских судов, механизмы и трубопроводы, металлические сооружения морских портов и т. д. Морская вода является хорошо аэрированным, нейтральным электролитом с высокой электропроводностью, обусловленной наличием в ней солей с большим содержанием хлоридов, оказывающих депассивирующее действие. Механизм морской коррозии металлов электрохимический. На скорость морской коррозии оказывают влияние состав морской воды, ее температура и скорость движения, дополнительный механический фактор (аэрирование, кавитация), контакт разнородных металлов, биологический фактор (обрастание подводной части металлических сооружений морскими растительными и животными организмами). Общая концентрация солей в морской воде достигает 4%, что влияет на ее электропроводность. Йод и бром играют роль дополнительных катодных деполяризаторов и ускоряют коррозию. Хлорион является сильным депассиватором, т. е. ускоряет анодный процесс коррозии металлов. Сероводород подкисляет морскую воду и связывает ионы металлов в труднорастворимые сульфиды, облегчая протекание анодного и катодного электродных процессов электрохимической коррозии. При прохождении электрического тока через подводную часть судов и морских сооружений возникает их электрокоррозия. Большое влияние на скорость коррозии в морской воде оказывает глубина погружения. Скорость коррозии металлов резко уменьшается с глубиной погружения, что связано с уменьшением содержания кислорода в воде. На глубине 1000 м наблюдается минимум скорости коррозии, что соответствует достижению минимального содержания кислорода в морской воде. Наиболее распространенным методом защиты металлов от коррозии в морской воде является нанесение лакокрасочных покрытий. Используют также цинковые и кадмиевые покрытия как самостоятельные или как подслой под лакокрасочные. Широкое применение находит электрохимическая защита морских судов и сооружений, а также применение некоторых коррозионно-стойких сплавов (например сплав меди с никелем). |
