биохимия. дз бх. 1. Структурная организация коллагена. Основная структурная единица коллагена
 Скачать 68.82 Kb. Скачать 68.82 Kb.
|
|
1.Структурная организация коллагена. Основная структурная единица коллагена. Коллаген- мультимерный белок (субъединица –тропоколлаген). Имеет фибриллярную форму, состоящую из трех полпипетидных левозакрученных альфа спиралей объедененных в правозакрученный тропоколлаген. Между молекулами тропоколлагена образуются ионные связи «конец в конец» и ковалентные связи «бок о бок» с участием лизина под действием лизилоксидазы . Коллагеновые фибриллы объединяются в коллагеновое волокно, формирующие остальные структуры (например сухожилие). В первичной структуре коллагена наиболее часто повторяющийся компонент- [гли-про-Х], где Х любая аминокислота. Вторичная структура характеризуется левозакрученной альфа спиралью с витком, на который приходится 3 аминокислотных остатка. Образование водородных связей здесь невозможно. Третичная структура стабилизируется водородными связями между молекулами полипептидных левозакрученных спиралей за счет остатков гидроксипролина. 2. Участие витамина С в созревании коллагена. При недостатке витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Гидроксилирование пролина и лизина, реакции катализируют пролилгидроксилаза, лизилгидроксилаза, их кофактор Fe2+, для поддержания их в восстановленной форме необходим витамин С. 3. Эластин, его свойства, химический состав и молекулярная структура. Основной белок эластических волокон, которые содержатся в межклеточном веществе кожи, стенок кровеносных сосудов, связок, лёгких, желчного пузыря, мочевого пузыря, кишечника. Преобладают аминокислоты с неполярными радикалами: глицин, валин, аланин, много пролина и лизина, нет гидроксилизина, мало гидроксипролина. Не формируют регулярные вторичную и третичную структуры. Пептидные цепи эластина связаны поперечными сшивками в разветвленную сеть. В образовании сети участвует медьзависимая лизилоксидаза. Данная структурная организация эластина обеспечивает белок свойством эластичности. Десмозин- структура, образованная остатками лизина четырех полипептидных цепей. Также в образовании поперечных сшивок может участвовать изодесмозин и лизиннорлейцин. Эластин синтезируется как растворимый мономер (тропоэластин) 4. Сравнительная характеристика коллагена и эластина- основных белков соединительной ткани. Коллаген- Много генетических типов, белок фибриллярный, есть тройная спиараль и повторы [гли-про-Х], в составе присутствует гидроксилизин, содержит углеводсодержащие межмолекулярные альдольные поперечные сшивки, образование растяжимых пептидов во время биосинтеза Эластин-один генетический тип, белок глобулярный, нет тройной спиарали и повторов [гли-про-Х], в составе нетгидроксилизин, не содержит углеводсодержащие межмолекулярные альдольные поперечные сшивки, не образует растяжимых пептидов во время биосинтеза. Протой белок. 5. Протеогликаны - основные белки межклеточного вещества соединительной ткани, структурная организация. В организме гликозаминогликаны связаны с молекулами белков. Такие «структурные комплексы» называются протеогликанами. В протеогликанах длинная линейная молекула гиалуроновой кислоты или другого гликозаминогликана связана нековалеными связями с молекулами белка. Последняя связана ковалентными связями с макромолекулами хондроитинсульфата, кератансульфата или др. гликозаминогликанов. 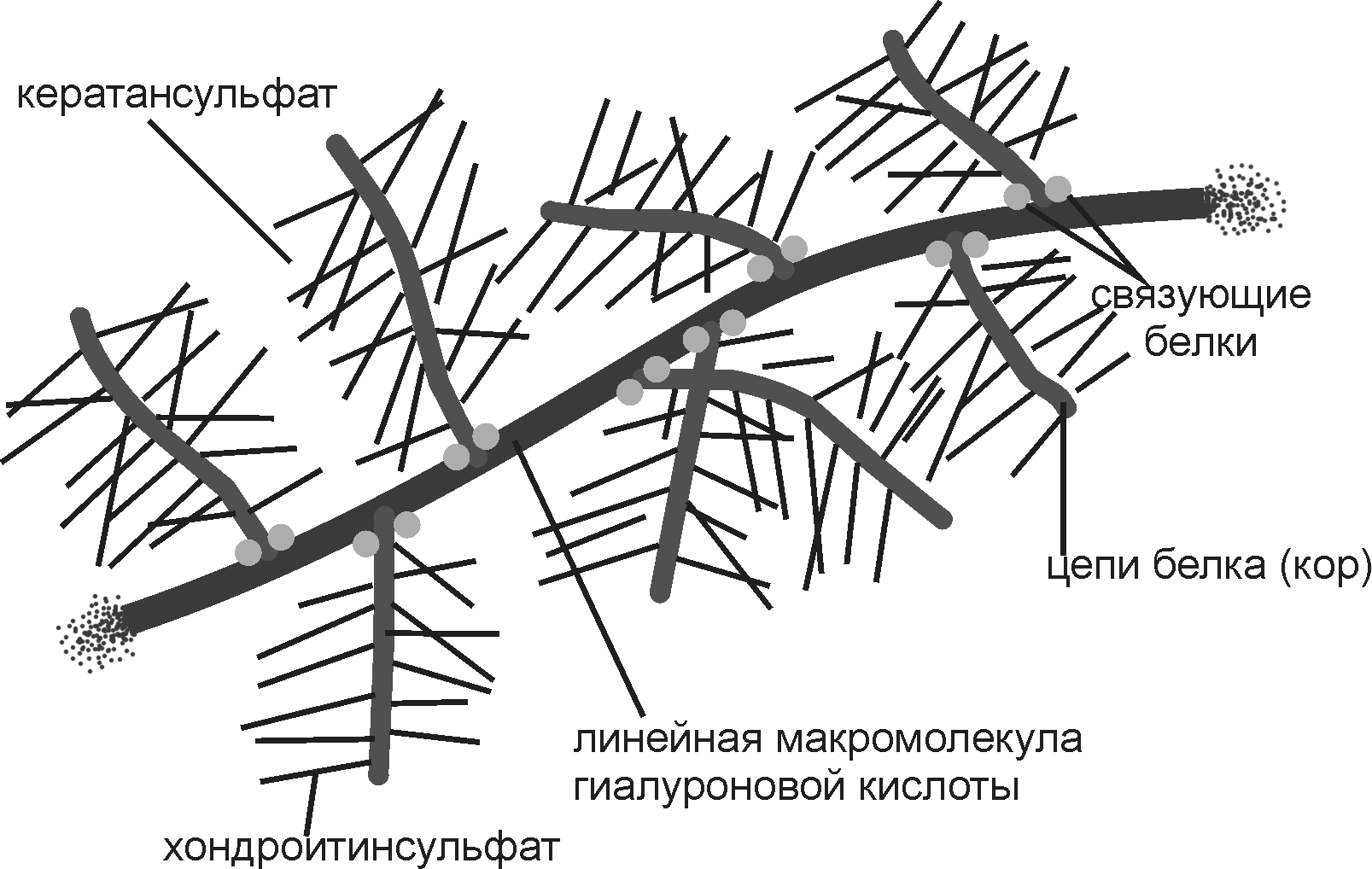 6. Гликозаминогликаны, структура и функция. {гексуроновая кислота (галактоза)-O- Ацетилгексозамин / сульфат }n- Структурная формула ГАГ. Функции: Депонирование воды, Депонирование жира (адипоциты) Депонирование осмотически активных ионов (Na+, Cl-), Формирование тургора ткани, Минерализационная роль (связывание Ca2+ в кости и зубе), Формирование гисто-гематических барьеров, Противосвертывающая функция (гепарин) , Защитная функция (сайты связывания иммуноглобулинов) |
