БИОХИМИЯ.ЛИПИДЫ.№2. БИОХИМИЯ.ЛИПИДЫ. 1. Триглицериды синтезируются в
 Скачать 388 Kb. Скачать 388 Kb.
|
1.Триглицериды синтезируются в клетках различных органов и тканей в качестве резервных питательных веществ, однако их синтез с наибольшей интенсивностью протекает в клетках печени и в клетках жировой ткани. Для синтеза необходимы высшие жирные кислоты и глицерол. Высшие жирные кислоты или поступают в клетки из плазмы крови, или же синтезируются в них из ацетил-КоА. Глицерол может поступать в клетки из плазмы крови, однако основным источником глицерола для синтеза триглицеридов и фосфолипидов в клетках служит фосфодигидроксиацетон - промежуточный продукт расщепления глюкозы. Высшие жирные кислоты участвуют в биосинтезе триглицеридов в виде своих активированных производных - ацил-КоА. Необходимый для синтеза 3-фосфоглицерол образуется или путем восстановления фосфодигидроксиацетона ( реакция катализируется глицеральдегид-3-фосфатдегидрогеназой за счет обратимости ее действия ), или за счет фосфорилирования свободного глицерола (реакция катализируется АТФ-зависимой глицеролкиназой). После образования 3-фосфоглицерола за счет двух последовательных реакций ацилирования образуется фосфатидная кислота. От нее гидролитическим путем отщепляется остаток фосфорной кислоты с образованием диглицерида, а затем с помощью еще одной реакции ацилирования завершается синтез триацилглицерина. Синтез резервных триацилглицеринов идет в основном в период абсорбции продуктов пищеварения и поступления их во внутреннюю среду организма. В постабсорбционном периоде идет мобилизация резервных триглицеридов. Они расщепляются в клетках под действием ферментов липаз. 2 вопрос. Мобилизация жиров из жировой ткани Адипоциты (место депонирования жиров) располагаются в основном под кожей, образуя подкожный жировой слой, и в брюшной полости, образуя большой и.малый сальники. Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе. Гидролиз внутриклеточного жира осуществляется под действием фермента гормончувствительной липазы - ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) в комплексе с белком плазмы - альбумином. Вопрос№3 Регуляция процессов синтеза и «мобилизации» триглицеридов, их биологическая роль. Какой процесс будет преобладать:
1) Регуляция синтеза жиров. В абсорбированный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани
В печени
ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жк в адипоциты, где они депонируются в составе триацилглицеринов. Биологическое значение: - запасание жиров в жировой ткани – основная форма депонирования источников энергии в организме человека. 2) Регуляция мобилизации жиров. Стимулируется:
В постабсорбированный период:
1. при физической нагрузке адреналин, который действует на аденилциклазную систему через:
  4. В крови триацилглицеролы, входящие в состав зрелых хиломикронов, гидролизуются ферментом липопротеинлипазой. ЛП-липаза связана с гепарансульфатом (гетерополисахоридом), находящимся на поверхности эндотелиальных клеток, выстилающих стенки кровеносных сосудов. ЛП-липаза гидролизует молекулы жиров до 3 молекул ЖК. На поверхности ХМ различают 2 фактора, необходимых для активности ЛП-липазы – АпоС-II и фосфолипиды. АпоС-II активирует этот фермент, а фосфолипаза участвует в связывание этого фермента с поверхностью ХМ. ЛП-липазы синтезируются в разных клетках многих тканей, но они все отличаются по значению. Поэтому гидролиз ЛП-липазы происходит в абсорбированный период. ЖК поступают в адипоциты и используются для синтеза жиров. В постабсорбированном состоянии, когда количество жиров в крови снижается, ЛП-липаза продолжает синтезировать жиры в составе ЛПОНП, которые присутствуют в крови в небольшом количестве, и ЖК используются в этой ткани как источник энергии. Даже при низкой концентрации жиров в крови. 5 вопр.бх активация вжк Процесс активации высших жирных кислот состоит из 2 этапов: 1 этап. За счет взаимодействия жирных кислот и использования специального фермента ацилКосинтетаза образуется ациладенилаты. Кроме того образуется второй продукт - пирофосфат, который немедленно расщепляется до фосфорной кислоты (так называемый термодинамический контроль направления процесса) 2 этап. Происходит образование активной жирной кислоты соединенной с КоА и высвобождение АМФ. Образование ацилКоА катализируется специальным ферментом ацилКоАсинтетаза (тиокиназа). В ходе активации высшей жирной кислоты АТФ распадается до АМФ и 2 остатков фосфорной кислоты, таким образом активация обходится клетке в 2 макроэргических эквивалента. Во всех своих превращениях в клетках жирные кислоты участвуют в активированной форме. RCOOH+HSKoA+ATФ->RCO-SKoA+AMФ+H4P2О7 6 вопрос. Окисление высших жирных кислот (β-окисление) Окисление ВЖК протекает в митохондриальном матриксе только в аэробных условиях, так как тесно связано с функционированием цитратного цикла и цепи переноса электронов. Жирные кислоты с короткой длиной цепи (4–10 углерод- ных атомов) самостоятельно проходят в митохондрии и там активируются. Ацил-КоА-синтетаза ЭР или наружной мембраны митохондрий превраща- ет ВЖК в ацил-КоА. Затем под действием фермента карнитинацилтрансфера- зы I (КАТ 1) ацильный остаток с ацил-КоА переносится на карнитин с обра- зованием ацилкарнитина. Специфическая транслоказа проводит это вещество через внутреннюю мембрану митохондрий. На внутренней по- верхности внутренней мембраны митохондрий карнитинацилтрансфераза II (КАТ П) расщепляет ацилкарнитин с помощью митохондриального HS-КоА. Ацил-КоА, освобождающийся в матрикс, участвует в реакциях β-окисления, а свободный карнитин той же транслоказой возвращается на на- ружную мембрану. Интенсивность поступления ВЖК в матрикс митохондрий зависит от соотно- шения количества малонил-КоА/ацил-КоА. Чем выше в клетке концентрация малонил-КоА, тем ниже скорость переноса жирных кислот в матрикс митохон- дрий, так как малонил-КоА — аллостерический ингибитор КАТ1, а ацил-КоА — его активатор. Попав в матрикс митохондрий, ацильный остаток в циклическом процессе с помощью совокупности ферментов окисляется по β-углеродному атому. Каж- дый цикл включает четыре последовательные реакции, в результате которых жирная кислота укорачивается на два углеродных атома, которые отщепляются в виде ацетил-КоА. Ацетил-КоА может вступать в цитратный цикл и окисляться до СО2 и Н2О, а укороченный ацильный остаток будет вовлекаться в следующий цикл β-окисления. В результате β-окисления ВЖК полностью расщепляются до ацетил-КоА, и суммарное уравнение окисления, например пальмитиновой кислоты (С16) име- ет следующий вид: СН3(СН2)14-СОSКоА + 7FAD + 7NAD+ +7H2O + 7HSKoA→ 8CH3- COSКоА + 7FADH2 + 7(NADH + H+) Выход энергии при β-окислении ВЖК За один цикл β-окисления образуется 1 моль ацетил-КоА, окисление кото- рого в цитратном цикле обеспечивает синтез 12 моль АТФ. Кроме того, в этом процессе восстанавливаются 1 моль FADH2 и 1 моль NADH, окисление которых в дыхательной цепи дает 2 и 3 моль АТФ соответственно. При окислении пальмитиновой кислоты проходит 7 циклов β-окисления и образуется 8 моль ацетил-КоА, 7 моль FADH2 и 7 моль NADH+Н+. Следо- вательно, выход АТФ составляет 35 АТФ при β-окислении и 96 АТФ в резуль- тате цитратного цикла, что в сумме дает 131 моль АТФ. Поскольку активация ВЖК требует затраты 1 АТФ, которая в ходе реакции распадается на АМФ и Н4Р2О7, то есть используются две макроэргические связи молекулы, то из 131 следует вычесть 2 моль АТФ. Общая формула для подсчета выхода АТФ при полном окислении насыщенных ВЖК записывается следующим образом: [(n/2 — 1)x 5 + n/2 × 12] — 2, где n — число С атомов в молекуле ВЖК; n/2 — 1 — число циклов β-окисления; 5 — выход АТФ в одном цикле β-окисления; n/2 — число ацетильных остатков; 12 — выход АТФ при полном окислении ацетил-КоА в цитратном цикле до СО2 и Н2О. Окисление ненасыщенных ВЖК идет по пути β-окисления до получения жир- ной кислоты с –НС=СН-связью в положении С3–С4. Дополнительные фер- менты: еноил-КоА-изомераза и трансфераза перемещают двойную связь в поло- жение 2–3 и цис-изомер превращают в транс-изомер. Далее β-окисление продолжается с участием ферментов, описанных ранее. При расчете выхода АТФ за счет окисления ненасыщенных ВЖК можно пользоваться формулой для расчета выхода энергии при окислении насыщенных ВЖК, вычитая 2АТФ на каждую двойную связь. Окисление ВЖК с нечетным числом углеродных атомов протекает по механизму β-окисления с образованием определенного количества ацетил-КоА и молекулы пропионил-КоА. В метаболизме последнего участвуют дополнительные ферменты: пропионил-КоА-карбоксилаза и метилмалонил-КоА-мутаза, работающие с участием биотина и витамина В12. В результате пропионил-КоА превращается в сукцинил-КоА, который может поступать в цитратный цикл или участвовать в синтезе гема 7. вопрос. Биосинтез и окислительный распад ацетоновых тел Жирные кислоты, поступающие в гепатоциты, активируются и подвергаются b-окислению с образованием ацетил-КоА. Именно этот ацетил-КоА используется для синтеза ацетоновых тел: ацетоацетата, b-гидроксибутирата и ацетона, по следующей схеме: Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Этот процесс в той или иной мере идет постоянно и ацетоновые тела постоянно присутствуют в крови в концентрации до 30 мг/л. Ежесуточное их выделение с мочой не превышает 20 мг. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела, однако при голодании даже головной мозг от 1/2 до 3/4 свой потребности в энергии может удовлетворять за счет окисления ацетоновых тел. Ацетоацетат,поступающий в клетки различных тканей, прежде всего подвергается активации с помощью одного из двух возможных механизмов: -поступающие в дальнейшем в цикл Кребса, где ацетильные остатки окисляются до СО2 и Н2О. - Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для " экспорта" ацетоацетата из гепатоцитов в кровь. b-Гидроксибутират в клетках предварительно окисляется с участием НАД+ в ацетоацетат. Эта реакция катализируется ферментом b-гидроксибутиратдегидрогеназой. Ацетон также может окисляться в клетках периферических органов. Возможны два варианта его окисления: во-первых, он может расщепляться до ацетильного и формильного остатков; во-вторых, через пропандиол он может превращаться в пируват. Ацетоновые тела, накапливаясь в крови и в тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в липоцитах. Биологическая роль этого регуляторного механизма становится понятной, если принять во внимание, что ацтоацетат и гидроксибутират представляют собой достаточно сильные органические кислоты, в связи с чем их избыточное накопление в крови приводит к развитию ацидоза. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови. 8 вопрос. Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот. Однако главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединённых в пируватдегидрогеназный комплекс (ПДК). Ацетильный остаток - ацетил- Ко А далее окисляется в цикле лимонной кислоты до СО2 и Н2О. В этих реакциях окисления принимают участие NAD- и FAD-зависимые дегидрогеназы, поставляющие электроны и протоны в ЦПЭ, по которой они передаются на О2. это второй шаг кислородного клеточного дыхания, декарбоксилирования пирувата, который происходит в матриксе митохондрии. Ацетил-КоА затем поступает в цикл трикарбоновых кислот. Ацетил-КоА является ключевым метаболитом липидного обмена в печени Ацетил-КоА, являясь конечным продуктом гликолитического цикла, может использоваться как источник энергии (в цикле Кребса), а также участвовать в синтезе триглицеридов, холестерина, стероидов и образовании кетоновых тел У животных ацетил-КоА является основой баланса между углеводным обменом и жировым обменом. Обычно ацетил-КоА из метаболизма жирных кислот поступает в цикл трикарбоновых кислот, содействуя энергетическому обеспечению клеток. В печени, когда уровень циркуляции жирных кислот высок, производство ацетил-КоА от разрыва жиров превышает энергетические потребности клетки. Чтобы использовать энергию, доступную из лишних ацетил-КоА, создаются кетоновые тела, которые затем могут циркулировать в крови. В некоторых обстоятельствах это может привести к высокому уровню кетоновых тел в крови, состоянию, называемому кетозом, которое отличается от кетоацидоза, опасного состояния, способного повлиять на диабетиков. Синтез кетоновых тел. При β-окислении жирных кислот в митохондриях печени образуется ацетил-КоА, подвергающийся дальнейшему окислению в цикле Кребса. Если в клетках печени имеется дефицит оксалоацетата (например, при голодании, сахарном диабете), то происходит конденсация ацетильных групп с образованием кетоновых тел (ацетоацетат,β-гидроксибутират, ацетон). Эти вещества могут служить энергетическими субстратами в других тканях организма (скелетные мышцы, миокард, почки, при длительном голодании - головной мозг). Печень не утилизирует кетоновые тела. При избытке кетоновых тел в крови развивается метаболический ацидоз.
Ацетил-КоА может быть карбоксилирован в цитозоле в ацетил-КоА карбоксилазу, давая начало малонил-КоА, необходимого для синтеза флавоноидов и родственных поликетидов, для удлинения жирных кислот (образование восков), У животных организмов ацетил КоА играет роль в обмене веществ, по мимо этого КоА как баланс между жировым обменом, так и углеводным. Для содействия клеток энергетическому соединению, КоА из жирных кислот поступает в цикл трикорбоновых кислот. Субстрат для синтеза жирных кислот Ацетил-КоА, образующийся под действием пируватдегидрогеназного комплекса (1), не проникает через мембрану митохондрий в цитоплазму, где происходит синтез жирных кислот. Поэтому ацетил-КоА конденсируется ферментом цитратсинтазой с оксалоацетатом (2), образуя цитрат, который с помощью транслоказы переносится в цитоплазму, где он расщепляется под действием цитратлиазы (3), и ацетил-КоА используется как субстрат для синтеза жирных кислот. Первая реакция синтеза жирных кислот - это превращение ацетил-КоА в малонил-КоА:  Фермент, катализирующий эту реакцию, ацетил-КоА-карбоксилаза,является регуляторным в биосинтезе жирных кислот. Он относится к классу лигаз и в качестве кофермента использует биотин. Фермент, катализирующий эту реакцию, ацетил-КоА-карбоксилаза,является регуляторным в биосинтезе жирных кислот. Он относится к классу лигаз и в качестве кофермента использует биотин.Исходным субстратом для синтеза холестерола является ацетил-КоА. Синтез холестерола происходит в абсорбтивный период, когда в печени активируется гликолиз, который является главным источником ацетил-КоА для синтеза холестерола. В синтезе холестерола из ацетил-КоА участвует около 30 ферментов, и этот метаболический путь является одним из самых длинных в организме. Реакции синтеза холестерола происходят в цитозоле и эндоплазматическом ретикулуме. Для синтеза необходим ацетил-КоА и NАDPН, образующийся в основном в реакциях пентозофосфатного пути катаболизма глюкозы. Все 27 атомов углерода холестерола происходят из ацетил-КоА. 2. Процесс синтеза холестерола условно разделяют на три этапа. I этап - реакции от ацетил-КоА до мевалоновой кислоты. Так как ацетил-КоА образуется в митохондриях, а синтез холестерола происходит в цитоплазме клеток, то (как и при синтезе жирных кислот) ацетилКоА доставляется в цитоплазму в составе цитрата. Первые реакции процесса сходны с реакциями синтеза кетоновых тел, которые, в отличие от синтеза холестерола, протекают в митохондриях. 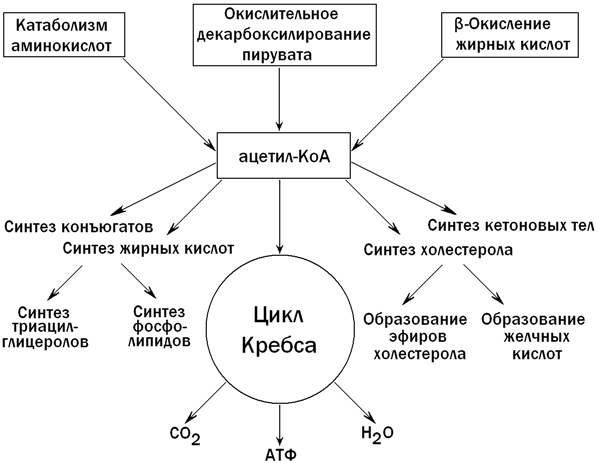 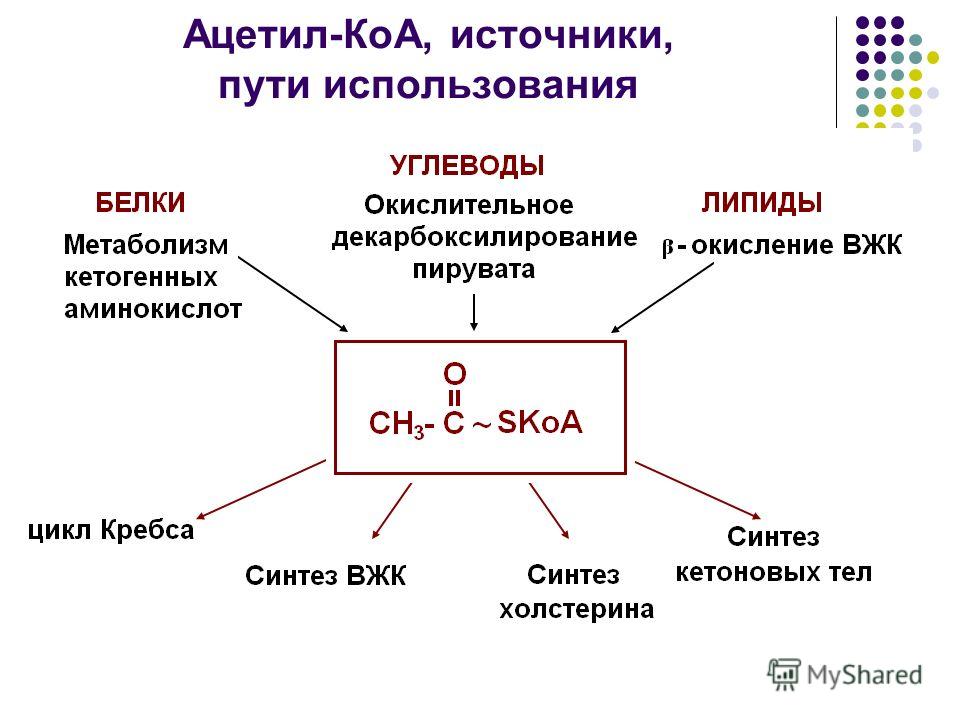 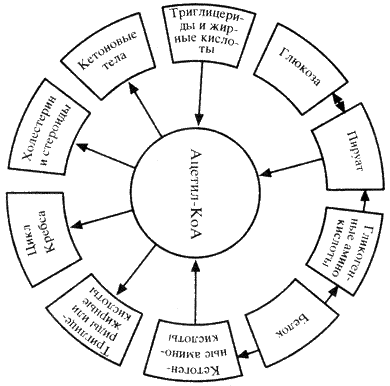 9 вопрос. Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль:*может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении, *обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. П 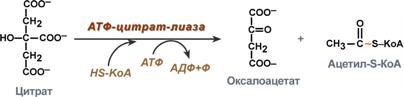 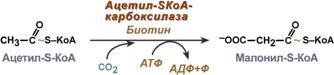 оступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируватмалик-ферментом ("яблочный" фермент). оступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируватмалик-ферментом ("яблочный" фермент). 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов. 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН. В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой. Удлинение цепи жирных кислот С 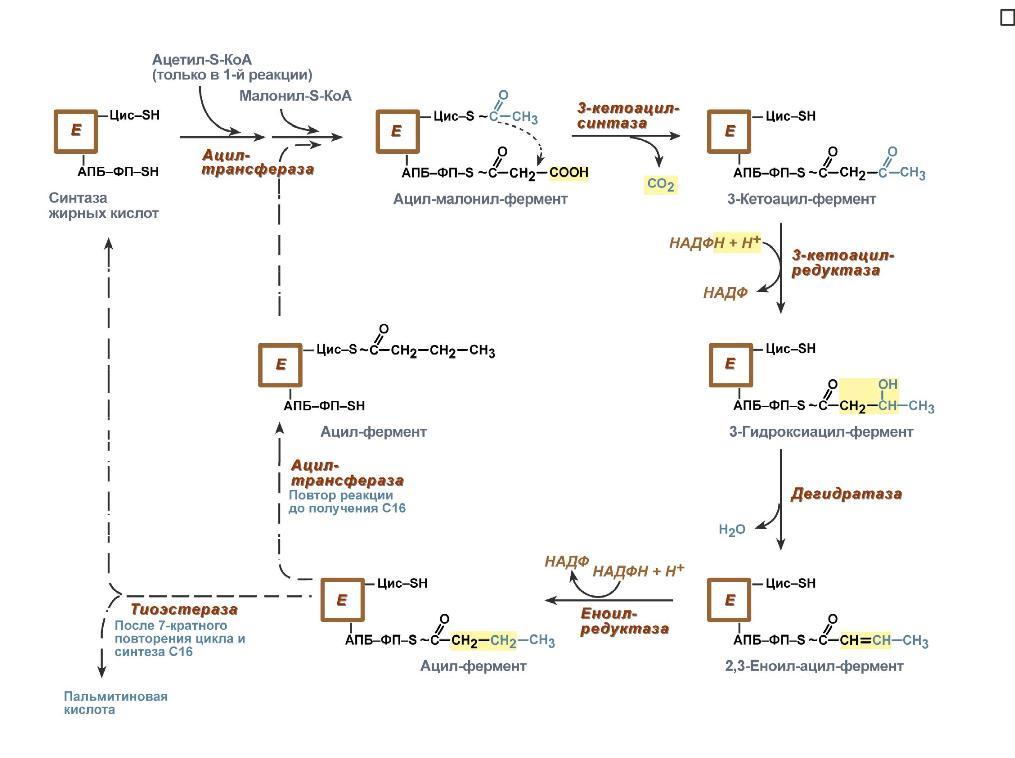 интезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум или в митохондрии. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников. интезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум или в митохондрии. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников.Синтезир-ся в орг-ме в основном пальмитиновая к-та. При необходимости ж к-ты с большим числом углеродных атомов. Ненасыщенные ж к-ты обр-ся на мембранах ЭПС с участием О2, НАДН и В5. Под воздействием ферментов десатураз обр-ся пальмитиновая и олеиновая к-ты. Полиненасыщенные ж к-ты (линолевая, арахидоновая, линоленовая) должны поступать с пищей. Источником углевода для синтеза ж к-т служит ацетилКоА, обр-ся при распаде углеводов. Избыток углеводов, поступающих в орг-м трансформир-ся в ж к-ты, а затем в жиры. Лимитирующим ферментом является ацетил-КоАкарбоксилаза. Аллостерические активаторы — АТФ и цитрат, ингибиторы — жирные кислоты с длинной цепью. Инсулин, эстрогены активиру¬ют, катехоламины и стресс ингибируют синтез жирных кислот. Значение:при распаде УВ обр ацетил-Коа, который используется в синтезе ЖК, т.о. избыток УВ запасается в виде жира. Вопрос 10. Основные этапы биосинтеза холестерола, регуляция синтеза. Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень. В печени синтезируется более 50% холестерола, в тонком кишечнике - 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг. Холестерол выполняет много функций:
Обмен холестерола чрезвычайно сложен - только для его синтеза необходимо осуществление около 100 последовательных реакций. Всего в обмене холестерола участвует около 300 разных белков. Нарушения обмена холестерола приводят к одному из наиболее распространённых заболеваний - атеросклерозу. Накопление холестерола в организме приводит к развитию и другого распространённого заболевания - желчнокаменной болезни. Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека. Образование мевалоната Сложный путь синтеза холестерола можно разделить на 3 этапа. Первый этап заканчивается образованием мевалоната (мевалоновой кислоты). Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА. Фермент гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза кетоновых тел. !Однако реакции синтеза кетоновых тел происходят в митохондриях печени, а реакции синтеза холестерола - в цитозоле клеток! Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза - гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль. Образование сквалена На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат - изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц - геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата - соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена - углеводорода линейной структуры, состоящего из 30 углеродных атомов. Образование холестерола На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов. У холестерола имеется насыщенная разветвлённая боковая цепь из 8 углеродных атомов в положении 17, двойная связь в кольце. В между атомами углерода в положениях 5 и 6, а также гидроксильная группа в положении 3. В организме человека изопентенилпирофосфат также служит предшественником убихинона (KoQ) и долихола, участвующего в синтезе гликопротеинов. Этерификация холестерола В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул - эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА:холестеролаиилтрансферазой). Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин:холестеролацилтрансфераза). Эфиры холестерола - форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров. Регуляция синтеза холестерола Регуляция обеспечивает баланс между синтезом и поглощением холестерина из пищи. Регуляция ключевого фермента синтеза холестерола (ГМГ-КоА-редуктазы) происходит разными способами.
Следовательно, в абсорбтивный период(Абсорбтивный период характеризуется временным повышением концентрации глюкозы, аминокислот и жиров в плазме крови. Клетки поджелудочной железы отвечают на это повышение усилением секреции инсулина и снижением секреции глюкагона) синтез холестерола увеличивается. В постабсорбтивном состоянии глюкагон через протеинкиназу А стимулирует фосфорилирование ГМГ-КоА-редуктазы, переводя её в неактивное состояние. Это действие усиливается тем, что одновременно глюкагон стимулирует фосфорилирование и инактивацию фосфатазы ГМГ-КоА-редуктазы и фосфорилирование киназы ГМГ-КоА-редуктазы, удерживая, таким образом, ГМГ-КоА-редуктазу в фосфорилированном неактивном состоянии. В результате синтез холестерола в постабсорбтивном периоде и при голодании ингибируется.
+Регуляция уровня внутриклеточного холестерина:
Вопрос №11. Синтез глицерофосфолипидов. Глицерофосфолипиды синтезируется из фосфатидной кислоты и азотсодержащих добавочных веществ. В синтезе фосфолипидов активатором служит ЦТФ, который может активировать или фосфатидную кислоту, или серин (коламин, холин). В связи с этим возможны два варианта синтеза фосфолипидов. а) Активация фосфатидной кислоты: б) Активация холина (серина, коламина): 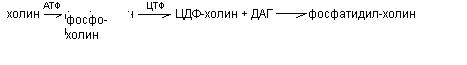 Таким образом, синтез глицерофосфолипидов и триацилглицеринов на начальных стадиях осуществляется путём образования фосфатидной кислоты. Для активации синтеза из неё структурных фосфолипидов используются липотропные вещества. К ним относится холин, метионин, витамин В12 и др. Липотропные вещества препятствуют жировой дистрофии печени, миокарда при гепатитах, миокардитах. |
