Алкины. Лекции Строение молекул, изомерия, номенклатура. Способы получения
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
|
ЛЕКЦИЯ 4 АЛКИНЫ Схема лекции 1. Строение молекул, изомерия, номенклатура. 2. Способы получения. 2.1 Промышленные способы. 2.2 Лабораторные способы. 3. Физические свойства. 4. Химические свойства. 4.1. Особенные свойства тройной связи. 4.2. Электрофильное присоединение. 4.3. Нуклеофильное присоединение. 4.4. Винилирование. 4.5. Гидрирование. 4.6. Окисление. 4.7. Полимеризация. 4.8. Реакции замещения. 4.8.1. Металлирование. 4.8.2. Реакции присоединения к карбонильным соединениям.
Алкинами, ацетиленовыми углеводородами называют углеводороды, в состав молекул которых входят как минимум два углеродных атома, находящиеся в состоянии sp-гибридизации и соединенные друг с другом тремя связями. Алкины образуют гомологический ряд с общей формулой СnН2n-2. Первым членом гомологического ряда является ацетилен имеющий молекулярную формулу С2Н2 и структурную формулу СНСН. В силу особенности sp-гибридизации молекула ацетилен имеет линейное строение. Наличие двух π-связей расположенных в двух взаимно перпендикулярных плоскостях предполагает расположение α-атомов замещающих групп на линии пересечения плоскостей, в которых расположены π-связи. Поэтому связи атомов углерода, затраченные на соединение с другими атомами или группами жестко расположены на линии под углом 1800 друг к другу. Строение системы тройной связи в молекулах алкинов определят их линейное строение. Особенность строения молекул алкинов предполагает существование изомерии положения тройной связи. Структурная изомерия, обусловленная строением углеродного скелета, начинается с пятого члена гомологического ряда. 1. Изомерия положения тройной связи. Например:  2. Структурные изомеры. Например: 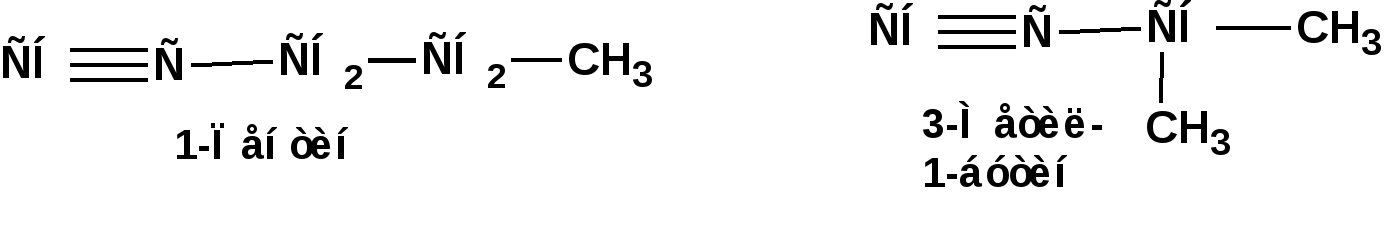 Первый член гомологического ряда носит тривиальное название «ацетилен». По рациональной номенклатуре ацетиленовые углеводороды рассматриваются как производные ацетилена, Например: 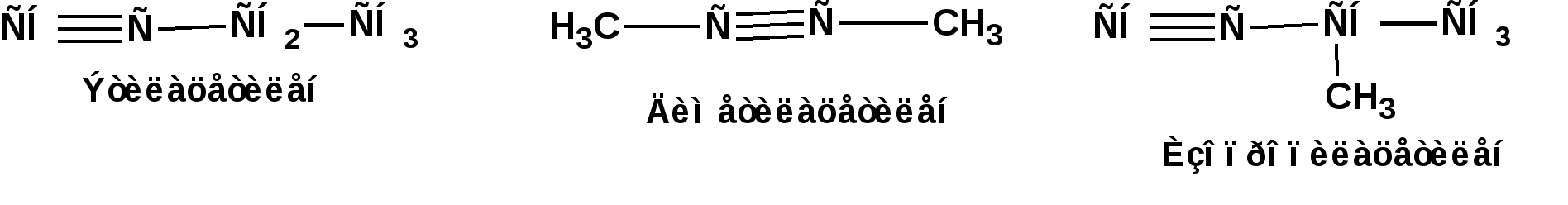 По номенклатуре ИЮПАК названия алкинов образуются заменой суффикса «ан» на «ин». Главную цепь выбирают таким образом, чтобы в нее попала тройная связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе тройная связь. При наличии в молекуле двойной и тройной связей двойная связь имеет меньший номер. Например: По номенклатуре ИЮПАК названия алкинов образуются заменой суффикса «ан» на «ин». Главную цепь выбирают таким образом, чтобы в нее попала тройная связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе тройная связь. При наличии в молекуле двойной и тройной связей двойная связь имеет меньший номер. Например:Тройная связь может быть концевой (терминальной, например, в пропине) или «внутренней», например в 4-метил-2-пентине. При составлении названий радикал -ССН называют «этинил». 2. Способы получения. 2.1 Промышленные способы. В промышленных условиях получают главным образом ацетилен. Существуют два способа получения ацетилена. 1. Карбидный способ получения ацетилена Ацетилен впервые карбидным способом был получен Фридрихом Велером в 1862г. Появление карбидного способа положило начало широкому применению ацетилена, в том числе и в качестве сырья в органическом синтезе. До настоящего времени карбидный способ является одним из основных промышленных источников ацетилена. Способ включает две реакции: 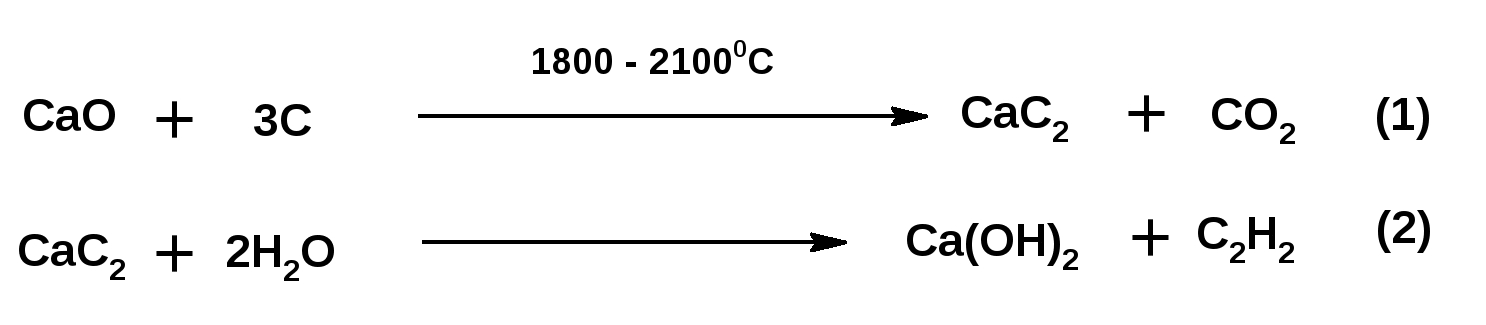 2. Пиролиз этилена и метана Пиролиз этилена и метана при очень высокой температуре ведет к получению ацетилена. В этих условиях ацетилен термодинамически нестабилен, поэтому пиролиз проводят за очень короткие интервалы времени (сотые секунды): 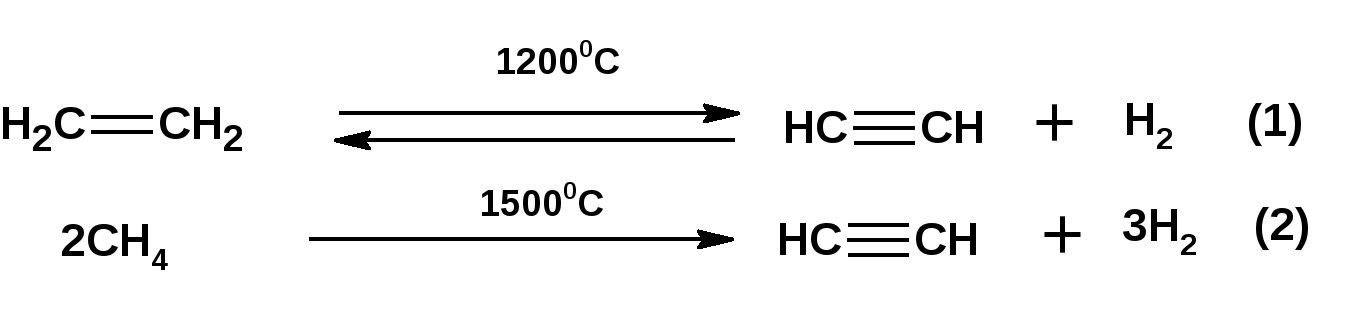 Термодинамическая нестабильность ацетилена (взрывается даже при сжатии) следует из высокого положительного значения теплоты его образования из элементов: Это свойство создает определенные трудности при хранении ацетилена и работе с ним. Для обеспечения безопасности и упрощения работы с ацетиленом используют его свойство легко сжижаться. Сжиженный ацетилен растворяют в ацетоне. Раствор ацетилена в ацетоне хранят в баллонах, наполненных пемзой или активированным углем. Такие условия хранения предотвращают возможности произвольного взрыва. 2.2 Лабораторные методы В лабораторных условиях ацетиленовые углеводороды получают также двумя путями: 1. Алкилирование ацетилена. 2. отщепление галогенводородов от поли (много)галогенпроизводных алканов. Алкилирование рассмотрим далее.Дегидрогалогенирование дигалогенидов и галогеналкенов. Обычно используют геминальные из карбонильных соединений (1) и вицинальные дигалогениды, которые получаются из алкенов (2). Например: 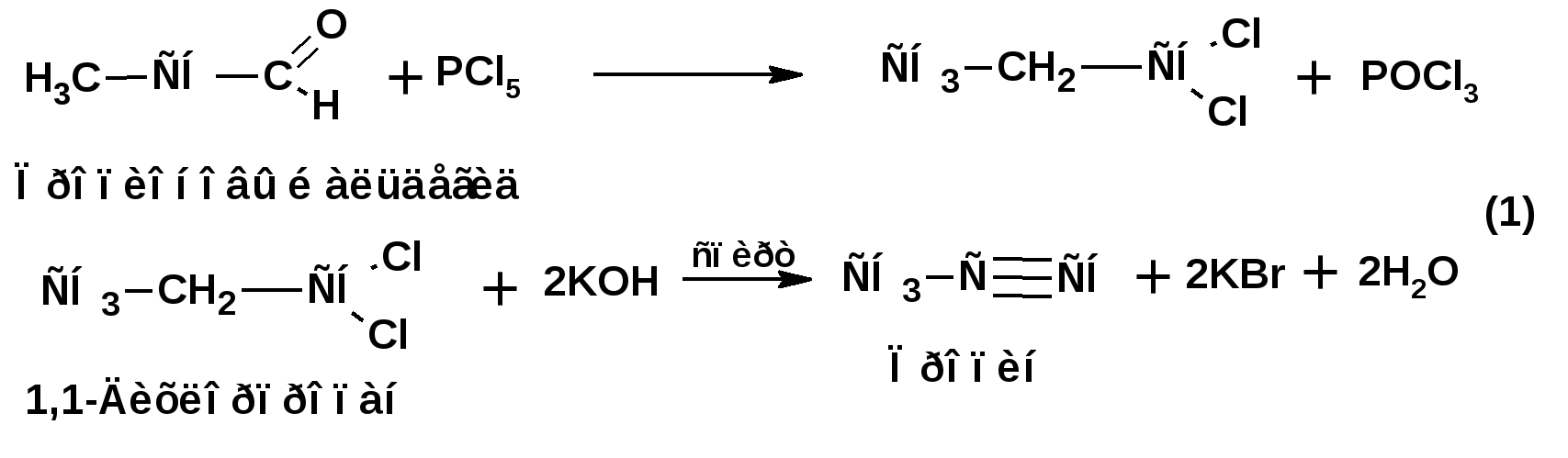 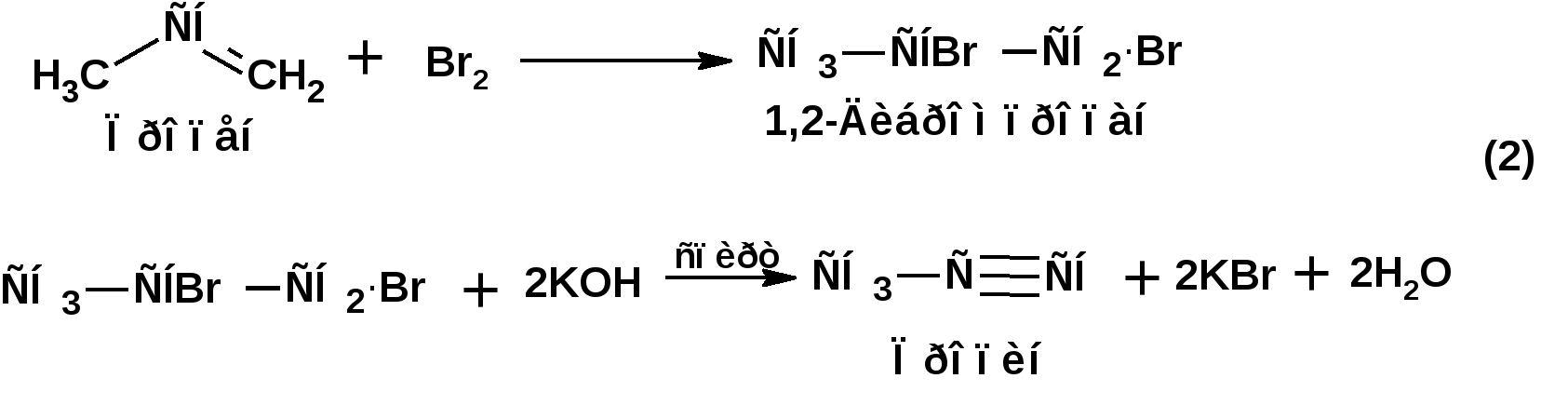 В присутствии спиртовой щелочи реакция дегидрогалогенирования идет в две стадии: При умеренных температурах (70-800С) реакция останавливается на стадии получения винилгалогенида. Если реакция протекает в жестких условиях (150-2000С), то конечным продуктом является алкин. 3. Физические свойства. Физические свойства алкинов соответствуют физическим свойствам алкенов. Следует отметить, что алкины обладают более высокими температурами плавления и кипения. Терминальные алкины имеют более низкие температуры плавления и кипения, чем внутренние. 4. Химические свойства. 4.1. пространственное и электронное строение. В соответствии с состоянием sp-гибридизации молекула ацетилена линейна. 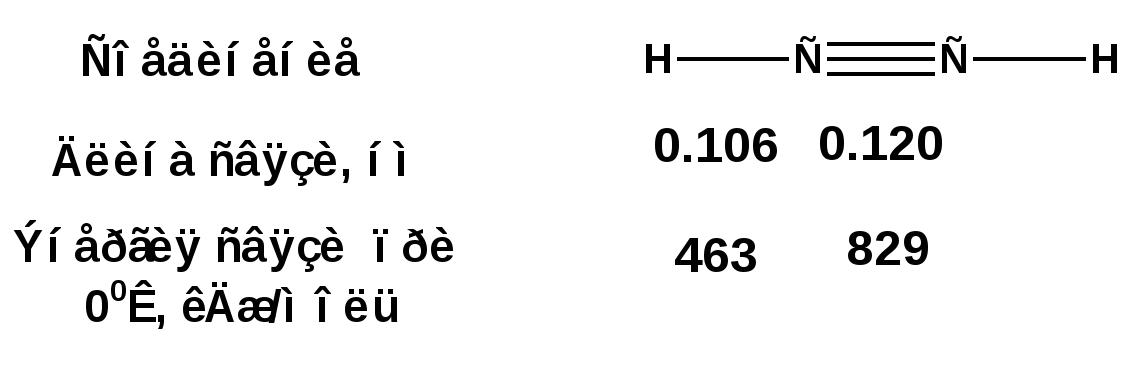 Энергия тройной связи 829 кДж/моль, что больше энергии двойной связи 607.1 кДж/моль, ординарной связи Сsp3–Сsp3 - 349.6 кДж/моль и ординарной связи Сsp3–Сsp2 - 360 кДж/моль. Однако две ординарные связи и одна двойная, а также четыре ординарные связи по энергии превосходят одну тройную связь. Поэтому тройная связь легко переходит в две ординарные и одну двойную связь путем присоединения по месту тройной связи двух атомов или атомных групп. Из этого следует, что для алкинов, также как и для алкенов, наиболее характерны реакции присоединения. Однако то, что атомы углерода, связанные тройной связью, находятся в состоянии sp-гибридизации, придает алкинам определенные особенности в химических свойствах. В первой лекции отмечалось, что с понижением степени гибридизации растет электроотрицательность атома углерода. Наибольшая электроотрицательность атома углерода в состоянии sp-гибридизации приводит к тому, что алкины обладают способностью не только выступать в роли нуклеофила в реакциях электрофильного присоединения (подвергаться атаке электрофильных частиц), но и выступать в роли электрофила (подвергаться атаке нуклеофильных частиц). Т.е. участвовать в реакциях нуклеофильного присоединения. Повышенная электроотрицательность атома углерода в состоянии sp-гибридизации также приводит к тому, что терминальные алкины являются так называемыми С-Н – кислотами (способны к электролитической диссоциации по связи С-Н). В результате ионизации образуется устойчивый карбанион:  Причем алкины являются кислотами более сильными, чем этилен и аммиак, и более слабыми, чем вода:  Причина более высокой кислотности алкинов по сравнению с алкенами заключается в большей устойчивости соответствующего карбаниона. Следствием возможности образования стабильного карбаниона является способность терминальных алкинов участвовать в реакциях замещения. 4.2. Электрофильное присоединение. Галогенирование Электрофильное присоединение (AdE) галогенов: хлора, брома йода к ацетиленам идет с меньшей скоростью, чем к олефинам. При этом образуются транс-дигалогеналкены. Дальнейшее присоединение галогенов идет с еще более низкой скоростью: Например, присоединение брома к этилену с образованием 1,1,2,2-тетрабромэтана в среде уксусной кислоты: 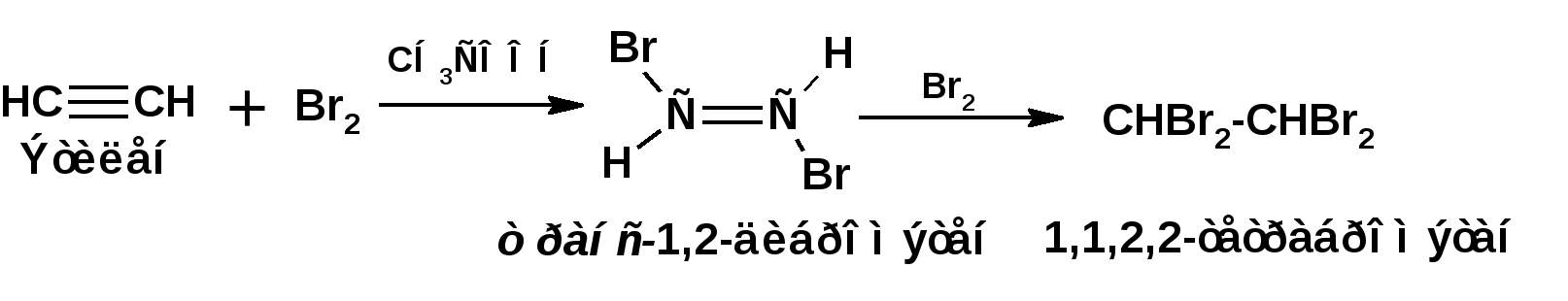 Механизм реакции присоединения брома к ацетилену: 1. Образование π-комплекса: 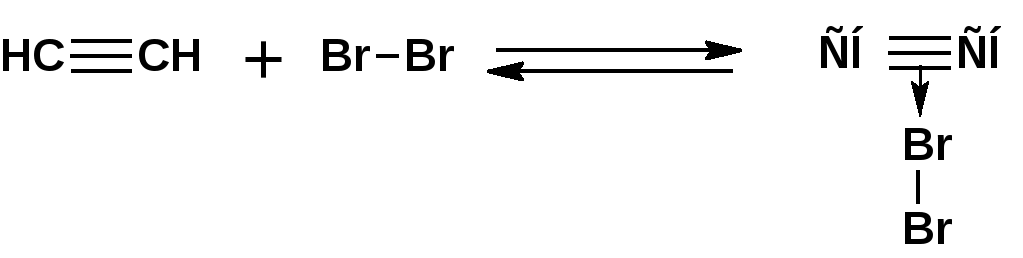 2. Скоростьлимитирующая стадия образования циклического бромирениевого катиона: 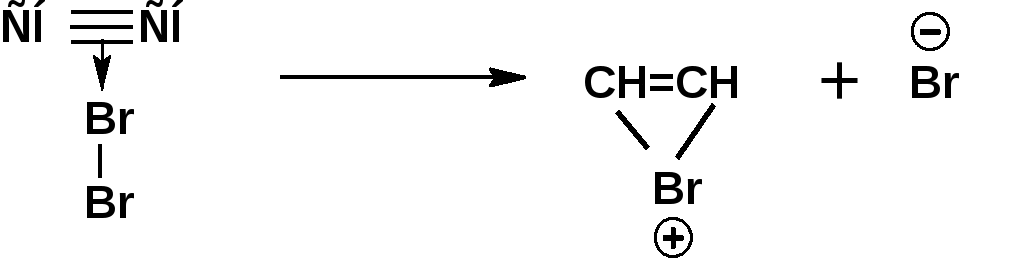 3. Присоединение бромид-иона к циклическому бромирениевому катиону: 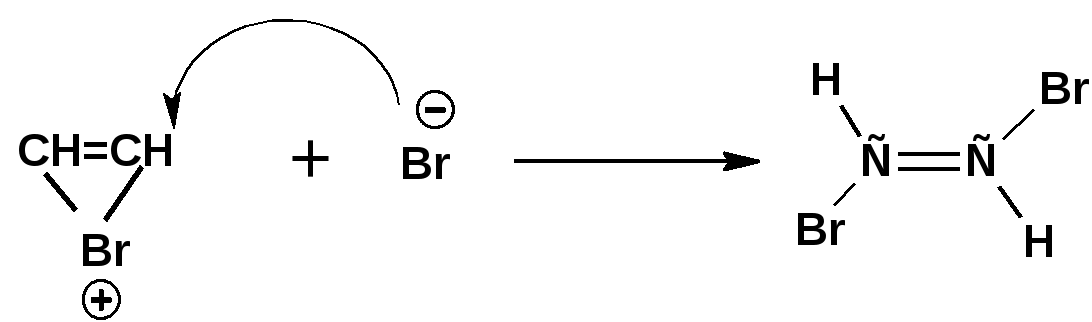 Гидрогалогенирование Алкины реагируют с хлористым водородом и бромистым водородом подобно алкенам. Галогенводороды присоединяются к ацетиленовым углеводородам в две стадии по правилу Марковникова: 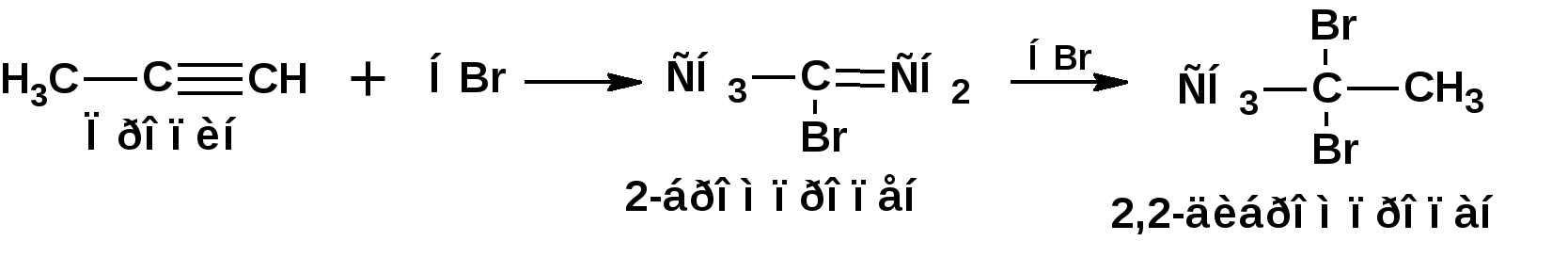 В таких реакциях скорость 100-1000 раз ниже, чем в реакциях с участием алкенов. Соответственно процесс может быть остановлен на стадии монобромида. Введение атома галоида снижает реакционную способность двойной связи. Механизм реакции гидрогалогенирования можно представить схемой: 1. На первой стадии образуется π-комплекс: 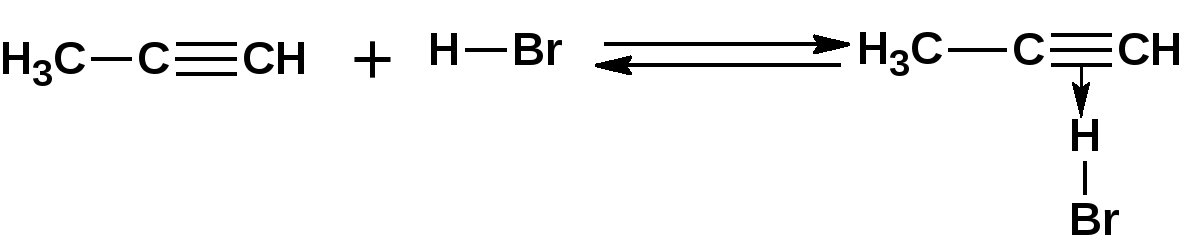 2. Образование промежуточного карбкатиона. Эта стадия является медленной (скоростьлимитирующей): 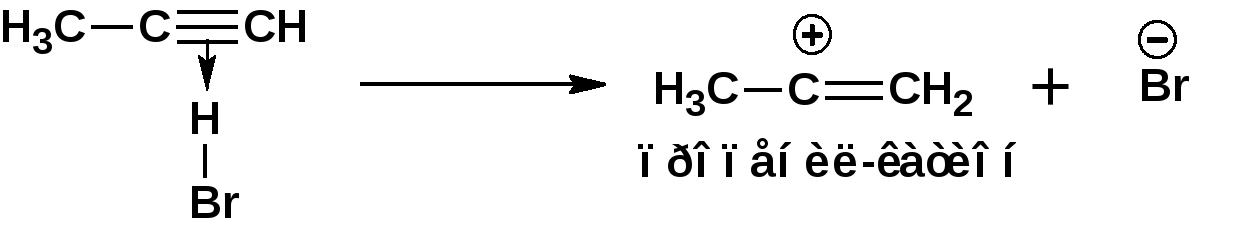 На этой стадии один из атомов углерода двойной связи переходит в состояние sp2-гибридизации. Другой остается в состоянии sp-гибридизации и приобретает вакантную р-орбиталь. 3. На третьей стадии бромид-ион, образовавшийся на второй стадии, быстро присоединяется к карбкатиону: Взаимодействие образовавшегося бромалкена со второй молекулой бромистого водорода идет по обычному для алкенов механизму. В присутствии пероксидов наблюдается перекисный эффект Караша. Реакция идет по радикальному механизму. Вследствие чего бромоводород присоединяется к алкину против правила Марковникова: Гидратация (или реакция Кучерова) Алкины присоединяют воду в присутствии сульфата ртути (II). При этом из ацетилена получается уксусный альдегид: 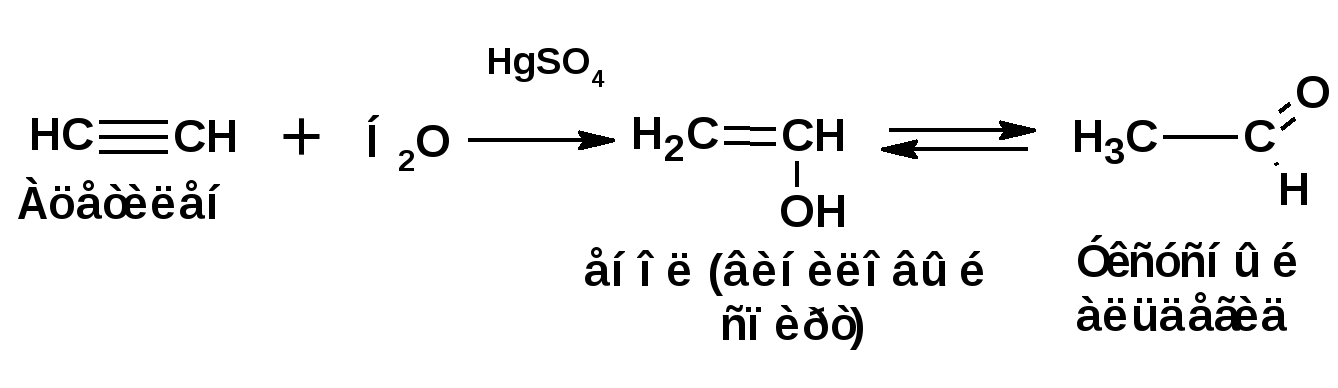 Ненасыщенный радикал СН2=СН- называется винил. Реакция гидратации ацетилена протекает через стадию ненасыщенного винилового спирта или енола, в котором гидроксигруппа связана с атомом углерода в состоянии sp2-гибридизации. По правилу Эльтекова подобная структура является неустойчивой и изомеризуется карбонильное соединение. Енол и карбонильное соединение находятся в равновесии. Взаимопревращение енола и карбонильного соединения является примером так называемой кето-енольной таутомерии или кето-енольного таутомерного равновесия. Участники этого равновесия различаются положением атома водорода и кратной связи. К гомологам ацетилена вода присоединяется по правилу Марковникова. Продуктами гидратации гомологов ацетилена являются кетоны: 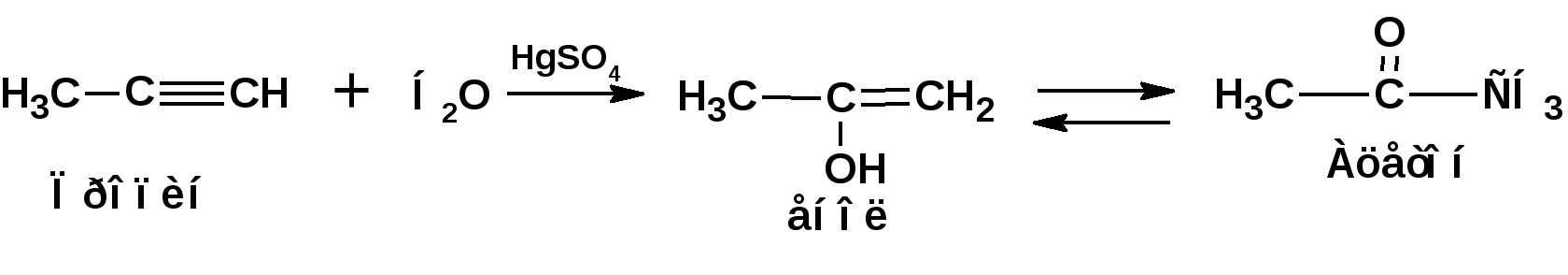 4.3. Нуклеофильное присоединение. В силу более высокой электроотрицательности атома углерода, в состоянии sp-гибридизации, по сравнеению с атомом углерода в состоянии sp2гибридизации, алкины, в отличии от алкенов могут вступать в реакции нуеклеофильного присоединения. Реакциями нуклеофильного присоединения (реакции тип АdN) называют реакции присоединения, в скоростьлимитирующей стадии которых атакующей частицей является нуклеофил. Примером нуклеофильного присоединения является присоединение спиртов к алкинам в присуствии щелочи (реакция Фаворского, 1887г.): 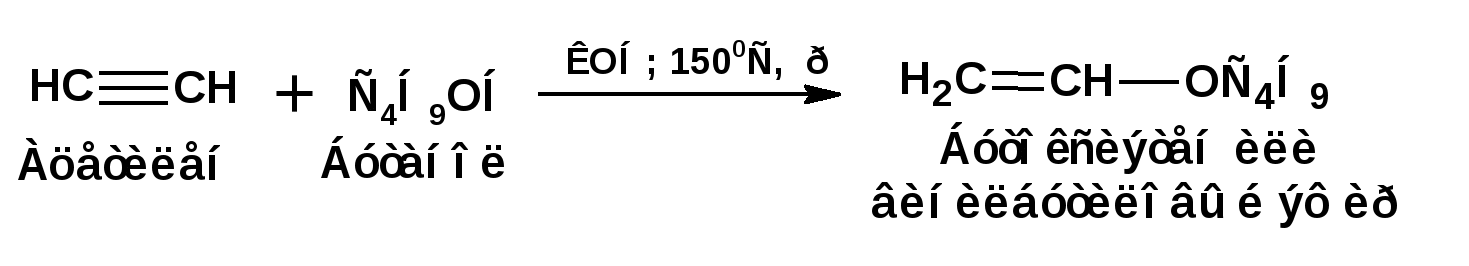 Механизм реакции нуклеофильного присоединения к тройной связи включает следующие стадии: 1. На первой стадии по кислотно-основной реакции образуется алкоголят-анион или алкоксид-ион, являющийся сильным основанием: 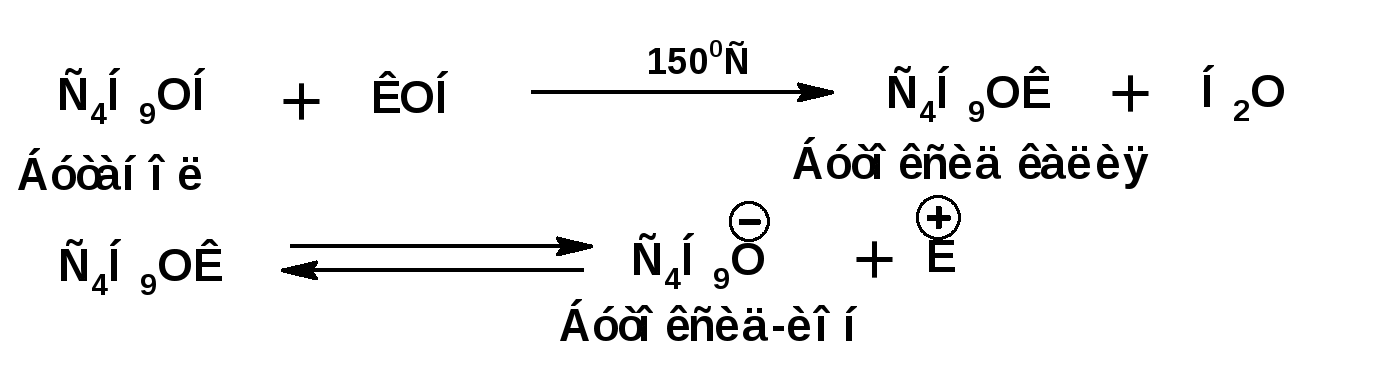 2. На второй стадии алкоксид-ион присоединяется к алкину. Эта стадия является скоростьлимитирующей. Причем, если алкин несимметричный, то присоединение протекает в соответствии с правилом Марковникова, а именно: анион, будучи нуклеофильной частицей, присоединяется к наименее гидрогенизированному атому углерода: 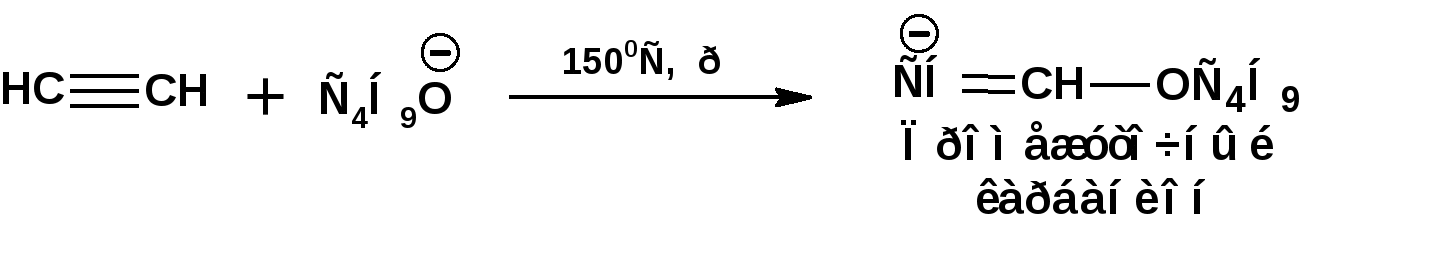 3. На третьей стадии образовавшийся карбанион отщепляет протон от другой молекулы спирта, что приводит к образованию эфира и регенерации алкоголят-аниона: Образовавшийся виниловый эфир может присоединить еще одну молекулу спирта. При этом образуется соединение называемое ацеталем: 4.4. Винилирование. Реакция образование виниловых эфиров из ацетилена и спиртов является примером так называемых реакций вининилирования. К числу этих реакций относятся: 1. Присоединение к ацетилену хлористого водорода:  2. Присоединение к ацетилену синильной кислоты в присутствии солей меди: 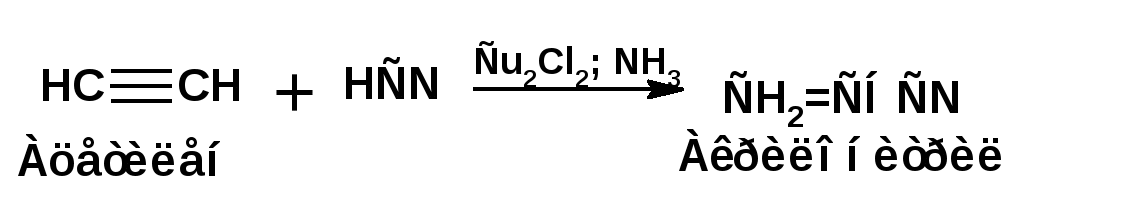 3. Присоединение к ацетилену уксусной кислоты в присутствии фосфорной кислоты: 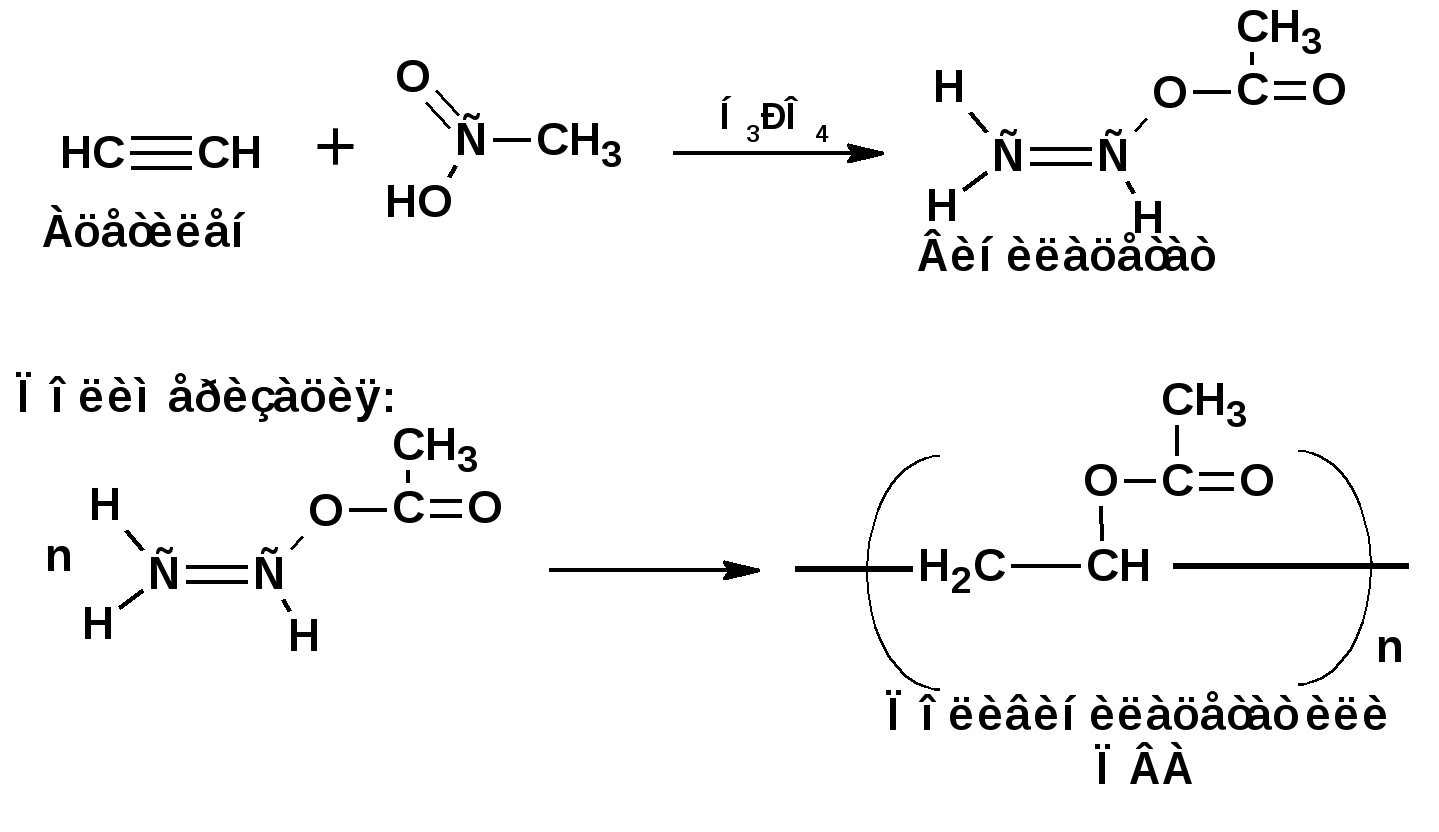 4.5. Гидрирование В условиях гетерогенного катализа алкины присоединяют водород аналогично алкенам: Первая стадия гидрирования более экзотермична (протекает с большим выделением тепла), чем вторая, что обусловлено большим запасом энергии в ацетилене, чем в этилене: 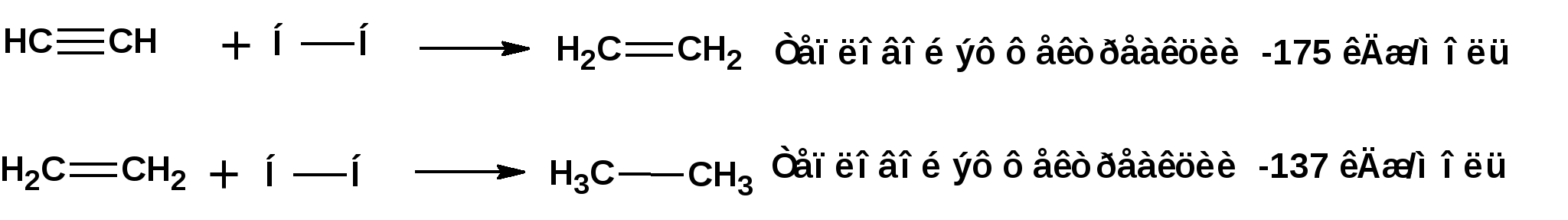 В качестве гетерогенных катализаторов, как и при гидрировании алкенов, используют платину, палладий, никель. Причем гидрирование алкена протекает значительно быстрее, чем гидрирование алкина. Чтобы замедлить процесс гидрирования алкена применяют так назывваемые «отравленные» катализаторы. Замедление скорости гидрирования алкена достигается за счет добавки оксида или ацетата свинца к палладию. Гидрирование на палладие с добавкой солей свинца приводит к образованию цис-олефина. Гидрирование действием металлического натрия в жидком аммиаке приводит к образованию транс-олефина. В качестве гетерогенных катализаторов, как и при гидрировании алкенов, используют платину, палладий, никель. Причем гидрирование алкена протекает значительно быстрее, чем гидрирование алкина. Чтобы замедлить процесс гидрирования алкена применяют так назывваемые «отравленные» катализаторы. Замедление скорости гидрирования алкена достигается за счет добавки оксида или ацетата свинца к палладию. Гидрирование на палладие с добавкой солей свинца приводит к образованию цис-олефина. Гидрирование действием металлического натрия в жидком аммиаке приводит к образованию транс-олефина.4.6. Окисление. Алкины подобно алкенам окисляются по месту тройной связи. Окисление идет в жестких условиях с полным разрывом тройной связи и образованием карбоновых кислот. Аналогично исчерпывающему окислению олефинов. В качестве окислителей применяют перманганат калия при нагревании или озон: 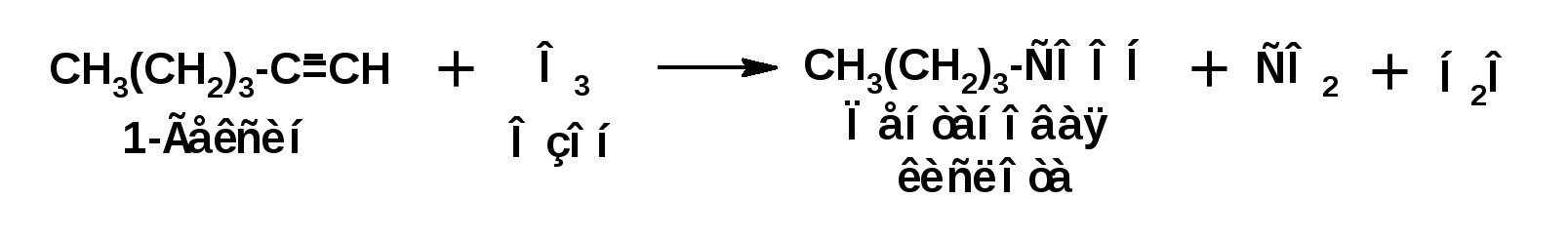 Следует отметить, что при окислении терминальных алкенов и алкинов одним из продуктов окисления является углекислый газ. Его выделение можно наблюдать визуально и тем самым можно отличить терминальные от внутренних ненасыщенных соединений. При окислении последних выделение углекислого газа не будет наблюдаться. 4.7. Полимеризация. Ацетиленовые углеводороды способны к полимеризации в нескольких направлениях: 1. Циклотримеризация ацетиленовых углеводородов, с использованием активированного угля (по Зелинскому) или комплексного катализатора из дикарбонила никеля и фосфорорганического соединения (по Реппе). В частности из ацетилена получается бензол: 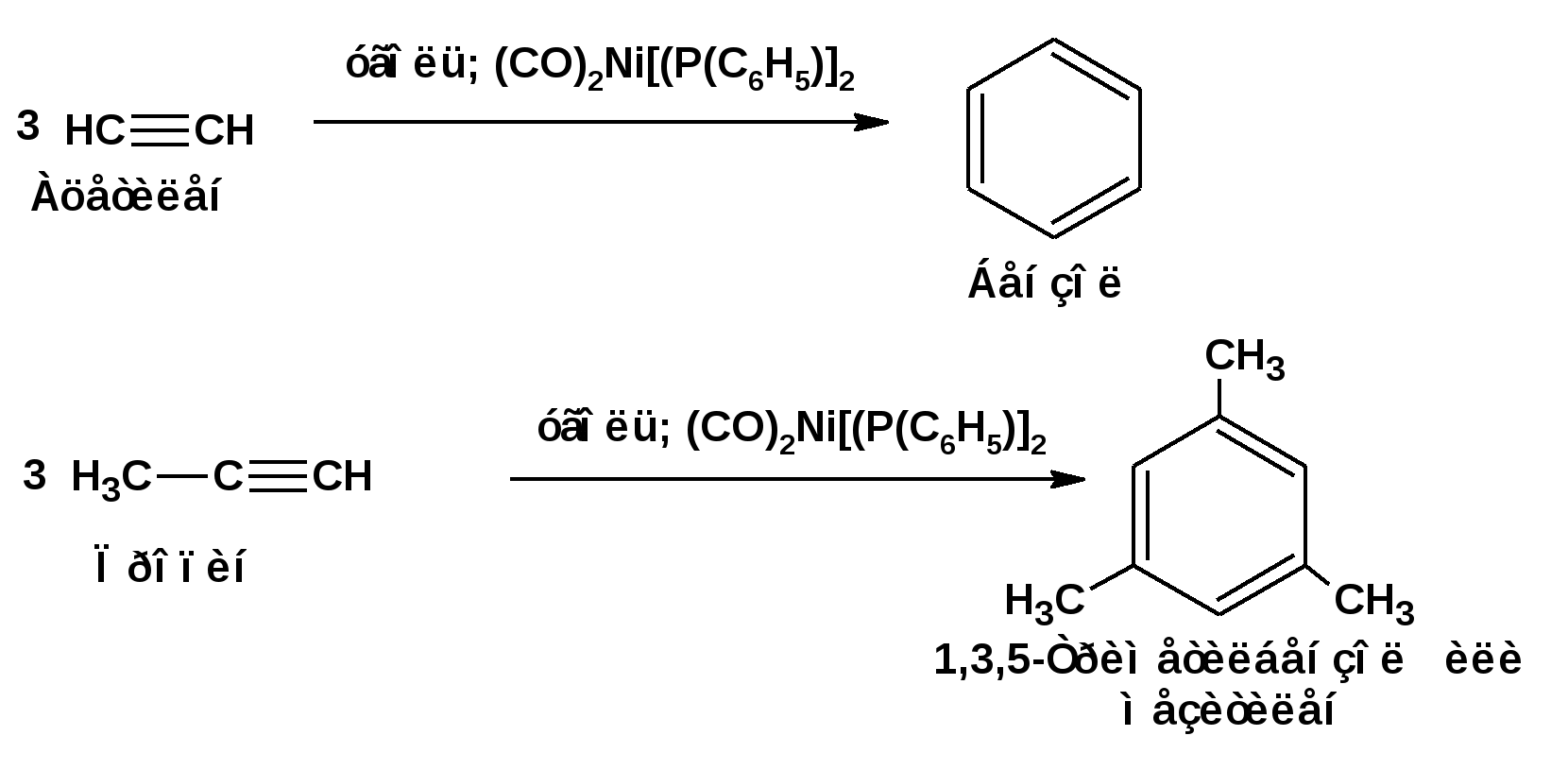 В присутствии цианида никеля ацетилен претерпевает циклотетрамеризацию: 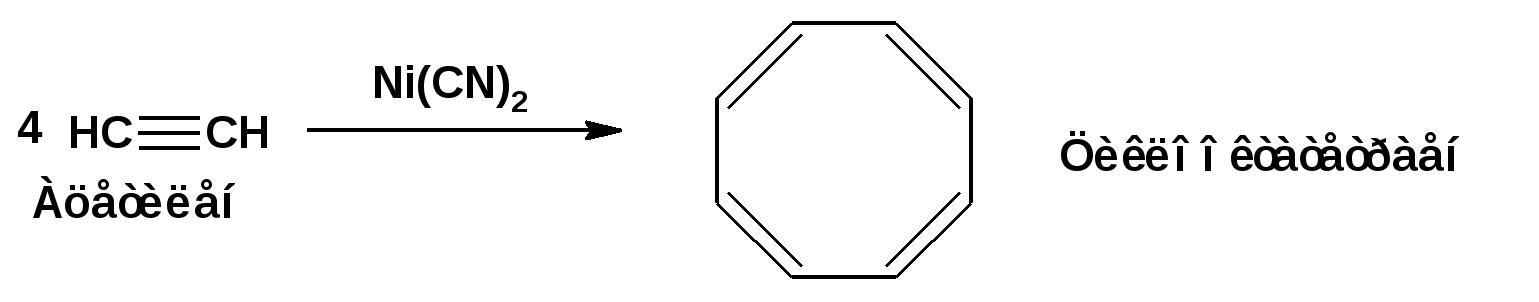 В присутствии солей меди происходит линейная олигомеризация ацетилена с образованием винилацетилена и дивинилацетилена: 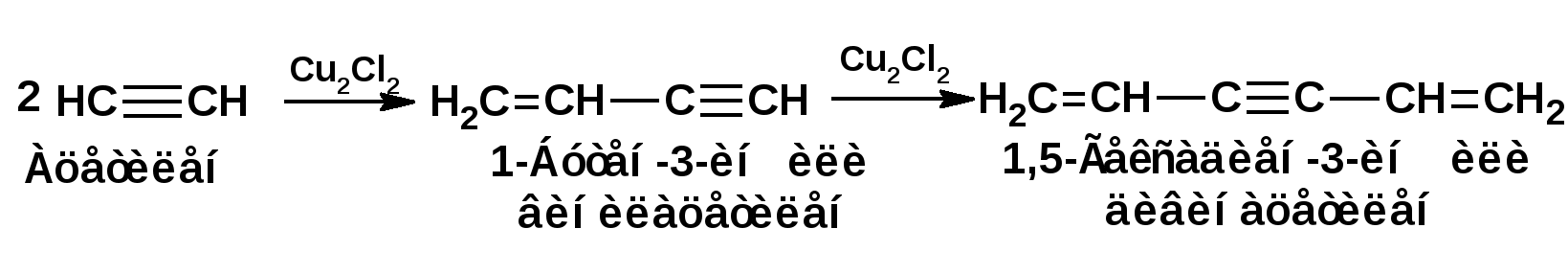 Кроме всего того, алкины способны к полимеризации с образованием сопряженных полиенов: 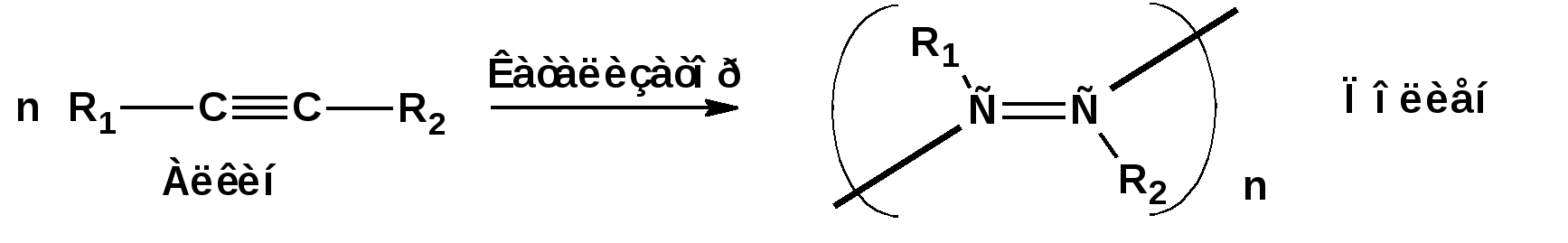 4.8. Реакции замещения. 4.8.1. Металлирование При действии очень сильных оснований алкины, имеющие концевую тройную связь, полностью ионизируются и образуют соли, которые называются ацетиленидами. Ацетилен реагирует как более сильная кислота и вытесняет более слабую кислоту из ее соли: 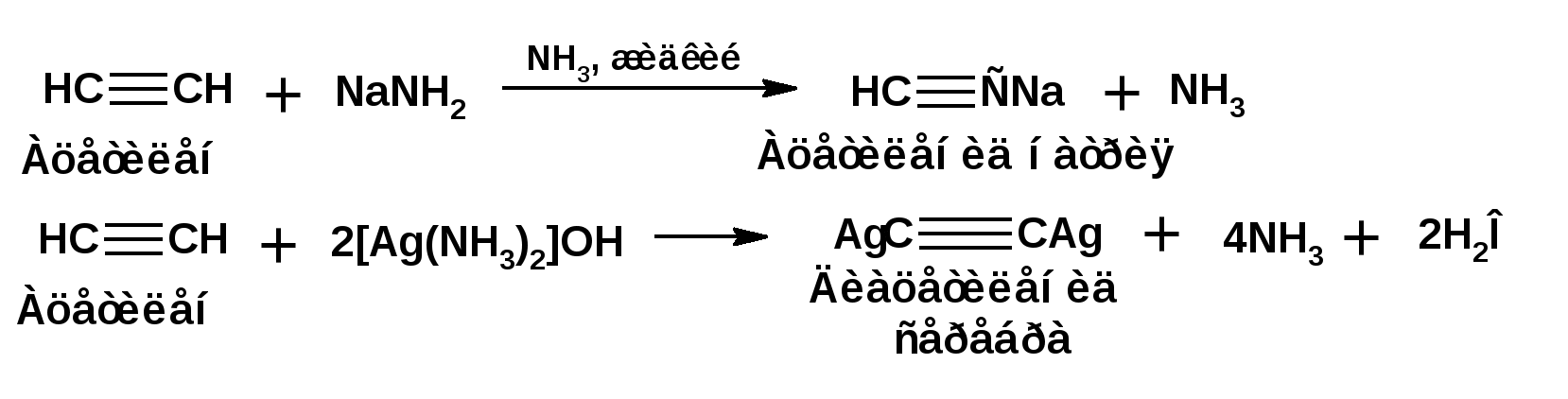 Ацетилениды тяжелых металлов, в частности меди серебра, ртути, являются взрывчатыми веществами. Алкинид-анионы (или ионы), входящие в состав ацетиленидов являются сильными нуклеофилами. Это свойство нашло применение в органическом синтезе для получения гомологов ацетилена с использованием галогеналкилов: 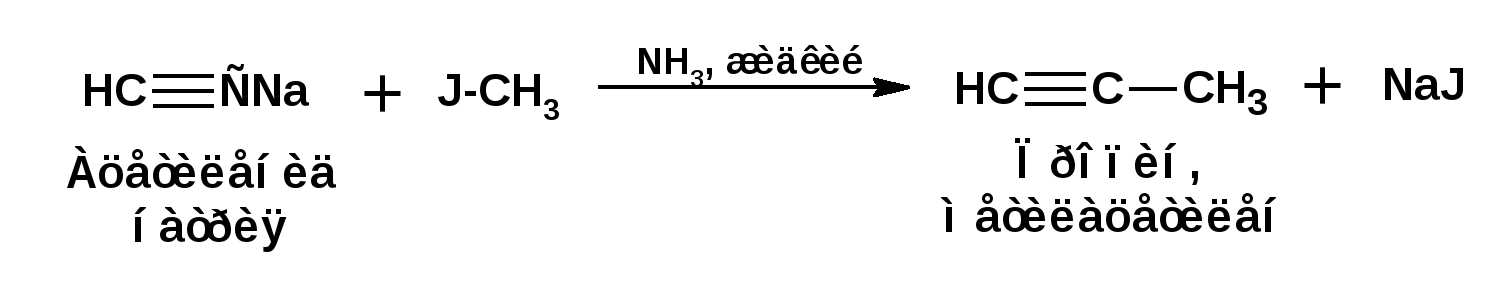 Кроме ацетилена подобное превращение можно провести для других алкинов, имеющих концевую тройную связь. Гомологи ацетилена или терминальных алкинов можно получить другим путем. С использованием так называемого реактива Иоцича. Реактив Иоцича получают из реактива Гриньяра:  Далее проводят реакцию реактива Гриньяра с алкином, имеющим концевую двойную связь.  Полученный реактив Иоцича в среде высокополярных апротонных растворителей или в жидком аммиаке взаимодействует с другим галоидным алкилом: Полученный реактив Иоцича в среде высокополярных апротонных растворителей или в жидком аммиаке взаимодействует с другим галоидным алкилом: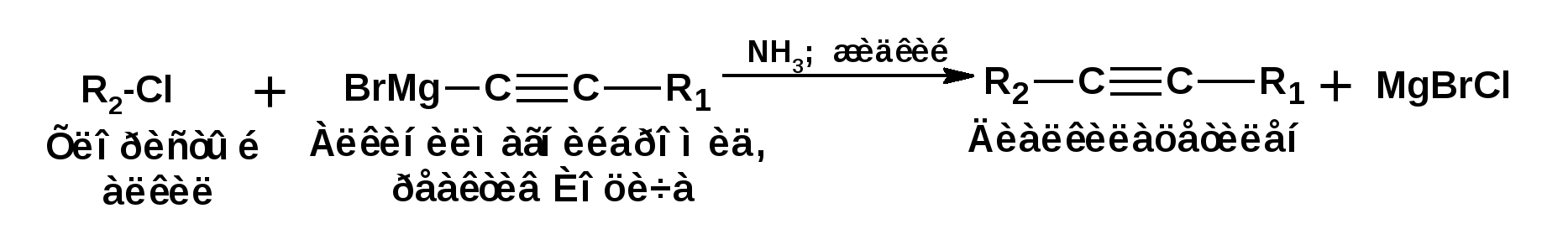 4.8.2. Реакции присоединения к карбонильным соединениям. Реактив Иоцича может взаимодействовать с углекислым газом. При этом образуются карбоновые кислоты ацетиленового ряда: 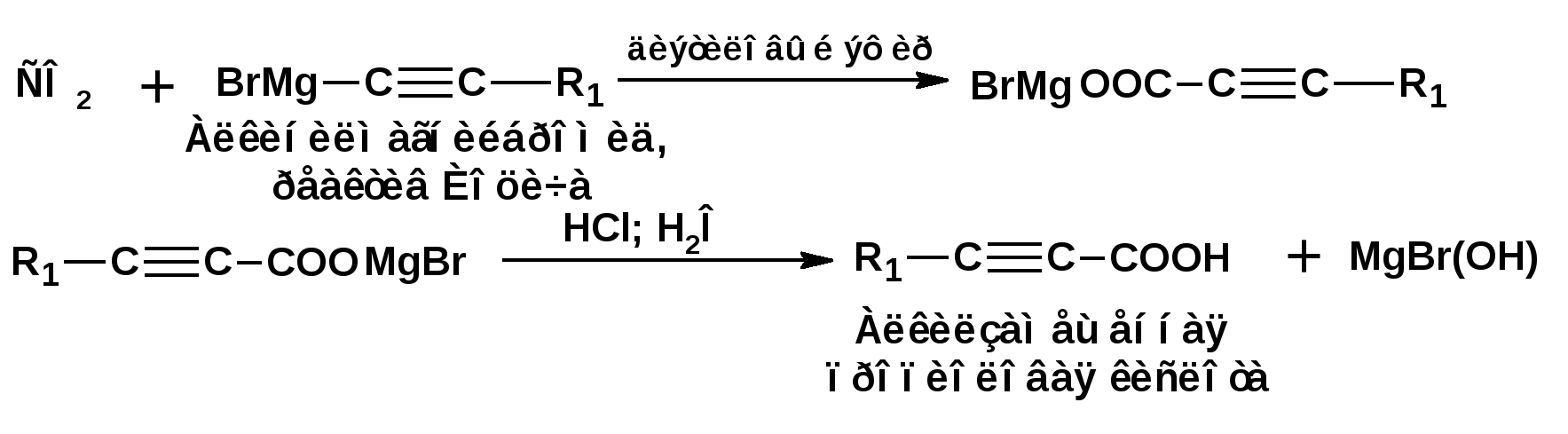 Подобное замещение подсказало А.Е.Фаворскому следующий тип реакций замещения с участием ацетиленовых соединений:  Из диметилэтинилкарбинола можно получить 1,3-диеновый углеводород: Из диметилэтинилкарбинола можно получить 1,3-диеновый углеводород: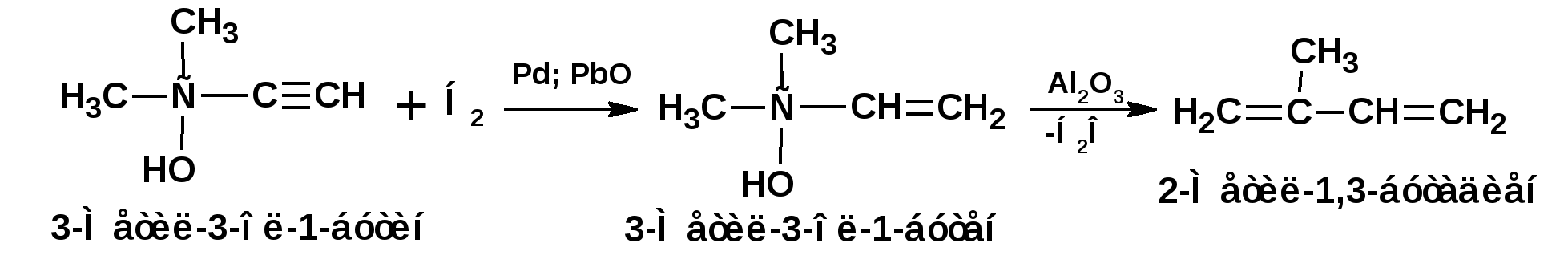 Аналогом реакции Фаворского является реакция Реппе. В этом случае ацетилен взаимодействует с формальдегидом в присутствии ацетиленида меди:  Пропаргиловый спирт может взаимодействовать с еще одной молекулой формальдегида: 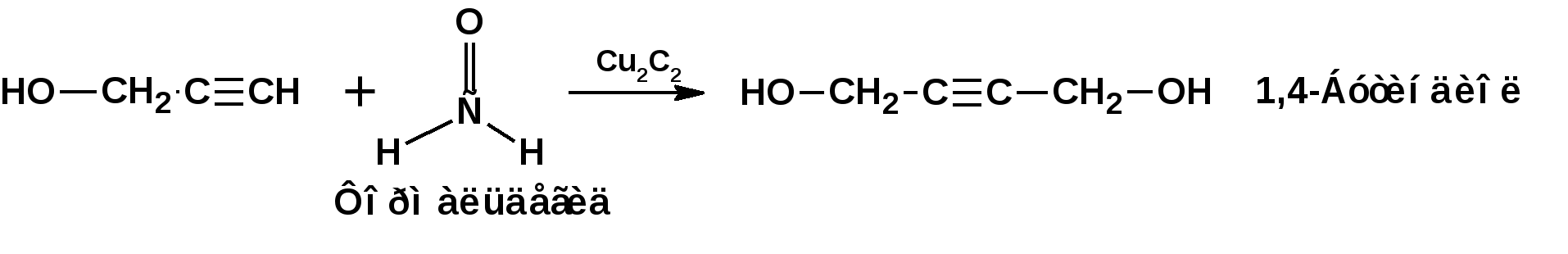 Из 1,4-бутиндиола также можно получить 1,3-диеновый углеводород: 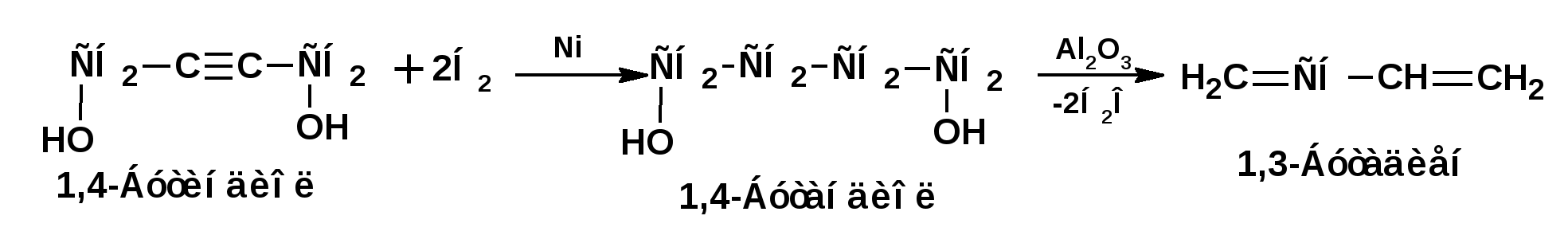 |
