Гидролиз солей (2). 1. уметь определять кислоты, соли и основания Кислоты
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
Гидролиз солей Чтобы определить тип гидролиза солей нужно 1. уметь определять кислоты, соли и основания: Кислоты – на первом месте Н+ , на втором месте кислотные остатки (например, хлорид, сульфат, нитрат, фосфат, нитрит, сульфит и т.д, см. Таблицу растворимости (1 столбик) Основания – на первом месте ион (катион) металла, на втором месте гидроксид-ион ОН- Соли – на первом месте катион металла, на втором месте кислотный остаток !!! положительно заряженный ион – это катион, отрицательно заряженный ион – это анион, поэтому кислотные остатки и гидроксид-ион называем анионами (они так и подписаны в таблице растворимости), а ионы водорода и ионы металлов называем катионами (в таблице растворимости они тоже так названы), то есть катионы – это верхняя строчка, анионы – это первый столбик. 2. знать сильные и слабые кислоты, сильные и слабые основания, я вам табличку давала, здесь дублирую 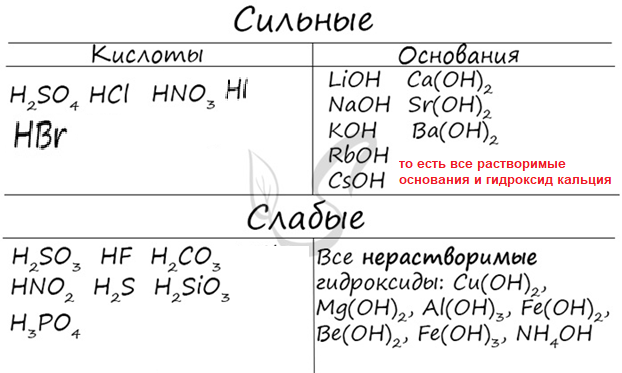 3. Пользоваться правилом ВОДА – РАЗРУШАЕТ ВСЕ СЛАБОЕ!!!! Если соль образована сильным основанием и слабой кислотой – гидролиз идет по аниону Если соль образована слабым основанием и сильной кислотой – гидролиз идет по катиону Если соль образована слабым основанием и слабой кислотой – гидролиз идет по аниону и по катиону Если соль образована сильным основанием и сильной кислотой – гидролиз не идет (вода разрушает все слабое, а здесь все сильное) ЭТО МОЖНО КОРОЧЕ ПРЕДСТАВИТЬ В ТАБЛИЦЕ
НЕРАСТВОРИМЫЕ СОЛИ НЕ ДИССОЦИИРУЮТ, ИХ МЫ ОПРЕДЕЛЯЕМ ПО ТАБЛИЦЕ РАСТВОРИМОСТИ, ЗНАЧЕК «Н» Рассмотрим, как это работает Са2СОз – соль не растворяется, значит нет диссоциации… в таблице показано, что соль образована катионом кальция и карбонат-ионом, на пересечении видим значек «Н», значит не растворяется и не диссоциирует  ТЕПЕРЬ РАССМОТРИМ ДОМАШНИЕ ПРИМЕРЫ  Это уравнение составлено правильно, но его не уравняли. Определяем, что здесь будет солью  На первом месте катион натрия (металл), на втором месте нитрат-ион (анион кислотного остатка) Эта соль образована сильным основанием и сильной кислотой (это мы определяем по таблице)       ВСЕ СИЛЬНОЕ, А ВОДА РАЗРУШАЕТ СЛАБОЕ, ЗНАЧИТ В ЭТОМ СЛУЧАЕ ГИДРОЛИЗ НЕ ИДЕТ! Еще один пример, реакция записана правильно, но ее тоже не уравняли   Эта соль образована сильным основанием и слабой кислотой, 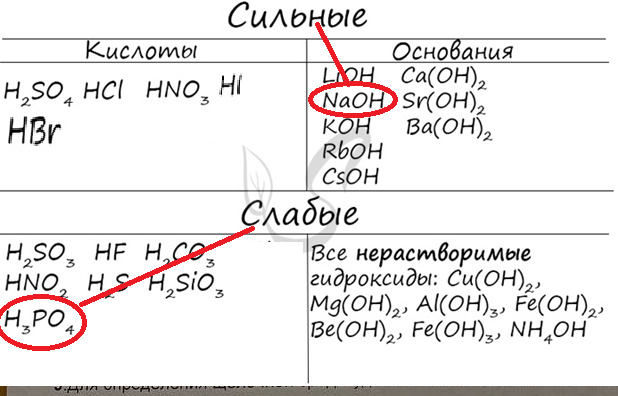 вода разрушает все слабое, значит гидролиз идет по аниону (кислотному остатку)  Теперь, используя все таблицы, выполните тренировочные упражнения по алгоритму Запишите реакцию и ее уравняйте. Определите, что будет солью, и будет ли эта соль растворимой. Определите, сильными или слабыми кислотами она образована Определите, идет или не идет гидролиз, если идет, то по катиону или аниону Оксид кальция и фосфорная кислота Гидроксид бария и фосфорная кислота Оксид лития и серная кислота Гидроксид меди (II) и серная кислота Еще один пример, как образец для оформления Соляная кислота + нитрат серебра =  HCl + AgNO3 = AgCl + HNO3, солью является нитрат серебра, он не растворяется, значит нет гидролиза HCl + AgNO3 = AgCl + HNO3, солью является нитрат серебра, он не растворяется, значит нет гидролизаСоляная кислота + гидроксид меди = 2HCl+ Cu(OH)2=CuCl2+2H2O, солью является хлорид меди, он образован сильной кислотой и слабым основанием, значит гидролиз идет по катиону |
