гидролиз отчет. ГИДРОЛИЗ. Исследование гидролиза солей
 Скачать 48.48 Kb. Скачать 48.48 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ С  АНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии Отчёт по лабораторной работе №3 «ИССЛЕДОВАНИЕ ГИДРОЛИЗА СОЛЕЙ» Выполнил: студент гр. РМ-22 __________ /Мялина А.А./ (подпись) (Ф.И.О.) Проверил: __________ / / (подпись) (Ф.И.О.) Санкт-Петербург 2022 год Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза. Общие сведения Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты и сульфаты щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей: Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты: А + Н2О = НА + ОН, в растворе появляются ионы ОН, поэтому среда – щелочная, рН > 7. Например, Na2CO3 образован сильным основанием NaOH и слабой угольной кислотой H2CO3. Диссоциация карбоната натрия описывается уравнением: 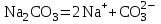 . .С водой взаимодействует карбонат-ион по реакции: 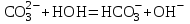 . .Распределяя катионы натрия по образующимся в ходе гидролиза анионам, получим молекулярное уравнение гидролиза: Na2CO3 + H2O = NaHCO3 + NaOH. Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания: М+ + Н2О МОН + Н+, в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Например, FeSO4 образован слабым основанием Fe(OH)2 и сильной кислотой H2SO4. Сульфат железа (II) диссоциирует по реакции: 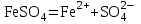 . .С водой реагирует остаток слабого основания – катион Fe2+: Fe2+ + HOH FeOH+ + H+. Так как в ходе гидролиза образуются ионы H+, то среда в растворе FeSO4 будет кислой. Молекулярное уравнение гидролиза: 2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4. Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов. Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть ограничивается взаимодействием иона только с одной молекулой воды. Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону: М+ + А + Н2О = МОН + НА. Например, ацетат натрия CH3COONa образован слабым основанием NH4OH и слабой кислотой CH3COOH, соответственно с водой взаимодействует и катион аммония и ацетат-ион: 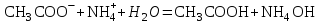 Молекулярная форма реакции: CH3COONH4 + H2O = CH3COOH + NH4OH Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная. Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Пример необратимого, полного гидролиза: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S. Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье. Чем слабее кислота или основание, образующиеся в результате гидролиза, тем выше глубина протекания процесса. С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает. Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора. Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи. При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза. Оборудование и реактивы В лаборатории: спиртовка – 1 шт., песчаная баня – 1 шт. В штативе: хлорид железа (III), сульфат цинка, сульфат алюминия, сульфат хрома (III), сульфат магния, карбонат натрия, ацетат натрия – растворы концентрацией 5 %; лакмус – раствор концентрацией 1 %. В вытяжном шкафу: соляная кислота – раствор концентрацией 15 %, сульфид натрия – раствор концентрацией 5 %. Получать в лаборантской: пробирки – 5 шт.; хлорид сурьмы (III), сульфит натрия – растворы концентрацией 5 %; хлорид олова (II) – кристаллический; цинк металлический; универсальная индикаторная бумага, фенолфталеин. Выполнение работы Опыт 1. Гидролиз солей.Б
Уравнения гидролиза: 2ZnSO4 + 2H2O  (ZnOH)2SO4 + H2SO4 (ZnOH)2SO4 + H2SO4Zn2+ + H2O  ZnOH+ + H+ ZnOH+ + H+Al2(SO4)3+ 2H2O  2AlOHSO4 + H2SO4 2AlOHSO4 + H2SO4Al3++ H2O  AlOH2+ + H+ AlOH2+ + H+Na2CO3+ H2O  NaHCO3 + NaOH NaHCO3 + NaOHCO32- + H2O  HCO3- + OH- HCO3- + OH-Na2S + H2O  NaHS + NaOH NaHS + NaOHS2- + H2O  HS- + OH- HS- + OH-(CH3COO)2Pb + H2O  (CH3COO)PbOH + CH3COOH (CH3COO)PbOH + CH3COOHPb2++ H2O  PbOH+ + H+ PbOH+ + H+Опыт 2. Образование основных и кислых солей при гидролизе. Б) Na2SO3+ H2O  NaHSO3 + NaOH NaHSO3 + NaOHNa++SO32- + H2O  2Na++HSO3- +OH- 2Na++HSO3- +OH-Универсальный индикатор окрашивается в зеленый. Примерный рН среды = 8-9. Это указывает на присутствие в растворе ионов ОН-, образовавшихся в результате гидролиза соли. Опыт 3. Факторы, влияющие на степень гидролиза солей. А. Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза.
Уравнения гидролиза: Na2SO3+ H2O  NaHSO3 + NaOH NaHSO3 + NaOHSO32- + H2O  HSO3- + OH- HSO3- + OH-Na2CO3+ H2O  NaHCO3 + NaOH NaHCO3 + NaOHCO32- + H2O  HCO3- + OH- HCO3- + OH-(CH3COO)Na + H2O  CH3COOH + NaOH CH3COOH + NaOHCH3COO-+ H2O  CH3COOH+ + OH- CH3COOH+ + OH- Al2(SO4)3+ 2H2O  2AlOHSO4 + H2SO4 2AlOHSO4 + H2SO4Al3++ H2O М AlOH2+ + H+ 2MgSO4+2H2O  (MgOH)2SO4+H2SO4 (MgOH)2SO4+H2SO4Mg2+ + H2O  MgOH+ + H+ MgOH+ + H+а) При гидролизе по аниону концентрация ионов ОН– более высокая в растворе соли Na2CO3 б) Концентрация ионов Н+ выше в растворе соли Al2(SO4)3 В. Влияние разбавления раствора на степень гидролиза соли а) SbCl3 + H2O → SbOCl↓ + 2HCl Sb3+ + H2O + Cl- → SbOCl↓ + 2H+ Наблюдается выпадение белого осадка б) SbOCl + 2HCl → SbCl3 + H2O SbOCl + 2H+ → Sb3+ + H2O Наблюдается растворение белого осадка Опыт 4. Растворение металлов в продуктах гидролиза солей. Al2(SO4)3+ 2H2O  2AlOHSO4 + H2SO4 2AlOHSO4 + H2SO4Al3++ H2O  AlOH2+ + H+ AlOH2+ + H+H2SO4 + Zn → ZnSO4 + H2↑ Наблюдается выделение бесцветного газа Опыт 5. Взаимное усиление гидролиза при взаимодействии растворов двух солей. А) Уравнения гидролиза: Na2CO3+ H2O  NaHCO3 + NaOH NaHCO3 + NaOHCO32- + H2O  HCO3- + OH- HCO3- + OH-FeCl3 + H2O  FeOHCl2 + HCl FeOHCl2 + HClFe3+ + H2O  FeOH2+ + H+ FeOH2+ + H+Fe2(CO3)3 + 3H2O  2Fe(OH)3 + 3CO2↑ 2Fe(OH)3 + 3CO2↑Уравнения реакций: 2FeCl3 + 3Na2CO3 + 3H2O → 6NaCl + 3CO2↑ + 2Fe(OH)3↓ Наблюдается выделение бесцветного газа без запаха, выпадение бурого осадка, растворение бурого осадка. Б) Реактивы: CuSO4, Na2CO3 Уравнения гидролиза: Na2CO3+ H2O  NaHCO3 + NaOH NaHCO3 + NaOHCO32- + H2O  HCO3- + OH- HCO3- + OH-2CuSO4 + H2O  (CuOH)2SO4 + H2SO4 (CuOH)2SO4 + H2SO4Cu2++H2O  CuOH++H+ CuOH++H+Уравнения реакций: 2Na2CO3 + 2CuSO4 + 2H2O → (CuOH)2CO3 + CO2↑ + 2Na2SO4 Cu2+ + CO32- + 2OH- → (CuOH)2CO3 + CO2↑ Наблюдаемые выпадение голубого осадка, выделение бесцветного газа без запаха. Вывод: в ходе первой части опыта были определены pH различных растворов солей. Была установлена интенсивность окраски фенолфталеина, исходя из которой можно сделать заключение, что она растет по мере повышения щелочности раствора. В ходе второй части опыта были также определены pH двух растворов солей и установлен цвет лакмуса в каждом из них, исходя из которого можно сделать заключение, что лакмус изменял цвет по мере роста кислотности раствора. Были составлены уравнения гидролизов данных солей. |
