1 вариант. 1блок в основе иммунохимических методов лежит взаимодействие ат с аг (в)
 Скачать 166.82 Kb. Скачать 166.82 Kb.
|
|
1 вариант. 1блок
2блок Антигены – это высокомолекулярные соединения. При попадании в организм вызывают иммунную реакцию и взаимодействуют с продуктами этой реакции. Классификация антигенов. 1. По происхождению: 1) естественные (белки, углеводы, нуклеиновые кислоты, бактериальные экзо– и эндотоксины, антигены клеток тканей и крови); 2) искусственные (динитрофенилированные белки и углеводы); 3) синтетические (синтезированные полиаминокислоты). 2. По химической природе: 1) белки (гормоны, ферменты и др.); 2) углеводы (декстран); 3) нуклеиновые кислоты (ДНК, РНК); 4) конъюгированные антигены; 5) полипептиды (полимеры a-аминокислот); 6) липиды (холестерин, лецитин). 3. По генетическому отношению: 1) аутоантигены (из тканей собственного организма); 2) изоантигены (от генетически идентичного донора); 3) аллоантигены (от неродственного донора того же вида); 4) ксеноантигены (от донора другого вида). 4. По характеру иммунного ответа: 1) тимусзависимые антигены; 2) тимуснезависимые антигены. Выделяют также: 1) внешние антигены (попадают в организм извне); 2) внутренние антигены; возникают из поврежденных молекул организма, которые распознаются как чужие; 3) скрытые антигены – определенные антигены (например, нервная ткань, белки хрусталика и сперматозоиды); анатомически отделены от иммунной системы гистогематическими барьерами в процессе эмбриогенез. Гаптены – низкомолекулярные вещества, которые в обычных условиях не вызывают иммунной реакции, но при связывании с высокомолекулярными молекулами приобретают иммуногенность. Инфекционные антигены – это антигены бактерий, вирусов, грибов, простейших. Разновидности бактериальных антигенов: 1) группоспецифические; 2) видоспецифические; 3) типоспецифические. По локализации в бактериальной клетке различают: 1) О – АГ – полисахарид (входит в состав клеточной стенки бактерий); 2) липид А – гетеродимер; содержит глюкозамин и жирные кислоты; 3) Н – АГ; входит в состав бактериальных жгутиков; 4) К – АГ – гетерогенная группа поверхностных, капсульных антигенов бактерий; 5) токсины, нуклеопротеины, рибосомы и ферменты бактерий. 2 вариант 1блок
2 блок строение и функции основных классов иммуноглобулинов Антитела (иммуноглобулины) – это белки, которые синтезируются под влиянием антигена и специфически с ним реагируют. Они состоят из полипептидных цепей. В молекуле иммуноглобулина различают четыре структуры: 1) первичную – это последовательность определенных аминокислот. Она строится из нуклеотидных триплетов, генетически детерминируется и определяет основные последующие структурные особенности; 2) вторичную (определяется конформацией полипептидных цепей); 3) третичную (определяет характер расположения отдельных участков цепи, создающих пространственную картину); 4) четвертичную. Из четырех полипептидных цепей возникает биологически активный комплекс. Цепи попарно имеют одинаковую структуру. Большинство молекул иммуноглобулинов составлено из двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными связями. Легкие цепи состоят или из двух k-цепей, или из двух l-цепей. Тяжелые цепи могут быть одного из пяти классов (IgA, IgG, IgM, IgD и IgE). Каждая цепь имеет два участка: 1) постоянный. Остается постоянным в последовательности аминокислот и антигенности в пределах данного класса иммуноглобулинов; 2) вариабельный. Характеризуется большой непостоянностью последовательности аминокислот; в этой части цепи происходит реакция соединения с антигеном. Каждая молекула IgG состоит из двух соединенных цепей, концы которых формируют два антигенсвязывающих участка. На вариабельном участке каждой цепи имеются гипервариабельные участки: три в легких цепях и четыре в тяжелых. Разновидности последовательности аминокислот в этих гипервариабельных участках определяют специфичность антитела. При определенных условиях эти гипервариабельные области могут также выступать в роли антигенов (идиотипов). В молекуле иммуноглобулина меньше двух антигенсвязывающих центров быть не может, но один может быть завернут внутрь молекулы – это неполное антитело. Оно блокирует антиген, и тот не может связаться с полными антителами. При энзиматическом расщеплении иммуноглобулинов образуются следующие фрагменты: 1) Fc-фрагмент содержит участки обеих постоянных частей; не обладает свойством антитела, но имеет сродство с комплементом; 2) Fab-фрагмент содержит легкую и часть тяжелой цепи с одним антигенсвязывающим участком; обладает свойством антитела; 3) F(ab)Т2-фрагмент состоит из двух связанных между собой Fab-фрагментов. Другие классы иммуноглобулинов имеют такую же основную структуру. Исключение – IgM: является пентамером (состоит из пяти основных единиц, связанных в области Fc-концов), а IgA – димер. Существует пять классов иммуноглобулинов у человека. 1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент. Свойства иммуноглобулинов G: 1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях; 2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных; 3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации. 2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2. Свойства иммуноглобулинов М: 1) не проникают через плаценту; 2) появляются у плода и участвуют в антиинфекционной защите; 3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент; 4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза; 5) образуются на ранних сроках инфекционного процесса; 6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий. 3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов. Свойства иммуноглобулинов А: 1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче; 2) участвуют в местном иммунитете; 3) препятствуют прикреплению бактерий к слизистой; 4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент. 4. Иммуноглобулины Е – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов. Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа. 5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. Свойства иммуноглобулинов D: 1) участвуют в развитии местного иммунитета; 2) обладают антивирусной активностью; 3) активируют комплемент (в редких случаях); 4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа; 5) участвуют в аутоиммунных процессах. 3 вариант 1 блок
2 блок этапы дифференцировки т-лимфоцитов.интрогенность т-лимфоцитов?? Стволовая гемопоэтическая клетка, мигрирующая в тимус, превращается (дифференцируется) под влиянием тимического микроокружения в Т-лимфоцит. Цель дифференцировки:
Вначале стволовая гемопоэтическая клетка попадает в корковую зону тимуса и превращается в ранний предшественник Т-лимфоцита. Фенотип этой клетки следующий: ТАГРР-альфа, бета +, CD3+ CD4-, CD8-, т. е. характеризуется наличием Т-клеточного распознающего рецептора, в составе которого имеются альфа- и бета-цепи, CD3 структура, но отсутствуют молекулы CD4 и CD8. Далее, здесь же в корковой зоне тимуса, под влиянием тимического микроокружения, гормонов тимуса и, особенно, ИЛ-7 ранний предшественник Т-лимфоцита превращается в незрелый Т-лимфоцит, фенотип которого следующий: ТАГРР-альфа, бета +, CD3+, CD4+, CD8+. Набор таких мембранных структур говорит о том, что данная клетка способна: 1) распознать любой антиген с помощью ТАГРР-альфа, бета; 2) после распознавания передать сигнал внутрь клетки для ее активации с помощью CD3 структуры: 3) превратиться как в CD4+ (хелпер), так и в CD8+ (киллер) клетки при развитии эффекторного звена иммунного ответа. На следующем этапе дифференцировки незрелый предшественник Т-лимфоцита переходит в мозговое вещество тимуса, где завершается тимический этап созревания. При этом происходят два важнейших события: 1) индуцируется толерантность к аутоантигенам; таким образом, минимизируется возможность развития аутоиммунного заболевания; 2) происходит разделение Т-лимфоцитов на две субпопуляции: CD4+CD8- (хелперы) и CD4-CD8+ (киллеры) (не нужно за-бывать, что на их мембране сохраняются молекулы ТАГРР-альфа, бета и CD3). Этот этап также реализуется при важном участии ИЛ-7. Покидая тимус, зрелые покоящиеся Т-лимфоциты, которые находятся в G(O) стадии клеточного цикла, расселяются в Т-зоны периферических лимфоидных органов. Такие Т-лимфоциты характеризуется следующими свойствами:
Часть Т-лимфоцитов, покидающих тимус, все же способна распознавать аутоантигены, однако такие Т-лимфоциты (и В-лимфоциты) либо подвергаются делении (разрушению) в периферических органах, либо находятся в состоянии анергии (неспособности к активации и реализации эфферентной части иммунного ответа). Т-лимфоциты-хелперы (CD4+ клетки) представлены тремя субпопуляциями: т. н. нулевыми Т-хелперами (Тх0), которые дифференцируются в Т-хелперы 1-го типа (Tx1) и 2-го типа (Тх2). В этой дифференцировке основную роль играют ИЛ-12, ИЛ-2, гамма-интерферон, ИЛ-10, ИЛ-4, ИЛ-5. Т-лимфоциты-хелперы (CD4+ клетки) участвует в распознавании атигенногопептида , который презентируется с помощью молекул ГКГ класса П. В этом случае для активации Т-лимфоцита необходим дополнительный, костимуляционный, сигнал. 4 вариант 1 блок
2 блок Система комплемента играет большую роль во многих болезнях, связанных с иммунитетом. При болезнях иммунных комплексов комплемент провоцирует воспаление главным образом двумя путями:
5 вариант 1 блок
2 блок дифференцировка в-лимфоцитов 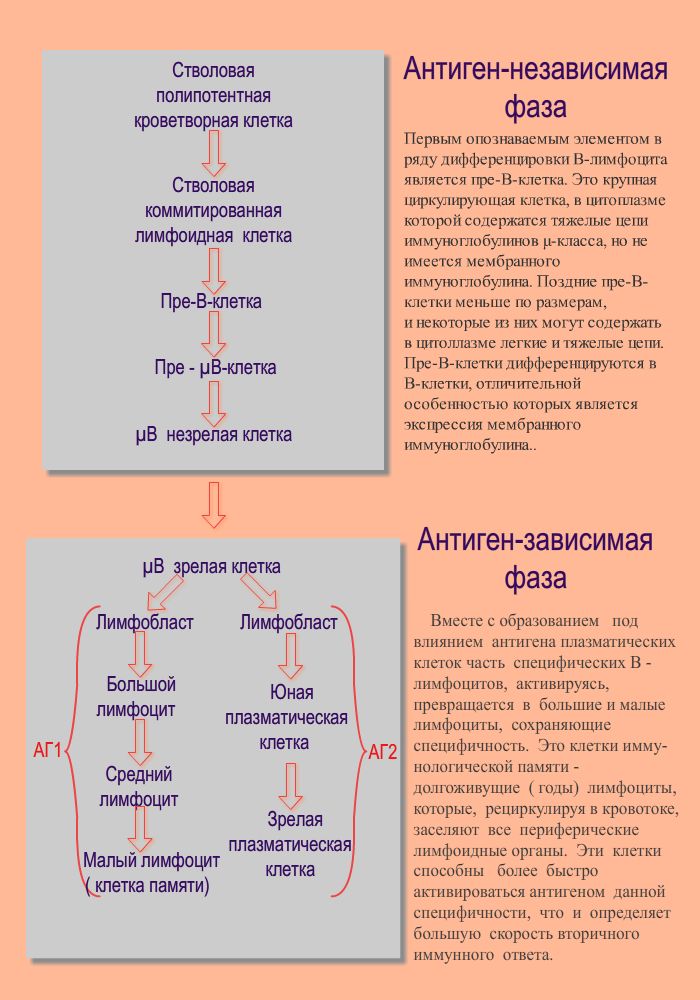 6 вариант 1 блок
2 блок Антигенпредставляющие клетки (АПК) Начальным этапом Т-клеточного иммунного ответа является представление антигена Т-лимфоцитам. Антигенный рецептор CD4+Т-хелпера воспринимает антиген в комплексе с продуктом гена МНС II класса, который должен находиться на поверхности АПК. Следовательно, роль АПК может играть любая клетка организма, обладающая антигеном МНС II класса и способностью сорбировать на своей поверхности чужеродный антиген. В организме человека антигенами МНС II класса обладают немногие клетки: макрофаги, дендритные клетки, В-лимфоциты, а также клетки Лангерганса и кератиноциты кожи, эндотелиальные клетки сосудов и гломерул почек. Макрофаги, дендритные клетки и В-лимфоциты называют профессиональными АПК, так как они более мобильны, активны и выполняют основной объем функций представления антигенов. АПК имеет на наружной мембране до 2 • 105 молекул МНС II класса. Для активации одного Т-лимфоцита достаточно 200-300 тагах молекул, находящихся в комплексе с антигеном. Макрофаги Макрофаги - клетки системы мононуклеарных фагоцитов происходят от монобластов костного мозга, которые дифференцируются в моноциты крови. Монолиты, составляющие около 5% лейкоцитов крови, находятся в циркуляции около 1 сут., а затем поступают в ткани, формируя популяцицию тканевых макрофагов, количество которых в 25 больше, чем моноцитов. К ним относятся купферовские клетки печени, микроглия центральной нервной системы, остеокласты костной ткани, макрофаги легочных альвеол, кожи и других тканей. Много макрофагов во всех органахиммунной системы. Тканевые макрофаги - клетки с округлым или почковидным ядром имеют диаметр 40-50 мкм. Цитоплазма содержит лизосомы с набором гидролитических ферментов, обеспечивающих переваривание любых органических ве ществ и выделение бактерицидного аниона кислорода. Макрофаги функционируют как фагоциты. Они продуцируют растворимые вещества, регулирующие другие клетки иммунной системы, из которых наиболее изучен ИЛ-1, активирующий лимфоциты. На мембране макрофага экспрессированы структуры, обеспечивающие способность отличать чужеродные субстраты от собственных. Маркер макрофага - белок CD14 служит рецептором липополисахаридов бактерий. Макрофаг обладает пектиноподобными молекулами, соединяющимися с маннозными и фруктозными компонентами поверхности большинства микроорганизмов, что обеспечивает их контакты, лежащие в основе фагоцитоза. Участие макрофага в иммунном ответе состоит в том, что эта клетка фагоцитирует антиген-содержащие частицы, дезинтегрирует их, превращая белки в антигенные пептидные фрагменты. Последние в комплексе с собственными антигенами МНС II класса макрофаг передает Т-лимфоциту при прямом контакте с ним. При этом макрофаг продуцирует лимфокин ИЛ-1, который вызывает пролиферацию лимфоцитов, вступивших в контакт с антигеном, что обеспечивает формирование клона этих клеток, осуществляющих развитие иммунологической реакции на антиген. Дендритные клетки Дендритные клетки составляют вторую группу АПК. Они близки к макрофагам, но не обладают фагоцитирующими свойствами. Это способствует сохранности поглощенных антигенов, которые могут быть полностью разрушены в ходе фагоцитоза. Дендритные клетки содержатся в крови, лимфе и во всех других тканях. Дендритные клетки эпителиальных тканей называют клетками Лангерганса, в лимфатических узлах и селезенке они составляют около 1 % всех клеток. Эти отростчатые мононуклеарные клетки в разных тканях имеют неодинаковую форму и даже названия, однако все они обладают молеку лами МНС II класса и способностью фиксировать антигены с формированием комплекса антиген-продукт МНС, представляемого Т-лимфоцитам. Дендритные клетки значительно более активны, чем макрофаги и В-клетки в индукции первичного иммунного ответа: в отличие от других АПК дендритные клетки могут представлять ангиген покоящимся Т-лимфоцитам. Захват антигена дендритными метками чаще всего происходит вне лимфоидных органов. После того они мигрируют в лимфоидные образования, где происходит их контакт с Т-лимфоцитами и развитие дальнейших событий иммунного ответа. Этому способствуют стимулирующие воздействия на лимфоцит через контакт молекул В7-1 и ИЛ-2, экспрессированных на поверхности дендритных клеток, с молекулами CD40, находящимися на :оверхности Т-лимфоцита. Дендритные клетки, как и большинство других клеток человека, обладают антигеном МНС I класса, необходимого для представления антигена CD8+цитотоксическому Т-лимфоциту. Поэтому они являются также инициаторами цитотоксичес-гах реакций 7 вариант 1 блок
2 блок Цитокины, основные характеристики Цитокины (ЦК) - небольшие белковые молекулы (медиаторы), опосредующие широкое сложное взаимодействие между клетками иммунной системы, гранулоцитами и другими клетками организма в процессах иммунного ответа и неспецифической защиты от агентов самой разной природы. К ЦК относят интерфероны (ИФН), интерлейкины (ИЛ), колониестимулирующие факторы и факторы роста. Это простые пептиды или гликопротеины. Подавляющее большинство цитокинов являются олигонуклеотидами и имеют несколько функций. Синтез цитокинов регулируется на уровне транскрипции и трансляции. Действие цитокинов реализуется через специфическое высокоаффинное связывание со специализированными клеточными рецепторами. Одинаковые биологические функции обнаруживаются у цитокинов с непохожей структурой и различными источниками синтеза. Многие эффекты in vivo дублируются целым рядом цитокинов различного происхождения, что повышает надежность функционирования защитной системы и обеспечивает ее тонкую регуляцию. Многие биологические эффекты цитокинов in vivo являются результатом синергического или антагонистического воздействия сразу нескольких цитокинов. Цитокины начинают продуцироваться в ответ на самые различные стимулы. Различают несколько уровней биологического действия цитокинов:
В зависимости от того, какие клетки преимущественно синтезируют данные цитокины их разделяют на лимфокины (ИФН, ФНО), монокины (ИЛ-1, ИЛ-6, ФНО) и нейтрофилокины. В зависимости от направления действия выделяют 6 групп цитокинов:
Наиболее важными изученными цитокинами, продуцируемыми преимущественно клетками моноцитарно-макрофагальной системы являются ИЛ-1, ИЛ-6 и фактор некроза опухолей (ФНО). К наиболее изученным в настоящее время цитокинам, синтезируемым преимущественно лимфоцитами (т.е. лимфокинам) относят: ИЛ-2, 3, 4, 5, 10, 13, ФНО, ИФН и др. 9 вариант 1 блок
2 блок Структура и функции иммунной системы: Начнем с понятий о том, что представляют собой структура и функции иммунной системы. Существует два вида иммунной защиты организма – врожденная и приобретенная. Врожденная иммунная система самая древняя и высокоразвитая, ведь она «росла» вместе с человеком, и получала информацию о вредителях вместе с эволюцией человека. Так, например, организм сам вполне может справиться со многими инфекционными заболеваниями, например, насморком или легкой простудой. Наша кожа, моча, кашель, при котором отходит мокрота, нарушение гормонального баланса – это самые первые звенья, которые начинают работать для уничтожения и выведения вредителей из организма. Также такими «перворабочими» являются рвота, чихание, понос и повышение температуры тела. Именно так иммунная система пытается справиться с чужаками на самых первый этапах борьбы. Если на этой стадии ИС не удалось добиться нужного результата, то включаются более глубокие резервы. При этом, наш организм сам вырабатывает необходимые для защиты антитела. Приобретенный иммунитет мы получаем в процессе нашей жизни. Это прививки, а также перенесенные заболевания в детстве и во взрослой жизни. Всем известно о ветрянке или ветряной оспе. Многие помнят себя разукрашенными «под леопард» зеленого или розово-бордового цвета. Неприятные ощущения – зуд и ужасная слабость, головная боль и высокая температура. Именно температура и позволяет нам пережить такого рода заболевание. Иммунная система человека начинает усиленно вырабатывать антитела, способные справляться с возбудителями болезни. Правда, за такое усердие мы расплачиваемся высокой температурой и прочими дискомфортными ощущениями. Однако сбивать температуру (если, конечно, она не «зашкаливает») нежелательно, ведь тогда организм решит, что все хорошо, и подаст сигнал ИС перестать работать в полную силу. Существует большая вероятность, что переболев один раз и вытерпев все сопровождающие симптомы, мы больше не будем переживать такой недуг вновь. Происходит это именно потому, что иммунная система организма человека «ставит» метки на возбудителей этого заболевания. И теперь, заметив их присутствие в организме, сразу же будет бросаться в атаку, уничтожая их, и выводя продукты распада из организма. Как правило, человек даже и не замечает такую борьбу в организме. Кстати, вы никогда не задумывались, почему дети значительно легче переносят заболевания, чем взрослые? Причина этого очень проста – малыш использует иммунитет, полученный с молозивом (первичным молоком) матери. С возрастом действие такого иммунного оружия ослабевает, и организму приходится самостоятельно и усиленно вырабатывать антитела, чтобы справиться с заболеваниями. При этом организм использует собственные резервы. Кроме того, иммунная система организма человека старается защищать и от собственных клеток-вредителей. Пытаясь ликвидировать такую угрозу изнутри, иммунная система с помощью различных средств сообщает нам, что есть причины для беспокойства. И, чем быстрее мы отреагируем на такие раздражители, тем легче нам будет бороться с заболеванием. Собственно, иммунная система человека – это самодостаточный комплекс органов, позволяющий нам относительно легко переживать различные заболевания. Эти органы иммунной системы мы словно и не замечаем, но они играют важную роль в организме человека. Чтобы их работа не давала сбой, им необходимо регулярно помогать. Для этого есть специально разработанный иммуномодулятор – Трансфер фактор. Изготовлен он путем ультрамембранной фильтрации молозива коров и желтков яиц. Препарат не имеет побочных эффектов, абсолютно безопасен для любого возраста, даже при больших дозах приема. Трансфер фактор стимулирует и доставляет в наш организм свежие элементы иммунной памяти, которые дополнительно сообщают ИС информацию о бактериях и вирусах, а также о способах их уничтожения. Использование только натурального и тщательно очищенного сырья делает Трансфер фактор уникальным препаратом для поддержания ИС в отличном состоянии. 10 вариант 1 блок
2 блок РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА МЕХАНИЗМЫ ОГРАНИЧЕНИЯ ИММУННОГО ОТВЕТА Система регуляции деятельности иммунной системы должна быть достаточно надежной, так как в противном случае высока вероятность развития неконтролируемой иммунной реакции, ко торая может привести к фатальным последствиям. О важности такого контроля косвенно свидетельствует тот факт, что в организме существует множество механизмов, ограничивающих иммунный ответ. Контроль со стороны антител по типу обратной связи. Одним из наиболее эффективных механизмов, ограничивающих синтез анти тел, является механизм отрицательной обратной связи, в котором продукт иммунной реакции (антитела) одновременно выступает в роли ее ингибитора. При этом речь идет не о простом снижении содержа ния антигена за счет его связывания антителами, поскольку целые молекулы иммуноглобулинов тормозят иммунный ответ более эффек тивно, чем F(ab')2-фрагменты. Полагают, что механизм такого торможения связан с образованием перекрестных связей между ан тигеном, молекулой IgG и Fc-рецептором В-лимфоцита. Следует отметить, что тормозящим действием обладают лишь IgG, тогда как IgM усиливают иммунный ответ. Т-супрессоры. С помощью Т-супрессоров осуществляется регуля ция различных форм гуморального и клеточного иммунитета, в том числе ГЗТ, а также пролиферация ЦТЛ, Т-хелперов и В-клеток. Клетки-супрессоры могут обладать антигенной специфичностью, т. е. подавлять иммунный ответ только на определенный антиген, а мо гут быть и антигеннеспецифическими. Активация антигенспецифических Т-супрессоров осуществляется с помощью так называе мых индукторов Т-супрессоров, имеющих такой же фенотип, как и Т-хелперы, — CD4+. Индукторы Т-супрессоров активируются при контакте с антигеном на поверхности антигенпрезентирующих клеток. Собственно механизм супрессии осуществляется с помощью растворимых факторов, способных подавлять активность как Т-хелперов, так и В-клеток или ЦТЛ. Т-супрессоры человека относятся к суб популяции CD8+. Антигенспецифические супрессоры способны ак тивировать уреаплазму антигеннеспецифические супрессоры. Антигенные рецепторы одного лимфоцита распозна ют идиотип (ИД) рецептора другого лимфоцита. Антиидиотипические рецепторы (антитела) могут содержать «внутренний образ» антигена. Такие антиидиотипические антитела при определенных усло виях могут замещать антиген. Несмотря на достаточно многочисленные исследования, показав шие, что клетки с фенотипом CD8+ могут подавлять продукцию антител посредством секреции антигенспецифического секреторно го фактора, все попытки выделить устойчивую линию Т-супрессо ров, а также получить биохимические и молекулярно-биологические характеристики супрессорного фактора оказались безуспешными. В связи с этим существование специальной субпопуляции Т-супрессо ров сомнительно. Идиотипические сетевые взаимодействия. Гипервариабельные районы Н- и L-цепей молекулы иммуноглобулина включают участ ки, которые сами могут играть роль антигенных детерминант. Эти индивидуальные, характерные для антител определенной специфич ности конфигурации, которые могут распознаваться соответствую щими рецепторами Т- и В-лимфоцитов или антителами, получили название идиотипических детерминант. Автор гипотезы сетевого вза имодействия лауреат Нобелевской премии 1984 г. N. Jerne предпо ложил, что лимфоциты, способные распознавать огромное число раз нообразных чужеродных антигенных детерминант, должны распоз навать и идиотипические детерминанты самих лимфоцитарных рецепторов. В соответствии с этим постулируется существование се тевого взаимодействия между лимфоцитами типа идиотип — антиидиотип (рис. 10). Попадание в организм чужеродного антигена неиз бежно должно нарушить равновесие сетевых идиотипических взаимо действий, а стремление системы восстановить утраченное равновесие будет естественно ограничивать иммунный ответ. Антиидиотипические антитела содержат внутренний образ того антигена, к которому специфичны первые антитела. Это можно пояснить на следующем примере. Моноклональные антитела, полученные против антагониста ацетилхолина BISQ, способны стимулировать ацетилхолиновые рецепторы, выполняя в этом взаи модействии функцию ацетилхолина. Эти свойства антиидиотипических антител могут быть использованы при создании вакцинных препаратов нового поколения. Задачи 2 уменьшение эозинофилов, в норме должно быть 0,5-5,0. А все остальное в норме. Здесь относительно изменена лейкоцитарная формула крови. 3.Обнаружение IgG говорит о трансплацентарном заносе антител материнских, поэтому кровь новорождённого исследуют повторно через 3-4 недели. диагностически значимым является увеличение титра IgG в 4 рза, Обнаружение в крови новорождённого IgM говорит о наличии активной инфекции у ребёнка. Из дополнительных исследований — в общем анализе крови можно обнаружить лейкоцитоз со сдвигом влево, лейкоцитоз с нейтропенией, токсическую зернистость нейтрофилов, анемию. 4.Л 23, М 12, Б 0, С 59 – норма Э 0 – эозинопения( в норме 0,5 – 6,0 %) встречается при: некоторых острых инфекционных заболеваниях;остром аппендиците;сепсисе;травмах; П 7- нейтрофилия(в норме 1-5%) вызывают:воспалительные процессы;инфаркт миокарда, легкого; злокачественные новообразования;многие инфекционные процессы. Сдвиг лейкоцитарной формулы влево — увеличение количества незрелых (палочкоядерных) нейтрофилов. 6. большие перспективы имеет применение препаратов рекомбинантных интерлейкинов и синтетических иммуномодулирующих пептидов, таких как ИЛ-1 бета, ИФНα, аэрозольный препарат АРИЛ и бестим. Дополнительное введение извне иммунотропных препаратов может оказать решающее воздействие на адекватное протекание защитных реакций и элиминацию патогена 7. Э увеличено. При любых аллергических состояниях, а также во всех случаях, когда в организме присутствует кто-то чужой (например, при глистных инвазиях), количество эозинофилов возрастает. Если сыпь у ребенка зудящая, ее вызвала, скорее всего, аллергия, инфекция или кожная болезнь. Грибковые кожные инфекции также сопровождаются зудом, хотя (за исключением прелости) редко встречаются до подросткового возраста. 8. Сдвиг лейкоцитарной формулы влево означает, что в крови появляются молодые, «незрелые» нейтрофилы, которые в норме присутствуют только в костном мозге, но не в крови. Подобное явление наблюдается при легком и тяжелом течении инфекционных и воспалительных процессов (например, при ангине Лейкограмма изменена , лейкоциты : норма для 6 лет 30- 50, у нас 60 т.е увеличение: причины повышения лимфоцитов (лимфоцитоз)
Моноциты 3-9 , у нас 20, т.е увеличение - Инфекции вызванные вирусами, грибками (кандидоз), паразитами и простейшими
9:Ребенок 8 месяцев … дефицит имунноглобулина А , он проходит через плацентарный . Его главная роль - защита дыхательных, мочеполовых путей и желудочно-кишечного тракта от инфекции. 10: У больного с септическим процессом… Дефицит имуноглобулина М IgM выполняет защитные функции: устраняет вирусы, активирует комплемент — сложную белковую систему, являющуюся частью иммунитета. |
