Производство неконцентрированной азотной кислоты. 1. Выбор и обоснование принятой схемы производства
 Скачать 1.25 Mb. Скачать 1.25 Mb.
|
|
Содержание Введение 1. Выбор и обоснование принятой схемы производства 2.Характеристика выпускаемой продукции, исходного сырья, вспомогательных материалов 3. Технологическая часть 3.1 Теоретические основы процесса 3.2 Описание технологической схемы 3.3 Расчеты технологических процессов 3.3.1 Расчеты материальных балансов процессов 3.3.2 Расчеты тепловых процессов 3.3.3 Конструктивные расчеты основного аппарата 4. Аналитический контроль производства 5. Автоматизация технологического процесса 6. Охрана труда и окружающей среды Список использованных источников информации Введение Азотная кислота является одним из исходных продуктов для получения большинства азотосодержащих веществ. Основное количество получаемой азотной кислоты (до 70-80 %) расходуется на получение минеральных удобрений. Одновременно азотная кислота применяется при получении взрывчатых веществ почти всех видов, нитратов и ряда других технических солей, в промышленности органического синтеза, в ракетной технике как окислитель в различных процессах и во многих других отраслях промышленности. Азотная кислота вырабатывается как неконцентрированная (до 60-62 % HNО3), так и концентрированная (98-99 % HNО3). В небольших объемах выпускается реактивная кислота и азотная кислота особой чистоты. Все промышленные способы получения азотной кислоты основаны на контактном окислении аммиака кислородом воздуха с последующей переработкой оксидов азота в кислоту путем поглощения их водой. Основными стадиями производства неконцентрированной азотной кислоты являются очистка сырья (воздуха и аммиака) от пыли и других загрязнений, каталитическое окисление аммиака, утилизация получаемого тепла, вывод из нитрозного газа реакционной воды, абсорбция оксидов азота, очистка газовых выбросов. К современным тенденциям развития технологии относятся: обеспечение наибольшей надежности конструкций аппаратуры и машинных агрегатов, повышение степени кислой абсорбции, а также степени использования тепла химических реакций и коэффициента полезного действия энергии сжатых газов, снижение вредных выбросов в атмосферу. 1. Выбор и обоснование принятой схемы производства В нашей стране особенно интенсивное строительство установок производства азотной кислоты началось в начале 60-х годов прошлого столетия. По объему производства азотной кислоты бывший Советский Союз являлся крупнейшим производителем. Основными производителями кислоты являются США, Франция, Германия, Италия и Англия, на долю которых приходится свыше 75% всей выработанной в начале 80-х годов азотной кислоты. К середине 80-х годов производство азотной кислоты в капиталистических странах стабилизировалось. Рост производства происходит за счет обновления предприятий, а также организации выпуска кислоты в развивающихся странах. Все промышленные способы получения азотной кислоты основаны на контактном окислении аммиака кислородом воздуха с последующей переработкой оксидов азота в кислоту путем поглощения ее водой. Основными стадиями производства неконцентрированной азотной кислоты являются: очистка сырья, каталитическое окисление аммиака, утилизация тепла, вывод из нитрозного газа реакционной воды, абсорбция оксидов азота, очистка газовых выбросов. К современным тенденциям развития технологии относятся: обеспечение наибольшей надежности агрегатов, повышение степени кислой абсорбции, а также степень использования тепла химических реакций и КПД энергии сжатых газов, снижение вредных выбросов в атмосферу. Все современные агрегаты производства азотной кислоты высоко автоматизированы, что позволяет сократить численность эксплуатационного персонала, устойчиво вести технологический процесс и повысить надежность работы установок. Бурный рост производства азотной кислоты сохраняет актуальность инженерного поиска оптимальных решений при создании новых технологических линий. Тенденция к созданию установок азотной кислоты, отличающихся высокими технико-экономическими показателями, проявилась особенно ярко в последние годы. Развитие химической промышленности пошло по пути создания установок большой единичной мощности. В силу ряда специфических особенностей процесса в настоящее время не сложилась стандартная технология получения азотной кислоты. Одной из наиболее сложных задач, возникающих при разработке технологической схемы агрегата азотной кислоты большой единичной мощности, является определение оптимального давления для каждой стадии производства. Агрегаты, работающие по комбинированной схеме, мощностью 4550 тыс.т/год (давление на стадиях конверсии аммиака и абсорбции оксидов азота, соответственно 0,098 и 0,343 МПа), которые были созданы в 60-е годы для получения 45-48%-ой азотной кислоты. В 70-е годы в Государственном научно-исследовательском и проектном институте азотной промышленности и продуктов органического синтеза были разработаны и внедрены агрегаты с единичной мощностью 120 тыс.т/год, работающие под единым давлением 0,716 МПа и снабженных пусковым электродвигателем. В основу этих агрегатов положена так называемая, энерготехнологическая схема, в которой используется энергия химических реакций превращения аммиака в азотную кислоту. В технологическую схему была внесена высокотемпературная очистка (каталитическая) хвостовых газов от оксидов азота с использованием природного газа в качестве восстановителя и в сочетании с газовой турбиной для рекуперации энергии. Подобная система позволила снизить содержание оксидов азота в выхлопных газах до 0,0020,005% по сравнению с 0,10,3% в комбинированной схеме. Надежность, простота управления, минимальные капитальные затраты и снижение себестоимости кислоты при практически полной очистки выхлопных газов от оксидов азота – главные критерии, на которые опирались проектировщики при создании данного агрегата Унифицированная комплексная линия производства азотной кислоты под единым давлением 0,716 МПа (УКЛ-7) полностью автоматизирована по энергии. Баланс ее в схеме замыкается за счет установки на одной оси с воздушным компрессором высокотемпературной газовой турбины. Это выгодно отличает данную схему от зарубежных, где одновременно с низкотемпературной газовой турбиной дополнительно устанавливается еще паровая, работающая на паре полученном на этой же установке В настоящее время больше половины разбавленной азотной кислоты вырабатывается на агрегатах мощностью 355 тыс/сутки, работающих по этой схеме. Следующим шагом явилась разработка и внедрение ГИАП-ом в 70-е годы еще более мощных агрегатов АК-72 (36380 тыс.т/год) производства азотной кислоты по комбинированной энерготехнологической схеме (давление на стадиях конверсии и абсорбции соответственно 0,392 и 1079 МПа). С той же системой каталитической очистки, что и в агрегатах мощностью 120 тыс.т/год. Параллельно и независимо французской фирмой "Гранд Ларуас" были созданы ряд установок азотной кислоты (60-ой %) по комбинированной схеме с давлением 0,40,5 Мпа на стадии окисления и 1,11,3 Мпа на стадии абсорбции, такой же мощности, что и агрегат АК-72. Эти установки характеризуются отсутствием природного газа и замкнутым энергетическим балансом, работают без каталитической очистки и запускаются паром из заводской сети [6]. Фирма "Гранд Ларуас" в начале 70-х годов запустила агрегат мощностью 925 т/сутки в ГДР, в дальнейшем этот агрегат был воспроизведен в Польше. Агрегаты меньшей мощностью (от 700 до 800 т/сут)были построены в Румынии и, наконец, в 1977 году фирма "Гранд Ларуас" пустила в эксплуатацию агрегат номинальной мощностью 1250 т/сут для Голландской компании. В 1992 году в ФРГ предложили способ получения азотной кислоты окислением и абсорбцией оксидов азота в водном растворе в присутствии кислорода при противотоке газ-жидкость. Процесс проводят в колонне специальной конструкции. Объединив свои знания и опыт, ГИАП и фирма "Гранд Ларуас" совместно разработали агрегат производства азотной кислоты по комбинированной технологической схеме без потребления природного газа с возможностью низкотемпературной каталитической очисткой выхлопных газов и замкнутым энергетическим балансом. 2. Характеристика выпускаемой продукции, исходного сырья, вспомогательных материалов Техническое наименование продукта – кислота азотная неконцентрированная Химическая формула азотной кислоты – HNО3 Молекулярный вес азотной кислоты – 63,016 Кислота азотная неконцентрированная должна соответствовать требованиям регламента, что выше показаний ОСТ 113 – 03 – 270 – 90. Таблица 2.1. Характеристика исходного сырья, вспомогательных и побочных материалов, выпускаемой продукции
Кислота азотная неконцентрированная с массовой долей 60% имеет следующие свойства: Таблица 2.2. Кислота азотная неконцентрированная с массовой долей 60% имеет следующие свойства:
Температура кристаллизации – минус 21,5оС Температура кипения – 120,06оС при 0,1 МПа (760 мм. рт.ст) С водой азотная кислота смешивается в любых соотношениях с выделением большого количества тепла (493,7 кДж/кг) при получении бесконечно разбавленного раствора. Свойства, характеризующие пожаро– взрывоопасность и токсичность неконцентрированной азотной кислоты приводятся в разделе 11 «Основные правила безопасной эксплуатации производства» настоящего регламента. Область применения Азотная кислота неконцентрированная применяется на предприятии для производства минеральных удобрений. 3. Технологическая часть 3.1 Теоретические основы процесса При каталитическом окислении аммиака образуется лишь оксид азота (II) (NО). Это относительно мало реакционноспособное соединение, не реагирующее с водой, поэтому для получения азотной кислоты оно должно быть окислено до оксидов высших валентностей. При окислении NО кислородом образуется диоксид азота, 2NO+О2=2NO2,rН0(298)=-113,6 кДж (3.1.) который может полимеризоваться до N2О4 и взаимодействовать с NО с образованием оксида азота (III) [1-3]: 2NO2 = N2О4 Нr(298)=- 55,8 кДж (3.2.) NO+NO2=N2О3 Нr(298)=-40,5 кДж (3.3.) Равновесие этих реакций при низких температурах смещено вправо, поэтому в нитрозном газе в условиях избытка кислорода и при достаточном времени контактирования все оксиды азота после охлаждения могут быть превращены в оксид азота (IV) (NО2). В реальных условиях непрерывно протекающих процессов окисления и кислотообразования равновесие не достигается, поэтому в газах присутствуют все указанные оксиды азота– NO, NО2, N2O3, N2О4. Соотношение между их количествами определяется в основном температурными условиями. Равновесие и скорость окисления оксида азота II Равновесие реакций (3.1.–3.3.) хорошо изучено, и числовые значения констант равновесия могут быть найдены практически в любом химическом справочнике. Температурная зависимость константы равновесия реакции (3.1.) может быть вычислена с большой степенью точности по уравнению Боденштейна (для давления, выраженного в Па) [1-3]: 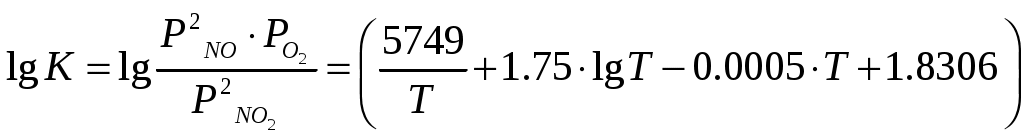 (3.4) (3.4)С понижением температуры равновесие реакции сдвигается в сторону образования оксида азота (IV). При атмосферном давлении в нитрозных газах, полученных конверсией аммиака воздухом, при температуре около 150°С в газе должен находиться один NO2, при 700 оС– один оксид азота (II) (NО). Повышение давления сдвигает равновесие в сторону образования NO2. Особенностью реакции (3.1.) является то, что скорость ее имеет отрицательный температурный градиент– она увеличивается с понижением температуры. Объяснение этому противоречащему обычным закономерностям явлению находят в двухстадийности процесса. Вначале считали, что промежуточным продуктом окисления является димер оксида азота (N2O2). Позднее спектрально было установлено существование соединения NO3 в газах при окислении оксида азота (II). Большинство исследователей стало представлять процесс в целом как двухстадийный в виде [1-3]: NO+O2=NO3Нr(298)=- 19,1 кДж (3.5.) NO3+NO=2NO2Нr(298)=- 94,4 кДж (3.6.) Первая стадия протекает быстро, с повышением температуры, скорость ее увеличивается, но равновесие смещается влево. Вторая стадия– медленная. Она и определяет скорость суммарного процесса. Поскольку при понижении температуры будет возрастать количество NO3, это приводит к увеличению скорости второй стадии и реакции в целом. Такой механизм позволяет объяснить отрицательный температурный градиент скорости реакции, однако в литературе отсутствуют данные о наличии NO3 в газе в результате диссоциации NO2 при высоких температурах, что должно было бы наблюдаться, если вторая стадия является равновесной. Как установлено Боденштейном, окисление оксида азота (II) протекает по уравнению третьего порядка. Пренебрегая скоростью диссоциации оксида азота (IV), что вполне правомерно до температур примерно 300 °С, изменение скорости реакции (3.1.) через парциальные давления можно выразить уравнением: В интегральной форме, наиболее часто применяемой для расчетов, эта зависимость имеет вид: 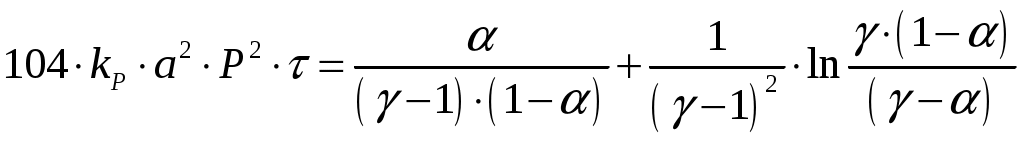 (3.8.) (3.8.)где kP–константа скорости реакции, МПа-2; Р– общее давление, МПа; =b/a; b– начальная концентрация кислорода; – степень окисления (а, b, –в долях единицы). Решение уравнения (3.8.) достаточно трудоемко, поэтому на практике чаще пользуются различными номограммами (рис. 3.1.) [2], уравнениями упрощенного типа или ЭВМ. 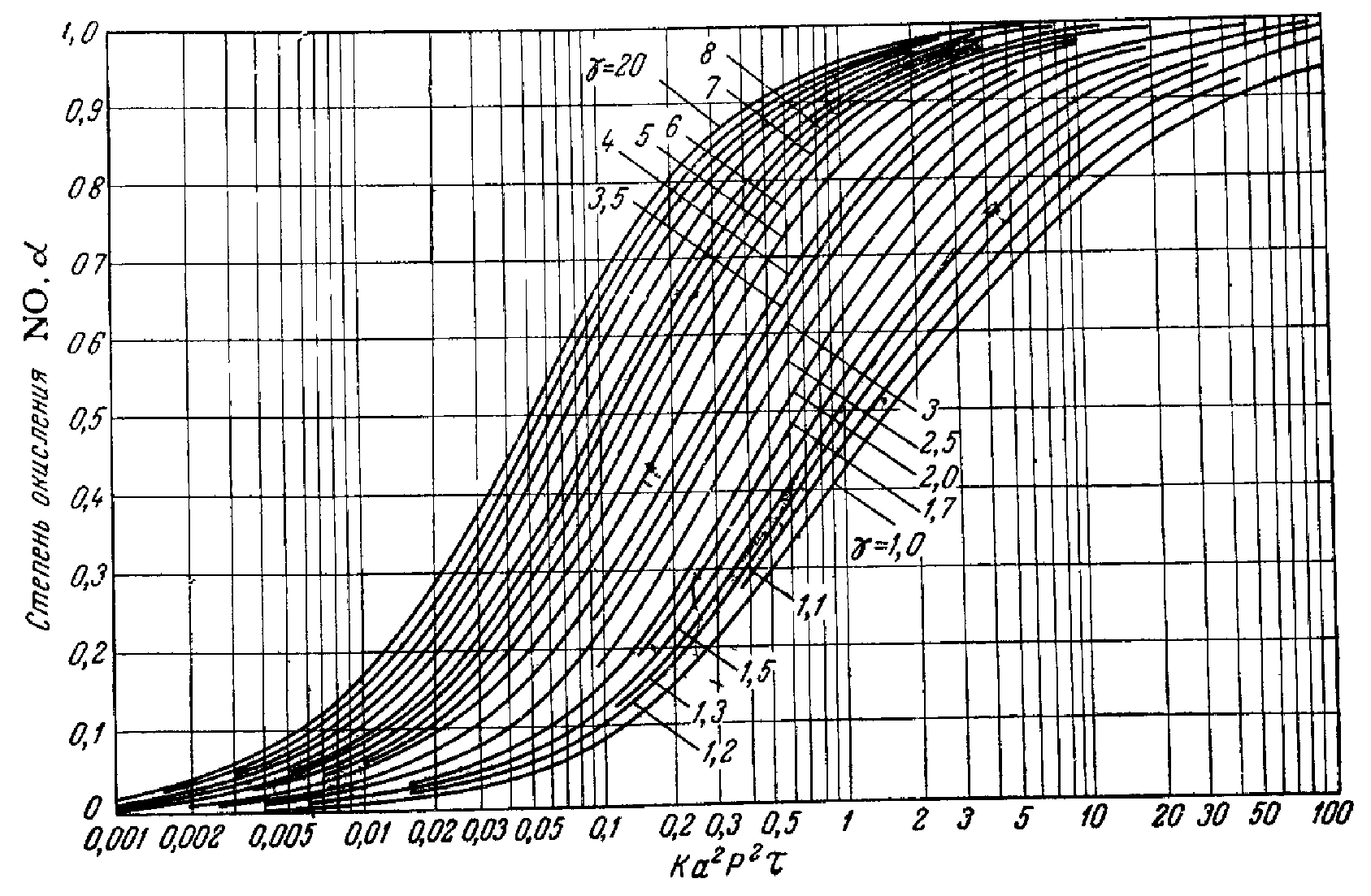 Рис. 3.1. Номограмма В.А. Каржавина для определения степени окисления оксида азота. Неоднократно для увеличения скорости реакции окисления оксида азота (II) предпринимались попытки подобрать катализаторы. Работы проводились как при низких концентрациях NО (в целях сокращения абсорбционных объемов), так и при относительно высоких концентрациях (для увеличения скорости абсорбции и рекуперации энергии). Многие оксиды металлов и другие вещества, обладающие высокой поверхностью и пористостью, проявляют каталитическую активность к реакции (3.1.). Однако практического применения исследованные контакты пока не нашли. Причиной этого является отрицательное влияние паров воды на скорость реакции окисления оксида азота (II) при температурах ниже 100 °С и параллельно протекающие процессы образования азотной кислоты в газовой фазе [1-3]. Установлено [1-3], что оксид азота (II) в определенных условиях, в том числе и в характерных для производства азотной кислоты, окисляется в жидкой фазе растворенным в ней кислородом. Например, при барботажном режиме скорость окисления NО увеличивается с повышением концентраций кислоты и оксидов азота и с ростом скорости газового потока. В отличие от процесса в газовой фазе скорость окисления NО в жидкости возрастает с повышением температуры. Она увеличивается при повышении концентрации кислоты примерно до 50% НNО3, затем снижается. Максимальная степень окисления наблюдается при температуре 30–40 °С. Однако, оценивая все эти особенности, следует учитывать, что скорость окисления в жидкой фазе значительно ниже, чем в равных условиях в газовой фазе. Предполагают [1], что степень окисления оксида азота (II) в жидкой фазе составляет 12–15% от общей степени окисления в нижней части абсорбционной колонны и 2,5–3% на верхней части. С появлением в газе NО2 при температурах ниже 150–200оС начинают протекать реакции (3.2.) и (3.3.). Константа равновесия реакции (3.2.) может быть вычислена с большой точностью по следующей формуле (для давления в МПа): Имеются сведения, что Кр этой реакции зависит не только от температуры, но и от концентрации оксидов азота в газе [1, 3]. В соответствии с равновесием реакции (3.2.) степень полимеризации оксида азота (IV) увеличивается при понижении температуры, повышении давления и концентрации оксидов азота в газе. При низких температурах и повышенных давлениях равновесие реакции (1.2.) практически полностью сдвинуто в сторону образования N2O4. Например, степень полимеризации (X) чистого диоксида азота составляет:
Несмотря на незначительную степень диссоциации при низких температурах нитрозный газ окрашен в бурый цвет, что говорит о присутствии в нем оксида азота (IV) (NO2) – единственного оксида азота, имеющего окраску. Окраски не имеет лишь равновесная смесь, находящаяся в твердом состоянии. Скорость полимеризации оксида азота (IV) очень велика. Равновесие реакции (3.2.) устанавливается практически мгновенно– за 10-4 с, поэтому в расчетах принимают, что в любой взятый отрезок времени смесь NO2–N2О4 находится в равновесии. Образованию оксида азота (III) (N2О3) способствуют пониженные температуры. Равновесие реакции (3.3.) сдвигается в сторону образования N2O3 при понижении температуры, повышении давления и увеличении концентрации оксидов азота в газе. Приближение степени окисления NО к 50% также способствует увеличению содержания в нитрозном газе N2O3. Так как оксид азота (IV), присутствующий в газе, немедленно полимеризуется (особенно при пониженных температурах), то содержание N2O3 в нитрозных газах обычно невелико. Так, в нормальных условиях, даже в эквимолекулярной смеси содержание N2O3 составляет всего 7%. Обычно в нитрозных газах при 25 °С и степени окисления 50% содержание N2O3 не превышает 2%. Скорость достижения равновесия реакции (3.3.) велика – равновесие устанавливается за время, менее 0,1 с. Обычно при расчете процесса переработки нитрозных газов содержанием в них N2O3 пренебрегают, хотя следует иметь в виду, что в определенных условиях кислотообразование может идти путем поглощения N2O3. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
