ответы. процессы и аппараты. 1 вопрос. Виды процессов массопередачи
 Скачать 1.06 Mb. Скачать 1.06 Mb.
|
|
Адсорбция- процесс поглощения одного ИЛИ нескольких компонентов из газовой смеси или раствора твердым веществом— адсорбентом. Поглощаемое вещество носит название адсорбата, или адсорбтива. Процессы адсорбции (как и другие процессы массопередачи) избирательны и обычно обратимы. Благодаря их обратимости становится возможным выделение поглощенных веществ из адсорбента, или проведение процесса десорбции. Механизм процесса адсорбции отличается от механизма абсорбции, вследствие того, что извлечение веществ осуществляется твердым, а не жидким поглотителем. Каждый из этих сорбционных процессов имеет свои области применения, где его использование дает больший технико-экономический эффект. Адсорбция применяется главным образом при небольших концентрациях поглощаемого вещества в исходной смеси, когда требуется достичь практически полного извлечения адсорбтива. В тех случаях, когда концентрация поглощаемого вещества в исходной смеси велика, обычно выгоднее использовать абсорбцию. Процессы адсорбции широко применяются в промышленности при очистке и осушке газов, очистке и осветлении растворов, разделении смесей газов или паров, в частности при извлечении летучих растворителей из их смеси с воздухом или другими газами (рекуперация летучих растворителей). Различают физическую и химическую адсорбцию. Физическая адсорбция обусловлена взаимным притяжением молекул адсорбата и адсорбента под действием сил Ван-дер-Ваальса и не сопровождается химическим взаимодействием адсорбированного вещества с поглотителем. При химической адсорбции, или хемосорбции, в результате химической реакции между молекулами поглощенного вещества и поверхностными молекулами поглотителя возникает химическая связь. При поглощении паров адсорбция иногда сопровождается заполнением пор адсорбента жидкостью, образующейся в результате конденсации паров (капиллярная конденсация). Конденсация происходит вследствие понижения давления пара над вогнутым под действием сил поверхностного натяжения мениском жидкости в капиллярах. Вопрос 37. Адсорбция. Характеристики адсорбентов В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы —- поры, которые условно могут быть разделены на макропоры (более 2·10-4 мм), переходные поры (6·10-6-2·10-4 мм), микропоры (2·10-6-6·10-6 мм). Характер процесса адсорбции определяется размером пор. Удельная поверхность макропор относительно очень мала, поэтому на их стенках адсорбируется ничтожное количество вещества. Макропоры играют роль лишь транспортных каналов для адсорбируемых молекул. На поверхности переходных пор, размеры которых обычно значительно превышают размеры адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция). Размеры микропор приближаются к размерам адсорбируемых молекул, и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого предположение об. образовании слоев поглощенного вещества на поверхности микропор не имеет физического смысла. Обычно микропоры пересекаются макро— и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции. В больших порах диаметром более 2·10-4 мм и малых порах, сравнимых с диаметром молекул поглощаемого вещества, явление капиллярной конденсации отсутствует. Адсорбенты характеризуются своей поглотительной, или адсор6ционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента. Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью. В промышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.), а также синтетические ионообменные смолы (иониты). Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Активирование осуществляют прокаливанием угля при температурах <900 °С, а также другими способами, например, удалением из пор угля смол и некоторых других продуктов сухой перегонки путем их экстрагирования органическими растворителями, окислением кислородом воздуха и др. Для повышения активности углей в них часто перед обугливанием вводят активирующие добавки (растворы хлористого цинка, кислот, щелочей и др.). Удельная поверхность активных углей колеблется от 600 до 1700 м2/г. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперация летучих растворителей и т. д.). Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть. Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами или кислыми растворами их солей. Удельная поверхность силикагелей изменяется от 400 до 770 м2/г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400—800 г/л. Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей. Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д. И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Относительно недавно были получены цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы, диаметр которых больше диаметра пор. Молекулярно-ситовыми свойствами обладают также некоторые природные цеолиты, например, натролит. Молекулярно-ситовое действие цеолитов часто используют в промышленной практике для разделения некоторых веществ, например, нормальных и изопарафиновых углеводородов. Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм. Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются плавленые цеолиты и молекулярные сита (цеолиты с правильной кристаллической структурой), ионообменные смолы, активированные минералы и органические вещества и др. Иониты практически нерастворимы в воде, а также в обычных растворителях и обладают подвижными ионами, способными обмениваться на эквивалентное количество ионов (с зарядом того же знака) из раствора электролита, с которым поглотитель контактирует. Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами, а иониты, содержащие основные активные группы и обменивающиеся недвижными катионами, - катионитами. Существуют также амфотерные иониты, способные к катионному и анионному обмену одновременно. Вопрос 38. Адсорбция. Равновесие при адсорбции Количество вещества, адсорбированное единицей массы или объема данного поглотителя при достижении состояния равновесия, зависит от температуры и концентрации поглощаемого вещества в парогазовой смеси или растворе. Соответственно зависимость между равновесными концентрациями фаз при адсорбции имеет вид: 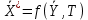 (62) (62)Или при постоянной температуре 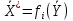 (63) (63)Где 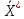 -относительная концентрация адсорбтива в адсорбенте (величина адсорбции), равновесная с концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг адсорбента; -относительная концентрация адсорбтива в адсорбенте (величина адсорбции), равновесная с концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг адсорбента; 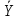 -относительная концентрация адсорбтива в фазе, из которой адсорбируется вещество, кг адсорбтива/кг носителя газовой смеси или раствора. -относительная концентрация адсорбтива в фазе, из которой адсорбируется вещество, кг адсорбтива/кг носителя газовой смеси или раствора.Концентрация 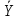 поглощаемого вещества может быть заменена его парциальным давлением p в паро-газовой смеси. Тогда поглощаемого вещества может быть заменена его парциальным давлением p в паро-газовой смеси. Тогда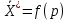 (63а) (63а)Зависимости (63) и (63а) представляют собой выраженные в самом общем виде уравнения линии равновесия при адсорбции, или изотермы адсорбции. Изотермы адсорбции определяются опытным путем. Вид изотермы адсорбции зависит от многих факторов: удельной поверхности адсорбента, объема пор, их распределения по размерам и других характеристик структуры адсорбента, свойств поглощаемого вещества, а также от температуры процесса. Адсорбция сопровождается уменьшением давления пара поглощаемого компонента в исходной смеси и заметным выделением тепла. Поэтому, в соответствии с принципом Ле-Шателье‚ количество адсорбированного вещества возрастает с понижением температуры и повышением давления. Таким образом, повышение температуры и понижение давления отрицательно влияют на процесс адсорбции, способствуя десорбции поглощенного вещества из адсорбента. Количество выделяющегося при адсорбции тепла определяется экспериментально; теплоты адсорбции различных веществ приводятся в справочной литературе. При отсутствии опытных данных о равновесии (или данных, полученных путем обработки эмпирических уравнений) построение изотермы равновесия возможно при использовании уравнений, выведенных на основе того или иного механизма, или теории процесса адсорбции. Вопрос 39. Адсорбция Скорость адсорбции. модель послойной фронтальной отработки слоя адсорбента Характер протекания процесса адсорбции во времени зависит от того, проводится процесс периодически или непрерывно. Деление промышленных процессов адсорбции на периодические и непрерывные связано, главным образом, с состоянием слоя адсорбента — является он соответственно неподвижным или движущимся. Процессы адсорбции не отличаются по механизму от других процессов массопередачи с участием твердой фазы и следуют одинаковым с ними общим закономерностям. Однако периодические процессы адсорбции характеризуются специфическими особенностями. Адсорбции в неподвижном слое адсорбента. Пусть в слой адсорбента, не содержащий адсорбтива, непрерывно поступает и движется с идеальным вытеснением поток с некоторой начальной концентрацией поглощаемого вещества. Через некоторый промежуток времени на лобовом, или фронтальном, участке слоя адсорбента вследствие резкого падения движущей силы поглощение адсорбтива практически прекращается, и поток «проскакивает» через этот участок без изменения концентрации, а зона поглощения перемещается в последующие за лобовым участки. Если бы скорость поглощения была бесконечно большой, то адсорбция в последующих слоях происходила бы только после полного насыщения предыдущих. Однако скорость массопередачи конечна, и распределение адсорбтива по высоте слоя происходит плавно, с образованием так называемого фронта адсор6ции. Изменение фронта адсорбции во времени схематично показано на рисунке 35‚ где приведены кривые распределения относительной концентрации 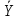 адсорбтива в газе (или растворе) по длине l неподвижного слоя адсорбента, причем τ1 < τ2 < τ3. . . . . . < τi„ где τi — время, протекшее от начала процесса. Согласно опытным данным, по истечении некоторого конечного промежутка времени профиль фронта адсорбции становится практически неизменным (рисунок 35). Время работы слоя до насыщения его лобового участка в периодическом процессе адсорбции называется периодом формирования фронта адсорбции и обозначается через τф. адсорбтива в газе (или растворе) по длине l неподвижного слоя адсорбента, причем τ1 < τ2 < τ3. . . . . . < τi„ где τi — время, протекшее от начала процесса. Согласно опытным данным, по истечении некоторого конечного промежутка времени профиль фронта адсорбции становится практически неизменным (рисунок 35). Время работы слоя до насыщения его лобового участка в периодическом процессе адсорбции называется периодом формирования фронта адсорбции и обозначается через τф.Таким образом, зона адсорбции перемещается во времени по всему слою адсорбента, причем концентрация адсорбтива в зоне плавно изменяется. Это изменение концентрации протекает различно для лобового и последующих участков слоя. По окончании первого периода формирования фронта адсорбции в неподвижном слое адсорбента начинается второй период — параллельного переноса стационарного фронта адсорбции, который характеризуется перемещением неизменного профиля концентраций по направлению потока с некоторой постоянной скоростью u (рисунок 35). С момента выхода из слоя точки фронта газа (раствора) с нулевой концентрацией, соответствующей началу «проскока» (практически с минимально возможной концентрацией, доступной для определения), завершается время адсорбционного, или защитного, действия слоя. Упрощенная модель процесса периодической адсорбции, называемая моделью послойной (фронтальной) отработки слоя адсорбента, была впервые предложена Н. А. Шиловым, применительно к условиям работы противогазовой техники. Средняя концентрация адсорбтива во всем слое адсорбента данной длины, достигнутая к моменту «проскока» адсорбтива, получила условное название динамической активности слоя адсорбента. Эта величина, характеризующая емкость адсорбента в динамических условиях, может измеряться не только количеством поглощенного вещества, но и промежутком времени, протекшим от начала поглощения до момента «проскока»; она часто используется в практике расчетов процессов адсорбции. Участок слоя адсорбента длиной l0 (рисунок 35), на котором происходит падение концентрации адсорбтива в потоке от начальной до нулевой (точнее, до концентрации, соответствующей началу «проскока»), называют работающим слоем, или зоной массопередачи. Рассмотренная выше модель относится только к тем системам адсорбент-адсорбтив, для которых изотерма адсорбции является вогнутой по отношению к оси абсцисс. 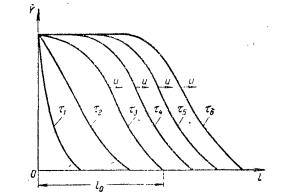 Рисунок 35-Изменение фронта адсорбции во времени Н.А. Шиловым было получено эмпирическое уравнение для режима параллельного переноса фронта адсорбции, перемещающегося с постоянной скоростью u. Согласно этому уравнению время защитного действия слоя τпр составляет: 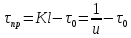 (64) (64)Где 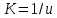 -коэффициент защитного действия слоя; -коэффициент защитного действия слоя; 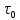 -потеря времени защитного действия слоя, обусловленная тем, что формирование фронта происходит не мгновенно. -потеря времени защитного действия слоя, обусловленная тем, что формирование фронта происходит не мгновенно.Зависимость времени защитного действия 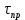 от длиныl в период формирования фронта выражается плавной кривой (рисунок 36), которая затем в период параллельного переноса фронта адсорбции переходит в прямую линию. от длиныl в период формирования фронта выражается плавной кривой (рисунок 36), которая затем в период параллельного переноса фронта адсорбции переходит в прямую линию.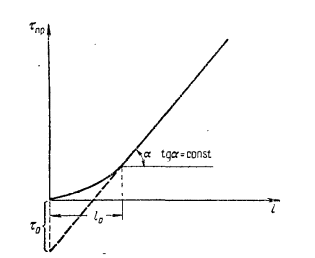 Рисунок 36-Зависимость времени защитного действия от длины слоя поглотителя Вопрос 40. Особенности массопередачи с твердой фазой. Массопроводность, коэффициент массопроводности Массопередача в системах с твёрдой фазой представляет собой особенно сложный процесс. В этом процессе, кроме массоотдачи от поверхности раздела фазы в поток жидкости (газа, пара), имеет место и перемещение вещества в твёрдой фазе массопроводностью. Количество вещества, переместившегося в твёрдой фазе за счёт массопроводности, пропорционально градиенту концентрации, площади, перпендикулярной направлению потока вещества, и времени, то есть: 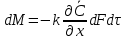 В этом уравнении коэффициент пропорциональности К (м2/ч), имеющий размерность коэффициента диффузии, может быть назван коэффициентом массопроводности. Коэффициент массопроводности зависит от природы проходящего процесса (адсорбция, сушка, выщелачивание), от ряда факторов, определяющих величину коэффициента молекулярной диффузии, и от структуры твёрдого пористого тела. |
