1. Взаимодействие света с веществом. Физические свойства обусловленные этим. Взаимодействие света
 Скачать 6.84 Mb. Скачать 6.84 Mb.
|
|
1.Взаимодействие света с веществом. Физические свойства обусловленные этим. Взаимодействие света: К основным оптическим свойствам минералов, определяемым при визуальной диагностике относятся: прозрачность, окраска и блеск. Оптические свойства проявляются при взаимодействии минералов с электромагнитным излучением видимого света. При падении света на поверхность минерала часть фотонов может проходить через вещество, другая часть отражается от поверхности минерала, а третья поглощается, а затем теряется с тепловым рассеиванием или излучением. Физические свойства: Прозрачность минералов. Прозрачностью называется свойство вещества пропускать свет. Количественно прозрачность оценивается величиной пропускания света, которая определяется отношением интенсивностей вышедшего и падающего лучей. Обычно в минералогии ограничиваются качественной характеристикой прозрачности, разделяя все минералы на прозрачные, просвечивающие и непрозрачные. Отношение к группе зависит, от толщины минерального индивида, но в целом, в практической работе минералога, эти характеристики являются полезными. На степень прозрачности оказывают влияние также характер поверхности кристаллов и агрегатное строение минерального вещества. Мин. тело состоящее из зерен кажутся непрозрачными из-за внутреннего рассеяния и отражения света. Бесцветные приобретают и минералы, состоящие из газово-жидких включений(молочный кварц), молочно-белую окраску. Непрозрачный минералы имеют примеси сульфидов металлов — Ag, Си, Sb, Bi, Pb, Fe, Mn, Co, Ni и др., a также кислородные соединения — Сг^^, и других металлов. Окраска ( цвет) минералов. Окраска минералов бывает самой разнообразной. Одни минералы всегда имеют только один характерный для них цвет (зеленый малахит, синий азурит, золотистый аурипигмент), другие — разную окраску, иногда меняющуюся по секторам и зонам роста кристалла (много- цветные турмалины, бериллы и т.д.) В истории, при изучение окраски выделяют 3 периода: Связан с качественными наблюдениями и систематикой. Кульминационным моментом этого периода явилась монография А.Е.Ферсмана «Цвета минералов» (1936), в которой было предложено различать три типа окраски — идиохроматическую (обусловленную составом и структурой минерала), аллохроматическую (вызванную изоморфными примесями или вростками цветных минералов-примесей), псевдохроматическую, или ложную. Шло активное изучение и интерпретация кривых спектрального поглощения минералов с целью выявить спектры поглощения, типичные для данного атома-красителя в данном валентном состоянии. Период связан с переходом от этих исследований к детальному выяснению физики явления. По современным научным определениям цвет — это свойство тела вызвать у человека определенное зрительное ощущение в соответствии со спектральным составом отражаемого или пропускаемого (испускаемого) телом излучения. Ощущение цвета — это сложное психофизиологическое явление, в котором физическое начало — характер светопоглощения минералом, действительно, есть только начало явления. Пример: самородное золото по своим опт. св-вам должно быть красным, но из-за неодинаковой чувствительности человеческого глаза к разным лучам света (максимально — к зеленому) оно кажется нам желтым. Минерал ,измельченный в порошок, будет для нас другим цветом, за счет рассеяния света и снижения его интенсивности. Это хорошая диагностическая особенность минералов. При плохой освещенности, минерал будет казаться другим цветом. Наконец, факторами физиологического восприятия цвета являются цветовая адаптация (падение чувствительности) глаза при длительном или сильном воздействии на него света, а также эффект цветового контраста (соприкасающиеся разноцветные зерна кажутся глазу различающимися сильнее, чем когда они воспринимаются порознь). Треугольник цвета. Главные факторы, влияющие на субъективную оценку наблюдателем цвета минерала, наиболее полно учитывает международная колориметрическая система. Точность определения цвета базируется на использовании: во-первых, экспериментально измеряемых коэффициентов спектрального отражения или пропускания в видимой области света; во-вторых, стандартных источников света со строго фиксированным типом светоизлучения. В результате пересчетов результатов измерений получают три колориметрических параметра — яркость цвета, его светлоту и коэффициенты цветности «х, у», учитывающие доли красного и зеленого цветов. Нанеся последние на стандартный график, получают точку на треугольнике цветности. Ее положение дает возможность объективно определить количественные характеристики цвета минерала. На треугольнике цветности указаны также координаты х и у для пяти стандартных источников света А, В, С, D, Е. Их излучение максимально близко к белому. Также указаны температуры поверхности, излучающей свет определенной волны. Типы окраски минералов. Удобно и просто разделить окраску минералов по физике явления на два типа — собственную и чужую (чужеродную), причем в каждом из них имеются свои разновидности. Собственная окраска обусловлена особенностями конституции минерала — его химическим составом и структурой. Здесь мы выделим, прежде всего, окраску, вызываемую характером светопоглощения — это наиболее распространенная разновидность собственной окраски минералов. Редкие разновидности собственных окрасок обусловлены интерференционными и дифракционными явлениями — это как бы игра и переливы цвета минерала. Чужие, или чужеродные окраски просты по своей природе. Они вызываются включением пигментирующих частиц (т.е. других цветных минералов), цветными пленками разной природы и некоторыми другими причинами, не связанными с особенностями химической конституции минерала. Цвет минерала очень часто является его специфическим свойством, поэтому он используется при диагностике минералов. Важным примером при этом служит определение цвета минерала не только в его естественных кристаллах и зернах, но и его порошка — цвета черты, оставленной минералом на шероховатой (неглазурованной) фарфоровой пластинке. 2.Гидротермальные месторождения. Образуются при отложении минералов из водных или углекисло-водных растворов. Морфология минеральных скоплений различна: Минералы могут заполнять пустоты в лавах и в осадочных горных породах, образуя в них конкреции и жеоды. Они могут заполнять открытые трещины в гранитах, гнейсах, сланцах и в любых других горных породах Если гидротермальные растворы двигались в горных породах по тончайшим трещинам или диффундировали (просачивались) в норовом и межзеренном пространстве горных пород, то отложение минералов и шло за счет постепенной резорбции (разъедания) и химического замещения минералов окружающих горных масс. Такое явление называется метасоматозом, а сами жилы — метасоматическими (или конкреционными). Метасоматические залежи – это еще одна форма гидротермальных мин. месторождений. Они образуются при просачивание растворов или диффузии вещества через породы, образуются за счет хим. реакций между веществами и гор. породой. Их морфология сложна, размеры различны. Наиболее крупные меднорудные гидротермальные метасоматические залежи 100х500х300 м. Источники воды в гидротермальных растворов: Застывшие магматические очаги. Во время кристаллизации магмы из нее выходят летучие компоненты, в том числе и вода. H2O и СО2 выделяются в глубинных зонах земной коры за счет реакций дегидратации и декарбонатизации глин, мергелей, известняков при процессах их регионального метаморфизма. Источников воды являются процессы дегазации мантии. Из нее выделяются углеводороды, при подъеме они окисляются, идет образование «воды» и «углекислого газа». Последний источник – поверхностные воды. Воды могут мигрировать до глубины 500 м. Характеристика: 1.Их максимальная глубина залегания от 4.5-5 км, минимальная по уровню поверхностных вод. 2.Средняя мощность от 0,1-0,2 до 3-4 м. 3. Горизонтальное простирание до 700-800 м, а вертикальное до 500 м. 4.Жилы редко одиночные, часто это целая система жил, сложная по характеру их взаимных пресечений. Минеральный состав гидротермальных месторождений – он разнообразен, тк множество различных источников р-ров ( разный хим. состав, разные концентрации в-ва, значения pH и величина ок.-вост. потенциала. Углекислота также играет роль, в изменение состава (растворенная форма СО2), т.е. растворы могут быть карбо-гидротермальными. Главные минералы: кварц или кальцит, реже – доломит, сидерит, барит, флюорит. Из рудных минералов – это сульфиды и оксиды. Месторождения:  Условно и ориентировочно гидротермальные рудные месторождения подразделяют на высоко-, средне- и низкотемпературные. У каждого из них свои особенности мин. состава и рудоносности. 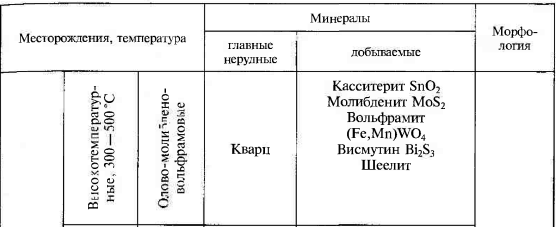 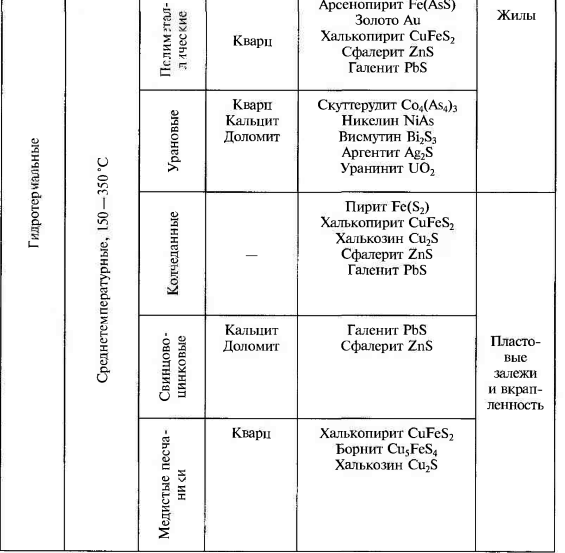 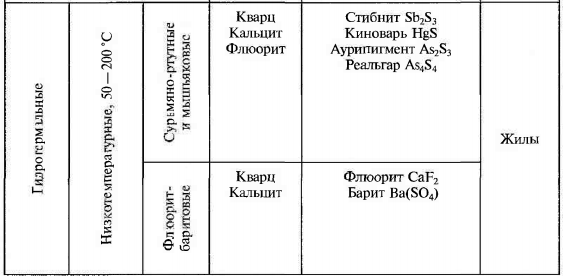 3.Классификация минеральных месторождений. Минеральное месторождение- это геологическое тело или группа геологических тел, имеющие схожий состав и процесс образования. Существует множество принципов классификации мин. месторождений- по гинезесу, по форме мин. тел, масштабам минерализации, одноактности или многоактности процессов минералообразования. Наиболее продуктиваня классификация на генетической основе, но и эта основа можеть быть разной – по физико-химическому характеру среды, способам и хим. обстановке образования минералов, по связи с различными геологическими процессами, по источникам в-ва и тд. Первая классификация завоевавшая широкое признание, была создана В.Линдгреном в 1906 г., он ее улучшил и опубликовал в 1933г. Это была «Общая классификация минеральных ( именно минеральных месторождений) 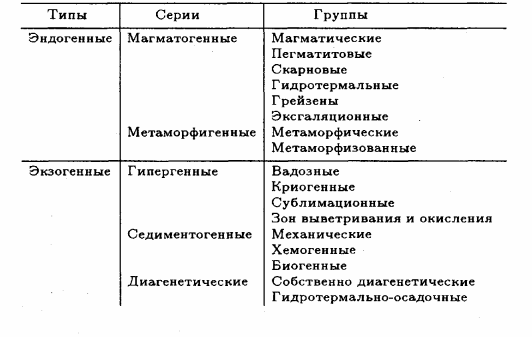 4.Конституция минеральных индивидов. Свойства кристаллического в-ва. Конституция минерала- это его хим. состав и кристаллическая структура ( вся сущность минерала), она определяет его видовую принадлежность. Агрегатное состояние минералов: Любое вещество неорганической природы в зависимости от температуры и давления может находиться в любом агрегатном состоянии, а при изменении этих факторов переходит из одного состояния в другое. Поскольку, минералы обладают кристаллическим телом они относятся к тв. телам. Лишь немногие минералы имеют аморфное тело. Абсолютное большинство минералов представлено кристаллическими веществами, т. е. веществами, обладающими кристаллической структурой. Предел устойчивости у всех агрегатов, различен. Кристаллизация охлаждаемого гомогенного жидкого вещества должна происходить при той же температуре, что и плавление твердого тела того же состава, но обычно она наступает при некотором переохлаждении жидкости, что всегда необходимо иметь в виду. Твердые химически однородные вещества, характеризующиеся беспорядочной структурой, т. е. отсутствием закономерного расположения атомов, носят название аморфных (стеклообразных) тел.К числу изотропных веществ, т. е. обладающих по всем направлениям одинаковыми физическими свойствами. Особенность аморфных тел состоит в том, что переход от одного состояния в другое идет намного плавне, чем в твердых. О кристаллическом строении вещества 1.Существует множество фигур описывающих крист. решетку. 2.Строение крист. в-ва определяется: Наличием атомов, ионов и молекул, удерживаемых электронными силами в решетке; Их размером, связана с плотностью упаковки и числом ближайших атомов, окружающих катион ( координационное число) Хим. связями ( от них зависит вид структуры ) Термодинамическими параметрами ( температура и давление ), при которых она существует. 3.Виды хим. связей: Ионная связь- связь между мет. и немет. с разными знаками ( мет. в начале лев. части таблицы, немет.-наоборот, кроме благородных газов) в результате такой связи атомы переходят в такое состояние при котором они будут затрачивать меньше Е ( энергии) -этот процесс экзотермический -образующее в-во более устойчивое ( мера устойчивости определяется- энергией кристаллической решетки: Е- необходимая для разделения 1-го моля тв. в-ва на 1 моль положительно заряженных ионов и 1 моль отрицательно заряженных, которые находятся на большом расстояние) Ковалентная связь- атомы для создания плотной электронной оболочки, захватывают по одному ил паре электронов.( ограда и спартанцы) Металлическая связь- связь между двумя металлами. -характерная, для самородных элементов; -малые электроны, как цемент удерживают большие атомы; -элементы образованные такой связью достаточно прочны. Вандервальская связь( Межмолекулярная связь)- такие связя образуются за счет остаточных электрических сил, которые появились из-за неравномерного распределения заряда в атоме -они очень слабы; -имеют только направленный характер; -по ним образуются наиболее слабые участки кристалла. Особенности связей зависят от св-в минерала ( оптические, химические) В ионных соединениях анионы как относительно крупные структурные единицы занимают главное пространство, а в кристаллических структурах и при плотной упаковке, естественно, стремятся к правильному расположению в пространстве по закону кубической (трехслойной) или гексагональной (двухслойной) плотнейших упаковок. Малые же катионы располагаются, между большими анионами, в тетроэдрических пустотах или окатэдрических, зависит от размера катиона) «Правило» в плотных упаковках, число октаэдрических пустот= числу анионов, а число меньших по размеру тетраэдрических пустот в два раза больше. Пустоты не всегда заполняются катионами. Зполнение может проходить разными способами: рядами, загзагами, слоями, кольцами и тд. Кристаллизация- экзотермический процесс. Полиморфизм и политепия: Полиморфизмом (от греч. поли — много, морфэ — форма) Способность минерала приобретать множество форм, из-за изменений внешней среды. Полиморфная модификация – переход минерала из 1-го состояния в другое; Хороший пример полиморфизма у природного углерода ( он обладает диморфизмом) при одних условиях он становится графитом( гексагональная структура), а при других алмазом ( кубическая структура). Полиморфный переход второго рода ( переход второй раз)- не испытывает задержек. Полиморфная модификация происходит если, при изменение внешних условий, внутренняя энергия кристалла изменилась. Разные полиморфные модификации обозначают разными буквами: α, β, γ и т. д. (например: α кварц, устойчивый при температурах ниже 573 °С; βкварц, устойчивый при температурах выше 573 °С, и др.). Понижение температуры при перестройке кристаллической структуры, как правило, приводит к модификации, характеризующейся более высоким координационным числом катиона (например, для нашатыря NH4 Cl — 8 вместо 6 при T = 184 °С), что сопровождается уменьшением объема, а следовательно, увеличением плотности (удельного веса) и связанного с нею показателя преломления. Симметрия низкотемпературных модификаций для одного и того же вещества обычно ниже по сравнению с высокотемпературными Понижение давления, наоборот, должно благоприятствовать уменьшению координационного числа, а стало быть и обусловливать понижение температуры превращения, в том числе и температуры плавления для огромного большинства веществ, плавящихся с увеличением объема (лед, висмут и сурьма являются исключением из этого правила). Рост давления приводит к полиморфной модификации с большей плотностью и большим координационным числом. (Симметрия высокобаричных выше симметрии низкобаричных) Морфотропия- преображение формы Автоморфотропия- мрфотропия+ полиморфизм Энатиотропное превращения- превращение, при котором кристалл может вернуться в прежнюю форму Монотропное превращение- превращение без возврата в прежнюю форму. Метастабильное состояние- состояние между переходами, может занять несколько часов, а может и лет, или вечность. Пример: при выпадении карбоната кальция из водных растворов при температуре ниже 30 °С сначала появляется метастабильный арагонит, который в дальнейшем переходит в кальцит, а иногда может и сохраниться. Устойчивая модификация, по сравнению с неустойчивой: меньшей упругостью пара; 2) меньшей растворимостью и 3) более высокой температурой плавления. продукты замещения называются параморфозами, примером которых являются октаэдрической формы выделения графита, представляющие параморфозы последнего по алмазу. К числу явлений, сходных с полиморфизмом, относится особый случай структурного разнообразия веществ одинакового состава, называемый политипией. Различные политипные модификации характерны для веществ со структурой, построенной из одинаковых слоеподобных фрагментов, характер взаимного наложения которых может быть различным за счет, например, различных взаимных разворотов или сдвигов слоев. Политипные модификации обозначаются обычно символамиРамсделла, содержащими стоящие впереди цифры, обозначающие число слоев в периоде и латинских букв (Tk, M, O, Q, R, T, H и C для модификаций с ячейками, обладающими триклинной, моноклинной, (орто)ромбической, тетрагональной, ромбоэдрической, тригональной, гексагональной и кубической симметрией соответственно). После буквенного обозначения может находиться подстрочный числовой индекс, если среди политипных модификаций определенной слойности есть несколько различных с одинаковой симметрией. Для полностью неупорядоченных последовательностей слоев употребляется буквенное обозначение D (от англ. disorder — беспорядок) Политипия широко распространена среди кристаллических веществ. Так, для самородного серебра, кроме обычной трехслойной кубической модификации 3С в природе известны двух и четырехслойная модификации 2H и 4H гексагональной сингонии. Особенно богаты политипами, как показал лабораторный синтез, сульфид цинка ZnS (более 150) и карбид кремния SiC (128). Так как различные политипы одного вещества построены из одинаковых слоев, координационные числа атомов в них не отличаются, что приводит обычно к ничтожным различиям по энергии связи между различными политипами. Благодаря такой близости различных политипов по энергии для них невозможно, за малыми исключениями, выделить индивидуальные поля устойчивости на P–T диаграммах, следовательно, при одних и тех же условиях могут сосуществовать несколько политипных модификаций. Причины образования тех или иных политипов остаются пока до конца не выясненными. Считается, что на это влияют микропримеси и динамические особенности роста кристаллов. Явления разрушения кристаллических структур. Главнейшими особенностями кристаллических структур минералов являются закономерное расположение и строго уравновешенное состояние слагающих их структурных единиц. Однако достаточно создать такие условия, при которых внутренние связи структурных единиц будут поколеблены, как из кристаллического вещества с упорядоченной пространственной структурой мы получим аморфную массу, не обладающую кристаллическим строением. Прекрасным примером в этом отношении является разновидность минерала брусита — ферробрусит: (Mg,Fe) [OH]2 , содержащий в виде изоморфной примеси до 36 % (по весу) закиси железа. В свежем состоянии этот минерал, будучи извлечен из глубоких горизонтов шахт, совершенно бесцветен, прозрачен и обладает стеклянным блеском. В течение нескольких дней его кристаллики на воздухе постепенно меняют свой цвет, становясь золотистожелтыми, затеям бурыми и, наконец, непрозрачными темнокоричневыми, сохраняя внешнюю кристаллическую форму1 . Химический анализ показывает, что почти все двухвалентное железо при этом переходит в трехвалентное (т. е. происходит окисление) а рентгенометрическое исследование не устанавливает признаков кристаллического строения Весьма интересные явления изучены в минералах, содержащих редкоземельные и радиоактивные элементы (ортит, фергюсонит, эшинит и др.). В них также очень часто, но не всегда, устанавливается превращение кристаллического вещества в аморфное, которое, как предполагают, обязано действию αлучей при радиоактивном распаде . Эти измененные стеклообразные минералы, не относящиеся к кубической сингонии, оптически изотропны и не обнаруживают дифракции рентгеновских лучей, т. е. ведут себя как аморфные тела. При этом происходит частичная гидратация вещества. Такие тела Бреггер назвал метамиктными. Известно немало примеров вторичной перегруппировки вещества с образованием новых кристаллических тел, устойчивых при изменившихся условиях. Так, известны «кристаллы ильменита» (Fe..TiO3 ), которые при микроскопическом изучении оказываются состоящими из смеси двух минералов: гематита (Fe2 O3 ) и рутила (TiO2 ) Минералы, находящиеся в метамиктном состоянии, как метастабильные фазы, имеют некоторый запас потенциальной энергии по сравнению с устойчивой модификацией. Эта энергия связана со смещением атомов из равновесных положений, произошедшим при столкновении с осколками деления; при низких температурах амплитуды тепловых движений атомов не достаточны для их возвращения в положения, которые были характерны для структуры до начала метамиктного распада. Нагревание метамиктных минералов чаще всего позволяет вывести их из метастабильного состояния с восстановлением первоначального кристаллического состояния. Нередко восстановление структуры происходит за столь короткое время, что бурно выделяющийся избыток энергии, отвечающий теплоте плавления, приводит к почти мгновенному самопроизвольному разогреву минерала до высокой температуры, сопровождаемому растрескиванием и интенсивным свечением (так называемая рекалесценция). 5.Магматические минеральные месторождения. Магматические процессы совершались во все геологические эпохи и приводили к образованию огромных масс изверженных горных пород. По условиям образования различают прежде всего две главные группы этих пород: а) эффузивные (экструзивные), т. е. излившиеся на земную поверхность в виде лав или быстро застывшие в непосредственной близости ее в условиях низкого внешнего давления; б) интрузивные, медленно застывшие на глубине под высоким давлением в виде больших грибообразных, пластообразных и неправильной формы массивов. Эффузивные породы при быстром остывании не успевают полностью раскристаллизоваться и потому в своем составе содержат в том или ином количестве вулканическое стекло и часто обильные округлые пустоты (в пузыристых лавах), свидетельствующие о выделении газообразных продуктов вследствие резкого уменьшения внешнего давления. Интрузивные породы, наоборот, представляют собой полнокристаллические породы. В зависимости от содержания кремнезема и других компонентов среди изверженных пород различают: а) ультраосновные, богатые MgO и FeO, но наиболее бедные SiO2 (< 45 %): дуниты, пироксениты — в интрузивных и пикриты — в эффузивных комплексах; б) основные, более богатые SiO2 (45–55 %) и богатые Аl2 О3 и CaO, но более бедные MgO, FeO; габбро, нориты — в интрузивных и базальты и диабазы — в эффузивных комплексах; в) среднекислые по содержанию SiO2 (55–65 %), более бедные CaO, но обогащенные щелочами: диориты, кварцевые диориты — в интрузивных, порфириты, андезиты и др. — в эффузивных комплексах; г) кислые, богатые SiO2 (> 65 %), но еще более богатые щелочами и более бедные, по сравнению с предыдущими, CaO, FeO, MgO: гранодиориты, граниты и другие породы — в интрузивных; липариты, кварцевые порфиры и прочие породы — в эффузивных комплексах. На рисунке представлены главные окислы интрузивных пород. На этой диаграмме легко видеть, как меняется состав ультраосновных, основных среднекислых и кислых изверженных горных пород. Особняком от них стоит семейство бескварцевых нефелиновых сиенитов (SiO2 около 55 %), более богатых щелочами и Аl2 О3 , чем граниты, а также фонолитов, лейцитофиров и других эффузивных комплексов. В ряде интрузивных массивов, где дифференциация магмы проявилась более совершенно, кислые разности пород располагаются в верхних частях, а более тяжелые по удельному весу основные и ультраосновные породы — в более глубоких частях, у нижней границы массивов. Рудные месторождения магматического происхождения встречаются лишь в ультраосновных и основных изверженных породах. К ним принадлежат месторождения Cr, Pt и других металлов платиновой группы, а также Сu, Ni, Co, Fe, Ti и др. В богатых щелочами интрузивных породах (нефелиновых сиенитах) встречаются месторождения редких земель — ниобия, тантала, титана, циркония, и неметаллических полезных ископаемых — фосфора (апатита), глиноземного сырья (нефелина) и др. 6. Метаморфические минеральные месторождения. Региональный метаморфизм и связанные с ним процессы минералообразования Наиболее сильные изменения как эндогенных, так и экзогенных образований наступают при так называемом региональном метаморфизме, когда вследствие тектонических перемещений целые области верхних участков земной коры могут оказаться в глубинных условиях, т. е. в условиях сильно повышенных температур и давлений или в условиях мощного проявления горообразующих процессов. Весьма существенно меняется минеральный состав горных пород и руд, а также их свойства и внешний облик. Химический состав при метаморфизме остается неизменным, в отличие от метасоматоза, исключение составляют лишь два компонента — вода и углекислота. Образовавшиеся в экзогенных условиях богатые водой соединения превращаются в безводные или бедные водой (например, опал переходит в кварц, лимонит — в гематит или магнетит и т. д.). Одновременно происходит перекристаллизация вещества (например, органогенный известняк превращается в мрамор с уничтожением прежних структурных особенностей). Во многих породах, в том числе в изверженных, происходит полная перегруппировка компонентов с образованием новых минералов. Химические реакции под влиянием высокого давления и температуры стремятся идти в сторону образования минералов с уменьшенным объемом и повышенным удельным весом. Парагенезис минералов зависит не только от состава метаморфизующихся пород, но и в значительной мере также от глубины, на которой происходит метаморфизм, т. е. от термодинамических условий. Сами породы под влиянием сильных динамических воздействий превращаются в сланцы, способные раскалываться на пластинки и плитки (глинистые сланцы, аспидные сланцы. Если метаморфизму подвергаются тонкослоистые осадочные породы, причем направление давления совпадает с направлением слоистости или близко к нему, то происходит сминание прослоек с образованием многочисленных мелких складок, по добно тому, как это изображено  В перегруппировках минерального вещества бесспорную роль играют такие компоненты, как Н2 О, СО2 и другие минерализаторы, с помощью которых совершаются не только перекристаллизация масс, но и явления метасоматоза и даже переотложение минерального вещества. Источником Н2 О и СО2 в данном случае являются либо магматические породы, либо те же породы, которые подвергаются метаморфизму. В условиях повышения температур и давлений эта метаморфическая вода должна приобретать все свойства типичных гидротерм, а затем — и флюидов, генетически связанных с интрузивной магматической деятельностью, т. е. повышенную способность к растворению, переносу и отложению минералов вдоль трещин. Среди месторождений полезных ископаемых, встречающихся в метаморфизованных толщах, выделяются следующие несколько различные по генетическим признакам типы: а) метаморфизованные месторождения, т. е. месторождения, существовавшие до момента метаморфизма (например, осадочные месторождения железа и марганца); б) метаморфические месторождения, возникшие лишь в процессе метаморфизма. Примером генезиса месторождений последнего типа может служить образование в метаморфических толщах графита за счет органических остатков. Известны случаи происхождения скрытокристаллического графита с отпечатками растений за счет пластов каменного угля (в метаморфических толщах восточного склона Урала). В данном случае графит как новообразование уже не представляет собой горючее ископаемое вследствие коренного изменения первоначальных свойств и потери летучих веществ. К такому типу относятся месторождения «жилы альпийского типа». Они приурочены к полым трещинам разрыва, возникшим в метаморфических тол щах обычно в крест сланцеватости пород. 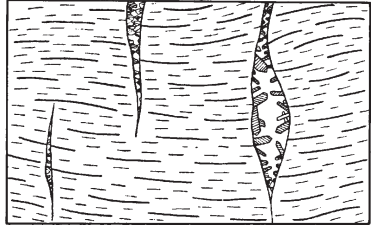 особенностью состава этих жил является то, что в них выкристаллизовываются те же самые минералы, которые возникают в процессе метаморфизма. позволяет считать, что минеральные компоненты были перенесены в полости непосредственно из метаморфизуемых толщ при участии флюидов или гидротерм, не связанных, повидимому, с какимилибо магматическими очагами. Механизм перераспределения компонентов из боковых пород в открытые полости трещин, как предполагается, связан с более высокой растворимостью в поровых растворах породообразующих минералов, а присутствующих в виде мелких зерен акцессорных — в особенности, по сравнению с их растворимостью в растворах полостей. Тонкие трещины в метаморфических породах нацело выполняются минеральным веществом. Таковы, например, прожилки белого кальцита в серых известняках, молочнобелого кварца в красных яшмах и т. д. При этом размеры кристаллических зерен этих жилок всегда больше, чем в окружающей породе. 7. Карбонаты со структурой NaCl.  Безводные карбонаты 1. Семейство кальцита Это семейство включает большое число минеральных видов, представляющих карбонаты двухвалентных металлов, образующих следующий морфотропный ряд (в порядке возрастания ионных радиусов): Mg, Zn, Fe2+, Mn2+, Ca, Sr, Pb и Ba. Характерно, что ионы с меньшим радиусом, чем Са, образуют широкие изоморфные ряды минералов, кристаллизующихся в тригональной сингонии, а ионы с большим радиусом, чем у Са, образуют карбонаты ромбической сингонии. Карбонат самого кальция является диморфным, т. е. может кристаллизоваться в той и другой сингониях. Карбонаты: тригональной сингонии Mg Zn Fe2+ Mn2+ Ca 0,74 0,83 0,80 0,91 1,04 ромбической сингонии Ca Sr Pb Ba 1,04 1,20 1,26 1,38 Кристаллическая структура тригональной модификации Са[СО3 ] изображена на рис. 208 и 209. 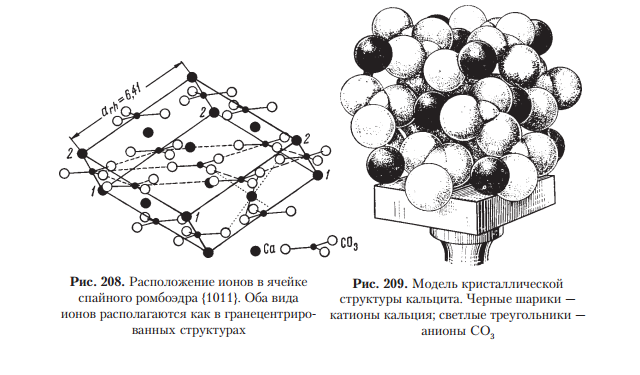 Если кубическую структуру NaCl сдавить вдоль тройной оси настолько, что углы между гранями станут равными 101°55′, то получится ромбоэдрическая гранецентрированная структура кальцита (см. рис. 209), причем ионы Са займут места Na, а группы [СО3 ] — места Cl. Таким образом, упаковка ионов в кальците отвечает несколько искаженной упаковке, про изведенной по способу плотнейшей кубической кладки структурных единиц. Кристаллическая структура арагонита — ромбической модификации Са[СО3 ] — от структуры кальцита отличается лишь тем, что ионы Са2+ и [CO3 ]2– упакованы по способу плотнейшей гексагональной кладки (рис. 210). 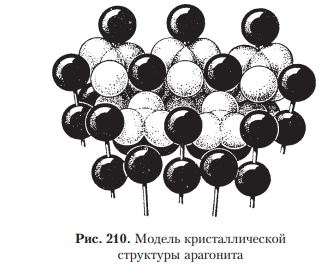 В отличие от структуры кальцита, в структуре арагонита каждый ион [СО3 ]2– окружен девятью ионами кальция. Насколько можно судить по разнице удельных весов, кристаллическая структура арагонита более плотна. Другой характерной особенностью минералов группы кальцита является склонность к образованию изоморфных смесей и двойных солей. В кальцитовом ряде, как и следовало ожидать согласно соотношениям размеров ионных радиусов катионов, широко замещают друг друга Mg, Zn и Fe2+. Fe2+ и Mn2+ образуют непрерывный ряд изоморфных смесей. Что касается Са, то этот элемент в силу существенного отличия величины его ионного радиуса от предыдущих катионов (за исключением Mn2+) может образовывать лишь двойные соли с ними. Ионы кальция и магния (или другие малые катионы) в кристаллических структурах располагаются попеременно вдоль тройной оси. Поэтому несколько снижается: вместо дитригональноскаленоэдрического вида симметрии (L3 6 3L2 3PC) имеем ромбоэдрический (L3 6 C), т. е. исчезают двойные оси, проходящие через центральный ион углерода и кислородные ионы, с ним связанные. В этом семействе будут рассмотрены простые и двойные тригональные (ромбоэдрические) карбонаты, которым отвечают группы кальцита и доломита, а также простые ромбические карбонаты (группа арагонита). Сюда же условно включен паризит, являющийся карбонатом кальция и редких земель с участием дополнительного аниона F1и имеющий полисоматическое строение. |
