16 1 Возбудитель сифилиса (T. pallidum) Был открыт в 1905 г. Ф. Шаудином и Э. Гоффманом
 Скачать 485.72 Kb. Скачать 485.72 Kb.
|
|
16.8.1.1. Возбудитель сифилиса (T. pallidum) Был открыт в 1905 г. Ф. Шаудином и Э. Гоффманом. Морфология и тинкториальные свойства. Типичны для рода Treponema. T. pallidumобладает тремя типами движения: вращением вокруг прямой оси, изгибанием под углом и поступательным волнообразным (маятникообразным) перемещением. Сгибание клетки под прямым углом без потери спиралевидной формы является важным дифференциальным признаком рода Treponema. Жизненный цикл возбудителя включает в себя спиралевидную форму, зернистую стадию, стадию кистоподобных сферических тел (цисты). Цисты являются формами устойчивого выживания в неблагоприятных условиях. Существуют также L-формы и фильтрующиеся формы T. pallidum/pallidum. Биохимические и культуральные свойства. Возбудитель сифилиса относится к облигатным паразитам, поэтому он не культивируется на искусственных питательных средах. Биохимические свойства вследствие некультивируемости изучены плохо. Антигенная структура. Обладает сложной антигенной структурой. Имеет специфический термолабильный антиген и неспецифический липоидный антиген. Последний по составу идентичен кардиолипину, экстрагированному из бычьего сердца. Представляет по химической структуре дифосфадил глицерин. Факторы патогенности изучены плохо. В процессе прикрепления к клеткам участвуют адгезины, синтез которых происходит, возможно, при попадании возбудителя в организм человека. Липопротеины участвуют в развитии иммунопатологических процессов. T. pallidum/pallidumне продуцирует сильнодействующие экзотоксины, обладая тем не менее цитотоксической активностью в отношении нейробластов и других клеток. Имеются протеины, сходные с бактериальными гемолизинами. Резистентность. Чувствителен к высыханию, солнечным лучам, дезинфицирующим веществам, нагреванию. При нагревании до 55 °С гибнет в течение 15 мин, при 100 °С - мгновенно. На предметах домашнего обихода сохраняет заразительность до высыхания. Цисты и L-формы являются формами устойчивого выживания в неблагоприятных условиях. Эпидемиология. Сифилис относится к строгой антропонозной инфекции - болеют только люди. Впервые врачами были установлены случаи заболевания сифилисом среди испанцев после открытия Колумбом Нового Света, а в результате войн оно широко распространилось в Европе и быстро достигло эпидемического уровня. Половой путь передачи инфекции был установлен достаточно быстро и был назван А. Паре «Lues Venerae»(«любовная чума»). Сам термин «сифилис» предложил Д. Фракасторо (1525), который в стихотворной форме описал это заболевание у пастуха по имени Сифилус. Заражение происходит, как правило, контактнополовым, реже контактно-бытовым и трансплацентарным путями. Возможно заражение кровью, собранной у инфицированных лиц на раннем этапе инфекции. Поэтому для разрушения возбудителя кровь консервируют при -3 °С в течение 5 дней. Патогенез и клиническая картина. Сифилис (Lues)- хроническое венерическое заболевание с циклическим течением, затрагивающее в процессе развития инфекции все органы и ткани человека. Проникшие в организм трепонемы из места входных ворот попадают в регионарные лимфатические узлы, где размножаются. Из лимфатических узлов возбудитель попадает в кровяное русло, где прикрепляется к эндотелиальным клеткам, вызывая эндартериит, ведущий к развитию васкулитов и последующему тканевому некрозу. С кровью трепонемы разносятся по всему организму, обсеменяя различные органы и ткани: печень, почки, костную, нервную и сердечно-сосудистую системы. Болезнь протекает в несколько циклов. Инкубационный период составляет 3-4 нед. Первичный периодхарактеризуется появлением твердого шанкра(язвочки с твердыми краями на месте внедрения возбудителя - слизистых оболочках половых органов, рта, ануса), увеличением и воспалением лимфатических узлов. Его длительность 6-7 нед. Затем наступает вторичный период,который длится годами. Он характеризуется появлением на коже и слизистых оболочках папулезных, везикулярных или пустулезных высыпаний, в которых содержится большое количество живых трепонем, а также поражением печени, почек, костной, нервной и сердечно-сосудистой систем. В этот период больной наиболее заразен. Высыпания могут самопроизвольно исчезать, а при ослаблении защитных сил организма появляться вновь. При отсутствии лечения наступает третичный период,который длится десятилетиями и характеризуется образованием сифилитических бугорков (гумм) как результат развития в организме иммунопатологического процесса. Гуммы склонны к распаду, вызывая деструктивные изменения в пораженных органах и тканях. Без лечения наступает четвертичный период- нейросифилис, характеризующийся развитием прогрессирующего паралича вследствие поражения центральной нервной системы. Иммунитет. Защитный иммунитет после перенесенной инфекции не формируется. В ответ на антигены возбудителя в организме образуются антитела, которые являются свидетелями инфекционного процесса, также развивается ГЗТ. Гуморальный иммунный ответ характеризуется первичным образованием неспецифических антител, исторически называемых реагинами, к липоидному антигену возбудителя. Титр этих антител в процессе уменьшения в организме количества трепонем падает. Специфические антитела на белковый антиген появляются позже. Они длительно сохраняются независимо от присутствия трепонем в организме. Микробиологическая диагностика. Используют бактериоскопический и серологический методы в зависимости от стадии заболевания, а также ПЦР. Бактериоскопическое исследование проводят при первичном сифилисе (рис. 16.10) и в период высыпаний при вторичном сифилисе. Материалом для исследования служат отделяемое твердого шанкра, пунктаты лимфатических узлов, материал из кожных высыпаний. Серологическое исследование включает комплекс серологических реакций, среди которых имеются отборочные неспецифические тесты, применяемые для обследования населения на сифилис, и диагностические тесты, подтверждающие диагноз. Отборочные тесты ставят с кардиолипиновым антигеном, а диагностические тесты - с трепонемальным специфическим антигеном. К отборочным тестам относится реакция микропреципитации или ее аналоги: VDRL(от англ. veneral disease research laboratory), RPR(от англ. rapid plasma reagin)- флоккуляционные тесты и РПГА с кардиолипиновым антигеном. Эти реакции бывают положительными на ранних этапах заболевания. Ранее ставилась РСК (реакция Вассермана) с кардиолипиновым и трепонемальным антигенами. Отборочные тесты с кардиолипиновым антигеном в количественном варианте постановки, при котором сыворотка разводится, позволяя определить титр антител, использую для контроля эффективности лечения. Их недостатком являют ложноположительные результаты у лиц, страдающих заболевани ми, сопровождающимися деструкцией тканей организма (маляри онкологические заболевания, коллагенозы и др.). Высокочувствительными и высокоспецифичными реакциями на сифилис являются тесты, в которых в качестве антигена используется ультразвуковой экстракт трепонем, выращенных в яичке кролика. К ним относятся ИФА, РПГА, РИФ (непрямая) иммуноблот. Они являются диагностически подтверждающими тестами. В связи с длительным сохранением специфических антител в организме эти реакции не могут быть использованы для оценки эффективности лечения. Они также будут положительными у больных фрамбезией и беджель. Из молекулярно-биологических методов чаще всего используют ПЦР, основанную на детекции ДНК T. pallidum/pallidumпутем амплификации участка гена поверхностного антигена с молекулярной массой 47 кД, а также выявлении 16S РНК T. pallidum/ pallidum.Аналитическая чувствительность этого метода составляет 400 копий ДНК в 1 мл. Лечение. Используют антибиотики пенициллинового ряда и висмутсодержащие препараты. Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика заключается в пропаганде здорового образа жизни, санитарно-просветительной работе среди молодежи. Проводится обязательный серологический контроль доноров, беременных и больных, поступающих во все стационары, а также в группах риска (проститутки, гомосексуалисты, наркоманы) с целью своевременного выявления и эффективного лечения больных сифилисом. 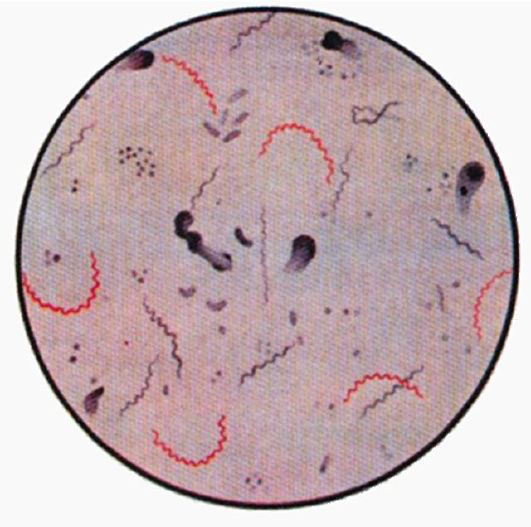 Рис. 16.10. Treponema pallidumв отделяемом твердого шанкра при окраске по Романовскому-Гимзе 16.8.2.1. Возбудители возвратных тифов Возвратные тифы - группа острых инфекционных заболеваний, вызываемых боррелиями, характеризующихся острым началом, приступообразной лихорадкой, общей интоксикацией. Различают эпидемический и эндемический возвратные тифы. Эпидемический возвратный тиф- антропонозная инфекция, возбудителем которой является B. recurrentis,впервые описанная в 1868 г. О. Обермейером. Единственным источником возбудителя является лихорадящий больной, в периферической крови которого находятся боррелии. Переносчиком возбудителя являются вши (лобковые, платяные, головные), реже клопы, которые становятся заразными на 6-28-й день после инфицирующего укуса. Человек заражается при втирании гемолимфы раздавленных вшей в кожу, при расчесывании места укуса. Заболевание встречается во время социальных бедствий и войн. На территории РФ в настоящее время не регистрируется. Эндемический (клещевой) возвратный тиф -зоонозное природноочаговое заболевание. Возбудители представлены более 20 видами боррелий, циркулирующих в различных природных очагах тропиков и субтропиков разных стран. Так, B. duttoniiхарактерна для Африки, B. persica- для Азии, B. caucasica- для Кавказа, Закавказья, Украины. Резервуаром в природе являются грызуны, ряд других животных, а также аргасовые клещи, у которых микроб передается трансовариально. Человек заражается через укусы клещей рода Ornithodoros. Возбудителей эпидемического и эндемического возвратных тифов дифференцируют в биологической пробе. Патогенез и клиническая картина. Патогенез и клинические проявления обоих типов возвратных тифов схожи. Инкубационный период длится 3-14 дней. Попавшие в организм боррелии внедряются и захватываются клетками лимфоцитарно-макрофагальной системы, размножаются в них и попадают в большом количестве в кровь, вызывая лихорадку (повышение температуры тела до 39-40 °С), головную боль, озноб. Каждая такая атака заканчивается повышением титра антител. Взаимодействуя с ними, боррелии образуют агрегаты, которые нагружаются тромбоцитами, вызывая закупорку капилляров, вследствие чего происходит нарушение кровообращения в органах. Под влиянием антител большая часть боррелий погибает. Однако в связи с особенностью строения генетического аппарата происходит вариация антигенного состава боррелий. Это является результатом того, что часть генов, кодирующих антигены, локализована на разных плазмидах и находится периодически в неактивной молчащей форме. В результате межгенных перегруппировок происходят активация молчащего гена и появление нового антигенного варианта, а так как антитела были выработаны к одному определенному варианту, то новые антигенные варианты боррелий размножаются и вызывают рецидив заболевания. Это повторяется от 3 до 20 раз. Прогноз эндемического возвратного тифа благоприятный. Летальность при эпидемическом возвратном тифе не более 1%. Иммунитет. Иммунитет к эпидемическому возвратному тифу гуморальный непродолжительный. В эндемических очагах коренное население к возбудителю эндемического возвратного тифа, циркулирующего в очаге, располагает иммунитетом. Микробиологическая диагностика. Используют бактериоскопический метод: исследование крови больного на высоте приступа лихорадки путем окрашивания толстой капли крови по Романовскому-Гимзе или темнопольную микроскопию висячей капли крови. Биопробу ставят для дифференциации B. recurrentisот возбудителей эндемического возвратного тифа: морские свинки легко заражаются возбудителями клещевого возвратного тифа, а белые мыши и крысы - B. recurrentis.В качестве вспомогательного используют серологический метод с постановкой ИФА и непрямой РИФ. Лечение. Применяют этиотропную антибиотикотерапию (антибиотики тетрациклинового и пенициллинового ряда). Профилактика включает борьбу с переносчиками и с завшивленностью населения. Специфическая иммунопрофилактика отсутствует. 16.8.3. Лептоспиры (род Leptospira) Лептоспироз - острая зоонозная природно-очаговая инфекция, с преимущественным поражением капилляров печени, почек и центральной нервной системы, сопровождающаяся развитием интоксикации, геморрагического синдрома и желтухи. Возбудителем лептоспироза являются различные серовары вида L. interrogansрода Leptospiraсемейства Leptospiraceae,класса Spirochaetes. Морфология. Лептоспиры - тонкие спирохеты размером 0,07-0,15x24 мкм с изогнутыми концами. Двигательный аппарат представлен идущими от каждого полюса клетки по одной фибрилле. Число завитков 20-40. Слабо окрашиваются анилиновыми красителями, поэтому трудноразличимы на препаратах, окрашенных по Романовскому-Гимзе. Легкоразличимы при микроскопии в темном поле и фазово-контрастной микроскопии. Обладают уникальным строением генома - наличием 2 кольцевых хромосом. Культуральные и биохимические свойства. Аэробы. Источником углерода и энергии служат липиды. Каталазо- и оксидазоположительны. Культивируются на питательных средах, содержащих сыворотку или сывороточный альбумин, при 28-30 °С. Растут медленно (лаг-фаза длится 2-8 сут, логарифмическая фаза роста - 3-8 сут). Делятся поперечным делением, цист не образуют. Антигенная структура. Содержат общеродовой антиген белковой природы, выявляемый в РСК, а также вариантоспецифический поверхностный антиген липополисахаридной природы, выявляемый в реакции агглютинации. Таксономическим критерием для лептоспир служит антигенный состав. Основным таксоном является серовар. Известно 250 сероваров, которые объединены более чем в 25 серогрупп. Факторы патогенности. Некоторые серовары обладают липазой, гемолитическими свойствами, продуцируют плазмокоагулазу, фибринолизин, цитотоксины. Резистентность. Чувствительны к высыханию, нагреванию, низким значениям рН, дезинфицирующим веществам. При нагревании до 56 °С погибают в течение 25-30 мин. Кипячение убивает микроб мгновенно. В водоемах сохраняется до 30 дней, во влажных и щелочных почвах - до 280 дней, на пищевых продуктах - 1-2 сут. Эпидемиология. Резервуаром в природе является более 100 видов диких и домашних животных. Непрерывность процесса циркуляции патогенных лептоспир в природе обеспечивается их способностью к колонизации эпителия извитых канальцев коркового слоя почек животных, у которых формируется хроническое носительство. У грызунов лептоспироз протекает всегда бессимптомно, у домашних животных лептоспироз протекает как бессимптомно, так и в хронически выраженной форме. Инфицированные лептоспирами животные выделяют их с мочой, контаминируя окружающую среду. Больной человек является тупиком инфекции и не имеет практического значения как ее источник. Основной путь передачи водный. Возможны также алиментарный и контактный пути передачи. Патогенез и клиническая картина. Инкубационный период 7-10 дней. Входные вороты; слизистые оболочки желудочнокишечного тракта, полости рта, глаз, носа, поврежденные кожные покровы. Проникнув в организм, микроб с кровью разносится к органам ретикулоэндотелиальной системы (печень, почки), где размножается и вторично поступает в кровь, что совпадает с началом заболевания. Возбудитель поражает капилляры почек, печени, центральную нервную систему, приводя к развитию геморрагий в этих органах. Болезнь сопровождается лихорадкой, интоксикацией, желтухой, развитием почечной недостаточности, асептического менингита. Летальность колеблется от 3 до 40%. Иммунитет. После перенесенного заболевания формируется прочный гуморальный серовароспецифический иммунитет. Диагностика. Материалом для исследования служат кровь, моча, сыворотка крови, ликвор в зависимости от стадии заболевания. Для диагностики используют бактериоскопический (обнаружение лептоспир в темнопольном микроскопе), бактериологический, серологический методы, биопробу на кроликах-сосунках и морских свинках и ПЦР. На 1-й неделе заболевания возбудитель можно обнаружить в крови, в период разгара заболевания - в моче и ликворе. В связи с тем что эффективность бактериологического метода ограничена из-за длительности проведения анализа (около 3 мес), ведущее место занимает серологический метод, при котором выявляют в крови антитела, а в биологических жидкостях - антигены лептоспир. Золотым стандартом метода является реакция микропреципитации с эталонным набором живых культур лептоспир по схеме, предложенной ВОЗ. Антитела можно определить с конца 1-й нед заболевания в диагностическом титре 1:100. В качестве экспресс-диагностики на 1-й нед заболевания определяют IgM ИФА и ДНК возбудителя ПЦР. Современными направлениями в лабораторной диагностики лептоспироза является обнаружение антигенов возбудителя при помощи ИФА, РОНГА для ранней диагностики лептоспироза. Лечение проводят введением гетерологичного противолептоспирозного иммуноглобулина совместно с этиотропной антибиотикотерапией. Профилактика. Специфическая профилактика проводится вакцинацией по эпидемиологическим показаниям убитой нагреванием корпускулярной вакциной, содержащей 4 основные серогруппы возбудителя. Неспецифическая профилактика сводится к борьбе с грызунами, проведению зооветеринарных мероприятий и соблюдению личной гигиены. 16.9. Риккетсии (семейство Rickettsiaceae) Порядок Rickettsialesкласса Proteobacteriaдомена Bacteriaобъединяет α1-протеобактерии двух родов семейства Rickettsiaceae (Rickettsiaи Orientia)и 4 родов семейства Anaplasmataceae (Anaplasma, Ehrlichia, Neorickettsia, Wolbachia). Термин «риккетсии», введенный H. da Rocha-Lima (1916) в честь американского исследователя H. Ricketts,описавшего возбудитель лихорадки Скалистых гор, объединяет обширную группу грамотрицательных микроорганизмов, тесно связанных в своей жизнедеятельности с членистоногими. Риккетсии имеют ряд общих свойств: • они являются облигатными внутриклеточными паразитами; • риккетсии не способны к росту на питательных средах; • их биологические свойства связаны с паразитизмом у членистоногих (клещи, вши, блохи); • они имеют ряд особенностей в строении, размножении, биохимических, генетических и иммунобиологических характеристиках; • вызываемые риккетсиями заболевания (риккетсиозы) характеризуются своеобразием клиники и эпидемиологии. Патологический процесс при риккетсиозах обусловлен размножением риккетсий главным образом в эндотелиальных клетках кровеносных сосудов, особенно мелких, и сосудорасширяющим действием токсичных субстанций, что вызывает значительные изменения центральной нервной системы и расстройства кровообращения; • они требуют специальных (риккетсиологических) методов изучения. Генетические исследования свидетельствуют об эволюционном родстве риккетсий и митохондрий эукариотов, наличии у них общего предшественника, давшего начало митохондриям, что сыграло определяющую роль в возникновении эукариотического мира. Митохондрии и современные риккетсии имеют ряд общих свойств (структура генома, морфология, аэробный тип дыхания и особенности метаболизма). 16.9.1. Семейство Rickettsiaceae Семейство включает представителей двух родов - Rickettsiaи Orientia. Среди облигатных внутриклеточных микроорганизмов порядка Rickettsialesособое место занимают представители рода Rickettsiaв связи с их эволюционным родством с митохондриями эукариотов. В состав рода входит 22 вида, которые выделены в две группы: клещевой пятнистой лихорадки (КПЛ) и сыпного тифа (СТ). Содержание Г-Ц в ДНК исследованных видов 30-32,5 мол.%. Типовой вид - Rickettsia prowazekiida Rocha-Lima,1916 (риккетсия Провачека). К группе СТ отнесены R. prowazekii -возбудитель эпидемического, передаваемого вшами сыпного тифа и болезни Брилла и R. typhi- возбудитель эндемического (крысиного или блошиного) сыпного тифа, остальные 18 видов - к группе КПЛ. Два вида входят в так называемую группу предшественников. Возбудитель лихорадки цуцугамуши Orientia tsutsugamushiперенесен из группы цуцугамуши рода Rickettsiaв самостоятельный род Orientia. Микроэкология, круг хозяев и естественного обитания. Экологической микронишей представителей рода Rickettsiaслужит цитоплазма, для ряда из них (риккетсии группы КПЛ) - и ядро эукариотической клетки, где они размножаются свободно, без окружения паразитофорной вакуолью. Этим они отличаются от коксиелл Бернета, представителей семейства Anaplasmataceaeи хламидий, микронишей для которых являются фагосома и фаголизосома. Экологические особенности риккетсий обусловлены их облигатным внутриклеточным паразитизмом с широким кругом филогенетически далеко отстоящих друг от друга хозяев - кровососущих членистоногих (клещей, вшей, блох) и их теплокровных прокормителей - грызунов, насекомоядных, сумчатых, копытных и других млекопитающих и птиц. Риккетсии и риккетсиоподобные микроорганизмы широко распространены среди членистоногих, в том числе у вшей, блох, комаров, клопов, клещей. Принято считать их эндосимбионтами, находящимися в мутуалистических отношениях с хозяевами - членистоногими. Высокая адаптация к организму членистоногих риккетсий, в том числе патогенных для позвоночных животных, позволяет рассматривать их в качестве первичных хозяев риккетсий. Вместе с тем многие виды риккетсий патогенны для человека и животных, что определяет их медицинское и ветеринарное значение. Риккетсии имеют широкий диапазон патогенности и могут быть разделены по этому признаку на три группы: классические патогены, новые патогены и симбионты эукариотических клеток, преимущественно насекомых. К классическим патогенам относятся представители группы СТ (R. prowazekii, R. typhi),а также три наиболее значимых представителя группы КПЛ с широким географическим распространением: R. rickettsii -возбудитель пятнистой лихорадки Скалистых гор, R. conorii- возбудитель марсельской или средиземноморской лихорадки, R. sibirica- возбудитель клещевого сыпного тифа (клещевого риккетсиоза Северной Азии). Кроме того, некоторые патогены группы КПЛ имеют локальные ареалы (R. australis, R. japonica)или их распространение слабо изучено (R. akari). Вторая группа (новые патогены) включает R. slovaca, R. helvetica, R. honei, R. africa, R. mongolotimonae, R. felis, R. aeschlimannii, R. canadensis, R. hulinii, R. heilongjiangensis;заболеваемость инфекциями, вызванными ими, связана с увеличением контактов населения с природными очагами, часто на фоне снижения иммунной резистентности. Риккетсии группы КПЛ - клещевые микроорганизмы с эффективной трансовариальной и трансфазовой передачей. Основными хозяевами риккетсий этой группы являются клещи родов Dermacentor, Rhipicephalus, Haemaphisalis, Ixodes, Amblyomma. Морфологические и тинкториальные свойства. Риккетсии - мелкие плеоморфные микроорганизмы от кокковидных до палочковидных, иногда нитевидные, однако чаще короткие палочки размером 0,3-0,6x0,8-2,0 мкм, у некоторых видов длиной до 4 мкм перед делением клеток. Размножение риккетсий происходит бинарным делением вегетативных форм. Жгутиков и капсул нет, но на электронных микрофотографиях клеток, подвергнутых минимальным лабораторным манипуляциям, виден внешний слой аморфного материала (микрокапсула). Риккетсии - грамотрицательные микроорганизмы, плохо окрашиваются обычными анилиновыми красителями. Удерживают основной фуксин. Наиболее часто применяют модификацию окраски по П.Ф. Здродовскому. При этом риккетсии окрашиваются в ярко-розовый или рубиново-красный цвет, цитоплазма клеток - в голубой цвет, ядра - в синий цвет. Риккетсии имеют сходное с классическими грамотрицательными бактериями строение клетки. При изучении поверхностных структур риккетсий выявлены, как у многих бактерий, волосовидные придатки или фимбрии. С наличием жгутикоподобных образований (актиновых хвостов) связана подвижность. У ряда видов отмечают наличие вегетативных и покоящихся форм. Культуральные свойства. Облигатный характер внутриклеточного паразитизма риккетсий требует для их развития компонентов клеток хозяина. Распространенными методами культивирования служат метод накопления в тканях желточного мешка развивающихся куриных эмбрионов по Коксу и культуры эукариотических клеток в условиях пониженного метаболизма. Для экспериментального воспроизведения инфекции и выделения штаммов патогенных риккетсий применяют различные виды чувствительных к определенным видам риккетсий животных, чаще морских свинок- самцов, хомячков, членистоногих. Особенности физиологии. Риккетсии являются медленно растущими микроорганизмами, размножаются поперечным бинарным делением, время их генерации составляет не менее 8-9 ч. Риккетсии имеют осмотически активную клеточную мембрану, содержащую специфические переносчики для транспорта субстратов. У риккетсий обнаружены ферментные системы, в частности трансаминазы, глютаматоксидазная система, с помощью которых осуществляется в клетке хозяина автономный метаболизм этих микроорганизмов. Наличие системы транспорта АТФ-АДФ и собственного синтеза АТФ при окислении глютаминовой кислоты указывает на два типа использования риккетсиями АТФ. При размножении риккетсии получают АТФ от клетки-хозяина, в ее присутствии ингибируется цитратсинтаза - ключевой фермент цикла Кребса, что сопровождается снижением катаболизма глютаминовой кислоты. При выходе риккетсий из клеток в условиях дефицита АТФ активность цитратсинтазы усиливается, что ведет к активации цикла Кребса и генерации эндогенной риккетсиальной АТФ. У риккетсий отмечается высокое содержание липидов (до 50%) и низкое - углеводов. По высокому содержанию нуклеиновых кислот (до 12%) и наличию в составе как ДНК, так и РНК риккетсии представляют бактериальные организмы. Сходны по химическому составу и клеточные стенки риккетсий и классических бактерий. В них выявлены диаминопимелиновая и мурамовая кислоты, белки, липиды, полисахариды. Однако у риккетсий содержится и глюкуроновая кислота, которая в оболочках бактерий обычно отсутствует. Факторы патогенности. Риккетсии - особая экологическая группа облигатных внутриклеточных прокариотических микроорганизмов, имеющих ряд отличий от классических бактерий в отношениях паразит-хозяин, среди них эндоцитобиоз в эукариотических клетках позвоночных животных и членистоногих переносчиков, отсутствие четких критериев патогенности и классических эндотоксинов. Наряду с патогенными для человека видами риккетсий имеется целый ряд непатогенных видов или видов с неустановленной патогенностью. У риккетсий описана микрокапсула, с наличием которой связывают так называемый механизм реактивации риккетсий (восстановления вирулентности штаммов). Во взаимодействии риккетсий с эукариотическими клетками придается значение фосфолипазе А2 и адгезинам риккетсий, которыми являются поверхностные белки rOmpA (имеют значение преимущественно для риккетсий группы КПЛ) и OmpB (для риккетсий группы СТ и ориенций), а также активной подвижности патогенных риккетсий, связанной с наличием актиновых хвостов. Риккетсии имеют субстанции, обладающие токсическими свойствами, в том числе липополисахарид, фосфолипидные фракции, специфический набор жирных кислот. Токсичность риккетсий и их пирогенное действие связаны преимущественно с поражением риккетсиями эндотелиальных клеток сосудистого русла. Риккетсии обладают гемолитическими свойствами в отношении эритроцитов кролика и барана, гемагглютинином. Риккетсии имеют также аллергенные субстанции, входящие в состав растворимых антигенных фракций. Патогенез и клиническая картина. Заражение людей риккетсиями группы КПЛ обусловлено присасыванием клещей-переносчиков определенных видов. Во входных воротах (на месте присасывания) при большинстве риккетсиозов группы КПЛ (кроме пятнистой лихорадки Скалистых гор) происходит размножение возбудителя в эпителиальных клетках с формированием первичного аффекта. Далее риккетсии распространяются лимфогенно, что может сопровождаться лимфангитом и регионарным лимфаденитом. Дальнейшее гематогенное распространение возбудителя сопровождается генерализованным поражением эндотелия сосудов, в том числе формированием различной выраженности эндоваскулитов и тромбангиитов в сосочковом слое кожи (сыпь). Патологический процесс при риккетсиозах обусловлен размножением риккетсий в клетках-мишенях (главным образом в эндотелиальных клетках кровеносных сосудов, особенно мелких) и сосудорасширяющим действием токсичных субстанций, что вызывает значительные изменения центральной нервной системы и расстройства кровообращения. Имеет место поражение сосудистого аппарата, преимущественно прекапилляров, капилляров и артериол с развитием десквамативно-пролиферативного тромбоваскулита и образованием специфических гранулем в местах паразитирования риккетсий. Этот процесс проявляется постепенным, по мере внутриклеточного размножения риккетсий и гибели инфицированных клеток, развитием инфекционно-токсического синдрома. Возможна не только длительная персистенция риккетсий в организме переболевшего, но и с учетом ангиотропизма риккетсий развитие сердечнососудистой патологии после перенесенного риккетсиоза. Для некоторых риккетсий характерно возникновение рецидивов инфекции, особенно для R. prowazekii(болезнь Брилла-Цинссера - рецидив сыпного тифа). Риккетсии могут взаимодействовать с плазматическими мембранами различных по функциям клеток - эритроцитами, клетками млекопитающих и человека, не являющихся профессиональными фагоцитами (прежде всего эндотелиальными клетками сосудов), а также фагоцитирующими клетками. Взаимодействие риккетсий с непрофессиональными фагоцитами осуществляется в два основных этапа - индукции фагоцитоза и лизиса плазматической мембраны эукариотической клетки при метаболической активности как микроорганизма, так и клетки хозяина. В процессе принимает участие фосфолипаза А и холестеринсодержащие рецепторы клетки. Эндоцитированные риккетсии оказываются в фагосоме. Риккетсии обладают способностью разрушать фагосому до ее слияния с лизосомой и тем самым избегают воздействия защитного механизма клетки, являются цитоплазматическими паразитами. На ранних стадиях заболевания макрофаги также колонизируются риккетсиями и участвуют в распространении возбудителя. Иммунитет. У переболевших риккетсиозами лиц развивается стойкий антитоксический и антибактериальный иммунитет, при сыпном тифе он может быть нестерильным. При риккетсиозах группы КПЛ после перенесенной инфекции создается стойкий иммунитет не только к данному виду риккетсий, но и к другим возбудителям группы КПЛ. При лихорадке цуцугамуши в связи с выраженной гетерогенностью генетических и антигенных свойств возбудителя иммунитет типоспецифический, нестойкий. Возможны повторные заболевания, связанные преимущественно с заражением другими серовариантами ориенций. При риккетсиозах группы КПЛ и СТ, лихорадке цуцугамуши доказано наличие стертых и бессимптомных форм инфекции, связанных как с гетерогенностью возбудителей, так и с неодинаковой резистентностью населения, в том числе наличием популяционного иммунитета. В развитии специфической невосприимчивости ведущее значение имеет клеточный иммунитет в виде ГЗТ, выявляемой с помощью внутрикожных аллергических проб или методов аллергологической диагностики in vitro- реакции торможения миграции лейкоцитов (РТМЛ) и реакции бласттрансформации лимфоцитов (РБТЛ) на специфические риккетсиальные аллергены. Микробиологическая диагностика. Лабораторная диагностика сыпного тифа и других риккетсиозов чаще осуществляется с использованием серологических (РСК, РНГА, реакции непрямой иммунофлюоресценции - РНИФ, ИФА) и молекулярногенетических (ПЦР, определение нуклеотидных последовательностей фрагментов генов) методов. У риккетсий группы КПЛ накопление возбудителя в отдельных клетках не сопровождается их переполнением, риккетсии еще на ранней стадии выходят из клеток без существенных их повреждений с быстрым распространением инфекции клеточной культуры. Дегенеративные изменения клеток обусловлены преимущественно токсическим действием риккетсий. Серологическая диагностика. РСК являлась базовым методом серологической диагностики риккетсиозов. Метод обладает высокой групповой специфичностью даже при низких (1:10-1:20) разведениях сывороток, однако недостаточно чувствителен в ранней фазе заболевания. Комплементсвязывающие антитела при большинстве риккетсиозов групп СТ и КПЛ выявляют в конце 1-й - начале 2-й нед инфекции, в некоторых случаях - в более поздние сроки. Наличие группоспецифического полисахаридного комплекса в составе препарата растворимого антигена для РСК приводит к отсутствию четкой видовой дифференциации внутри групп СТ и КПЛ, хотя титры антител обычно бывают выше к гомологичному антигену. Группоспецифическая диагностика риккетсиозов группы КПЛ в РСК в России осуществляется с растворимым антигеном R. sibirica. Более четкая видовая дифференциация внутри групп осуществляется с помощью корпускулярных антигенов. ИФА применяют для серодиагностики риккетсиозов групп СТ и КПЛ, лихорадки цуцугамуши. По чувствительности и специфичности ИФА сопоставима с РНИФ, однако имеет некоторые преимущества для выявления антител в низких титрах (у вакцинированных, в период поздней реконвалесценции), что можно использовать при ретроспективном эпидемиологическом анализе. РНИФ является золотым стандартом серологической диагностики риккетсиозов. Метод обладает высокой специфичностью и чувствительностью, позволяет выявлять IgM- и IgG-антитела как суммарно, так и раздельно в зависимости от применяемых конъюгатов. При риккетсиозах группы КПЛ и лихорадке цуцугамуши диагностически значимые титры IgM-антител выявляют в конце 1-й нед, IgG-антител - в конце 2-й нед заболевания. Иммуноблот является методом подтверждения стандартных серологических методов диагностики. У риккетсий и ориенций выявлено наличие перекрестно реагирующих эпитопов с протеями (реакция агглютинации Вейля-Феликса с протеями). Однако реакцию Вейля-Феликса с протейными антигенами и варианты реакции агглютинации со специфическими риккетсиальными антигенами в настоящее время не применяют в связи с недостаточной чувствительностью и специфичностью. Существует более чувствительный метод микроагглютинации с меченными флюорохромом риккетсиями для серологической диагностики риккетсиозов группы СТ. В последние годы для диагностики риккетсиозов применяют генетические методы (ПЦР, рестрикционный анализ, определение нуклеотидных последовательностей фрагментов ДНК). Использование методов, основанных на ПЦР, является более рациональным. При этом не только не требуется длительное культивирование микроорганизмов, но часто эти варианты генетического анализа оказываются более чувствительными и специфичными. Лечение. Наиболее эффективными средствами и антибиотико- терапии риккетсиозов, и лихорадки цуцугамуши являются препараты группы тетрациклинов и фторхинолонов. Основные нозологические формы и особенности клинического и эпидемиологического проявления риккетсиозов описаны ниже. 16.9.1.1.1. Возбудитель сыпного тифа Сыпной тиф Антропоноз, при котором циркуляция возбудителя - Rickettsia prowazekii,происходит в паразитарной системе, включающей человека (резервуар) и платяную вошь (переносчик). В организме вши риккетсии размножаются в эпителии кишечника, вызывая его разрушение (несовершенная адаптация) и гибель инфицированных переносчиков. Риккетсии в высоких концентрациях содержатся в фекалиях вшей. Платяная вошь покидает больного хозяина при сыпнотифозной лихорадке и переходит к новому хозяину, что определяет ее роль как переносчика. Механизм передачи - трансмиссивный (контаминация инфицированных фекалий вшей при расчесах). Эпидемическая цепь при сыпном тифе: больной человек → вошь → здоровый человек. Исторически эпидемический сыпной тиф - одна из наиболее значимых эпидемических инфекций, получавших наибольшее распространение в период войн, других социальных и природных потрясений (т.е. на фоне увеличения вшивости населения). Кроме этого с R. prowazekiiсвязана болезнь Брилла-Цинссера - рецидив эпидемического сыпного тифа, возникающий у переболевших через месяцы - десятки лет (эндогенная реактивация возбудителя). При наличии платяных вшей больной болезнью Брилла может явиться исходным звеном эпидемической цепи вспышки сыпного тифа. Клинически острая инфекция носит циклический характер после инкубационного периода, длящегося в среднем 10-12 дней. Она проявляется длительной лихорадкой, появлением в разгар заболевания розеолезной, далее розеолезно-петехиальной или розеолезно-папулезной сыпи, резкими изменениями нервной (до менингоэнцефалита) и сердечно-сосудистой систем, тифозным статусом, наличием осложнений. Болезнь Брилла возникает у ранее переболевших лиц как рецидив эндогенной инфекции. Клиническая картина аналогична таковой при острой форме, но клинические проявления менее выражены. Для диагностики применяют преимущественно серологические методы (РА, РСК, РНГА, РНИФ, ИФА); выделение возбудителя можно проводить только в специализированных риккетсиологических лабораториях (II группа патогенности). Для исследования переносчиков можно применять экспресс-методы - МФА, РНГА с иммуноглобулиновым диагностикумом для выявления риккетсий группы СТ. ДНК возбудителя можно выявлять в ПЦР с последующей идентификацией путем определения нуклеотидных последовательностей ампликона. В настоящее время выявляют преимущественно спорадические случаи болезни Брилла, вспышки возможны при наличии у больного болезнью Брилла и в его окружении платяных вшей (педикулеза). Профилактика. Разработана живая сыпнотифозная вакцина. Однако наибольшее значение применительно к СТ имеют борьба с педикулезом, лабораторное обследование на сыпной тиф длительно лихорадящих больных, особенно из категории риска (завшивленные, бездомные, беженцы и др.). 16.9.1.1.2. Возбудители клещевых риккетсиозов Клещевой риккетсиоз Возбудитель - Rickettsia sibiricaиз группы КПЛ. Клещевой риккетсиоз - облигатно-трансмиссивная природно-очаговая инфекция, передаваемая человеку клещами преимущественно из родов Dermacentor (D. nuttalli, D. silvarum, D. marginatus, D. reticulatus)и Haemaphysalis (H. concinna).Природные очаги распространены в Сибири и на Дальнем Востоке России, в Казахстане, Монголии, Китае. Наиболее активны горно-степные очаги с переносчиком D. nuttalliи лесостепные очаги с переносчиками D. nuttalli, D. silvarum, D. marginatus, D. reticulatus.Более 80% заболеваний приходится на Алтайский и Красноярский края. Механизм передачи трансмиссивный (инокуляция при присасывании переносчика с инфицированной слюной). Клинически заболевание проявляется лихорадкой, первичным аффектом на месте присасывания клеща, регионарным лимфаденитом, розеолезно-папулезной полиморфной сыпью, относительной доброкачественностью течения. В отличие от сыпного тифа, поражаются преимущественно сосуды кожи, а не головного мозга; деструкция эндотелиальных клеток сосудов менее выражена. В типичных случаях диагноз можно ставить клинически, из лабораторных методов чаще применяют РСК со специфическим антигеном. Марсельская лихорадка Риккетсиоз из группы КПЛ, клиническая картина которого в целом схожа с таковой других риккетсиозов этой группы. Характерны относительная доброкачественность течения, появление пятнистой сыпи на ладонях и подошвах и черных пятен, образующихся обычно в месте присасывания клеща (первичный аффект). R. conorii- возбудитель марсельской лихорадки - экологически связан преимущественно с собачьими клещами Rhipicephalus sanguineus,различные фазы развития которых питаются на мелких млекопитающих, ежах, зайцах и собаках. Эпидемиологическое значение имеют контакт с собаками, присасывание клещей (дворовые, синантропные очаги). Марсельская лихорадка распространена преимущественно в Средиземноморском регионе, а также в бассейнах Черного и Каспийского морей, в Африке, Индии и Пакистане. Отмечены генетические и антигенные отличия возбудителя в пределах генокомплекса R. conorii,а также определенные особенности клинического течения вызываемых R. conoriiв различных регионах пятнистых лихорадок. Астраханская пятнистая лихорадка Возбудитель астраханской пятнистой лихорадки - риккетсия, относящаяся к генокомплексу R. conoriiиз группы КПЛ. Переносчиками ее возбудителя являются иксодовые клещи Rhipicephalus pumilio,паразитирующие на различных животных (в том числе на собаках, кошках, ежах). Имаго и особенно нимфы этих иксодид способны присасываться к человеку и передавать возбудителя с пиком заболеваемости в июле-августе. Клинически существенных отличий от марсельской лихорадки не отмечено, преобладают формы средней тяжести, лихорадка, выраженная интоксикация, первичный эффект выявляется редко и с трудом, отмечается выраженная пятнисто-розеолезно-папулезная или геморрагическая сыпь. Для лабораторной диагностики могут быть использованы различные серологические реакции (РСК, РНИФ, ИФА), предпочтительной является РНИФ с высокоочищенными корпускулярными антигенами из штаммов риккетсий астраханской пятнистой лихорадки при начальном разведении сывороток крови 1:40. Очаги эпидемически активны преимущественно в Астраханской области, их существование выявлено на смежных территориях юга России (в Калмыкии, Волгоградской области) и западной части Казахстана. Профилактика. Применяют противоклещевую обработку территорий, меры личной защиты от нападения и присасывания клещей, превентивно назначают антибиотики. |
