2. Химическая связь. 2. Химическая связь
 Скачать 255.82 Kb. Скачать 255.82 Kb.
|
2. Химическая связьОбразование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Химическая связь осуществляется валентными электронами: у s и р-элементов – внешними электронами, у d-элементов внешними ns (n – номер внешнего уровня), и предвнешними (n-1)d электронами, у f-элементов: ns, (n-1)d и (n-2)f. Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования общих электронных пар (Г. Льюис) или образования ионов (В. Коссель). По современным представлениям, химическая связь имеет электрическую природу, но осуществляется она по-разному. Различают три основных типа химической связи: ковалентную, ионную и металлическую. КОВАЛЕНТНАЯ СВЯЗЬ – это химическая связь, осуществляемая обобществленными электронами. Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например в молекулах Н2, Cl2, в кристаллах алмаза), так и между разными атомами. При возникновении ковалентной связи происходит перекрывание электронных облаков атомов, сопровождающееся выделение энергии. Если между сблизившимися до касания атомами водорода расстояние 0,106 нм, то после перекрывания (т.е. после образования молекулы Н2) это расстояние составляет 0,074 нм. В результате возникновения связи между атомами Н, каждый атом достигает конфигурации инертного элемента Не. 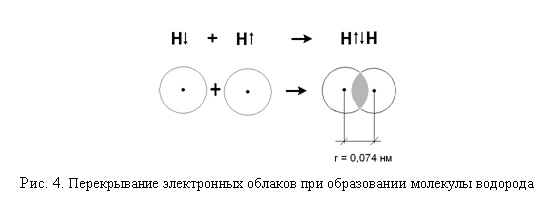 Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Изображение химических связей можно осуществлять по-разному: - при помощи точек, приставленных к химическому знаку: 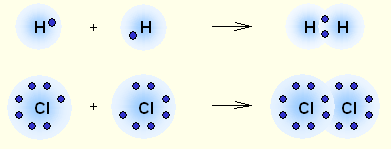 - с помощью квантовых ячеек, как соединение электронов с противоположными спинами в одной молекулярной квантовой ячейке 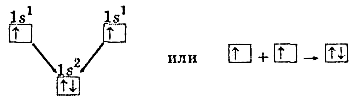 - часто ковалентную связь изображают черточкой, символизирующей пару электронов: 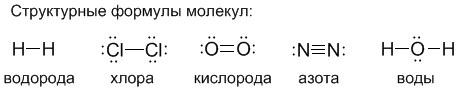 Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной, если больше, то кратной: двойной (2 общие электронные пары), тройной. Химическая связь тем прочнее, чем больше перекрываются атомные орбитали. 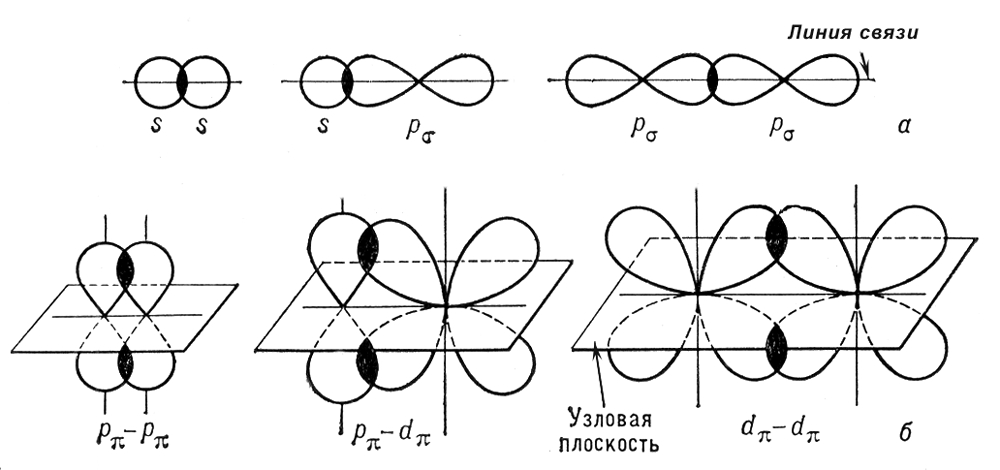 Результирующее электронное облако σ-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующих атомов. Электронное облако π-связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. Источник: http://www.xumuk.ru/bse/2478.html Источник: http://www.xumuk.ru/bse/2478.html Различают 2 разновидности ковалентной связи: полярную и неполярную. В случае неполярной КС электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов. Например, в гомоядерных молекулах Н2, О2, Cl2, F2, N2 и др. электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной КС электронное облако смещено к атому с большей электроотрицательнотью, например: HCl, H2O, H2S. 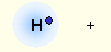    Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора (2,83) больше, чем у Н (2,1). Донорно-акцепторный механизм образования КС В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония NH+4. В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако): 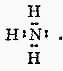 У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить так: □Н+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой: 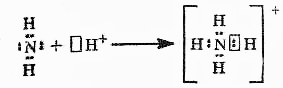 Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором. Гибридизация атомных орбиталей Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами. Гибридизация − это гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам. При образовании молекулы вместо исходных атомных s-, р- и d-элек- тронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Виды гибридизации
 sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов. sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом: находят центральный атом и определяют число σ-связей (по числу концевых атомов); определяют степени окисления атомов в частице; составляют электронную конфигурацию центрального атома в нужной степени окисления; если это необходимо, проделывают то же самое для концевых атомов; изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально спаривают электроны; отмечают орбитали, участвующие в образовании связей с концевыми атомами; определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней; по типу гибридизации определяют геометрию химической частицы. Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном, который и участвует в образовании ковалентной связи. Атом бериллия в невозбужденном состоянии (ls2-2s2) неспаренных электронов не имеет: Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (ls22s12p1): Образовавшийся возбужденный атом Be* обладает двумя неспаренными электронами; электронное облако одного из них соответствует состоянию 2s, другого —2р. При перекрывании этих электронных облаков с р-электронными облаками двух атомов фтора могут образоваться ковалентные связи. Однако, как уже было сказано, при затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sр-орбитали). Форма и расположение этих орбиталей показаны на рис., из которого видно, что гибридные sp-орбитали вытянуты в противоположных направлениях. Перекрывание гибридных sр-электронных облаков атома бериллия с р-электронными облаками атомов фтора изображено на рисунке. Благодаря вытянутой форме гибридных орбиталей достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи. Энергия, выделяющаяся при образовании этих связей, больше, чем суммарные затраты энергии на возбуждение атома бериллия и гибридизацию его атомных орбиталей. Поэтому процесс образования молекулы BeF2 энергетически выгоден. В этой молекуле sр-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Примером молекулы, в которой осуществляется sр2-гибридизация, может служить молекула фторида бора BF3. Здесь вместо исходных одной s- и двух р-орбиталей возбужденного атома бора образуются три равноценные sр2-орбитали. Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах — атомы фтора. Все три связи В − F в молекуле BF3 равноценны. Если в гибридизации участвуют однаs- и три р-орбитали (sp3 - гибридизация), то в результате образуются четыре гибридные sр3-орбитали, вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под углами 109°28' друг к другу. Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана При образовании молекулы воды происходит sр3-гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол НОН в молекуле Н2О (104,5°) близок не к 90°, а к тетраэдрическому углу (109,28°). Небольшое отличие этого угла от 109,28° можно понять, если принять во внимание неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды. В самом деле, в молекуле метана (I): все восемь электронов, занимающие в атоме углерода гибридные sр3-орбитали, участвуют в образовании ковалентных связей С—Н. Это обусловливает симметричное распределение электронных облаков по отношению к ядру атома углерода. Между тем, в молекуле воды(II) только четыре из восьми электронов, занимающих гибридные sр3-орбитали атома кислорода, образуют связи О—Н, а две электронные пары остаются неподеленными, т. е. принадлежат только атому кислорода. Это приводит к некоторой асимметрии в распределении электронных облаков, окружающих атом кислорода, и, как следствие, к отклонению угла между связями О—Н от 109,28°. ИОННАЯ СВЯЗЬ осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь может возникать лишь при больших различиях в значениях электроотрицательностей атомов. Например, ионная связь возникает между цезием и фтором, разница электроотрицательностей у которых составляет более трех единиц. К типичным соединениям с ионной связью относят галогениды щелочных мтеаллов: CsF, CsCl, NaCl. NaCl: ЭО (Na) = 1,01; ЭО (Cl) = 2,83 Na (1s22s22p63s1) Cl(1s22s22p63s23p5). Для завершения электронных уровней атому натрия легче отдать 1 электрон, чем присоединить 7, а атому хлора легче присоединить 1 электрон, чем отдать 7. Опыт показывает, что при химических реакциях атом натрия отдает один электрон, а атом хлора присоединяет. Схематично: Na0 - 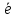 → Na+Cl0 + → Na+Cl0 + 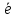 → Cl-. → Cl-.Таким образом, электронная оболочка натрия превратилась в устойчивую оболочку инертного газа Ne, а оболочка атома хлора – в оболочку инертного газа Ar. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение NaCl. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда переходит во владение одного из соединяющихся атомов. Молекулярное электронное облако полностью смещается к атому хлора – это равносильно переходу электрона от натрия к хлору. Очевидно, что полярную связь можно определить как разновидность ковалентной связи, которая претерпела лишь незначительную одностороннюю поляризацию (связующее электронное облако сместилось к атому с большей относительной электроотрицательностью), поэтому полярная ковалентная связь является промежуточной между ионной и неполярной КС. Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина. Предсказать полярной связи можно с помощью относительной электроотрицательности. Чем больше разность, тем сильнее выражена полярность. Δ Э.О. = 0 - связь ковалентная неполярная; Δ Э.О. > 3 – связь ионная (в соединении CsF Δ Э.О. = 3,24); в остальных случаях – ковалентная полярнаяNa0,8+Cl0,8– . МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Из-за низкой энергии ионизации электроны в металле утрачивают связь между отдельными атомами, легко обобществляются, образуя электронный газ – совокупность свободных электронов. Электроны в металле подвижны и легко перемещаются.Металл можно представить как плотно упакованную структуру положительных ионов, связанных друг с другом электронным газом. При этом сравнительно небольшое количество обобществленных электронов связывает большое число ионов. Химическая связь, образующаяся в результате электростатического притяжения между ионами металла и обобществленными электронами, называется металлической связью. Она характерна для металлов, сплавов и интерметаллических соединений. Природа связи – электрическая. Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому все кристаллы с ковалентной связью хрупкие, а с металлической – пластины, т.е. возможно взаимное смещение ионов без нарушения связи. |
