Лекция "Биологическое окисение"_2009. 2010г лекция 4 Тема Биологическое окисление этапы, цикл Кребса, пути использования кислорода в тканях
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
Тема: Биологическое окисление. Механизмы оксигеназного исвободно - радикального окисления веществ. АОЗ клетки.Факультеты: лечебно-профилактический, медико-профилактический, педиатрический. 2 курс. ОКСИГЕНАЗНЫЙ ПУТЬ ИСПОЛЬЗОВАНИЯ КИСЛОРОДА Оксигеназы это ферменты, которые катализируют включение кислорода в молекулу субстрата. Оксигеназы работают в составе мультиферментных комплексов, встроенных в мембрану и участвуют в синтезе и деградации многих типов метаболитов. По способу включения кислорода их делят на: монооксигеназы и диоксигеназы. Монооксигеназные реакции Монооксигеназы это ферменты, которые включают в субстрат только один атом молекулы кислорода. Другой атом кислорода восстанавливается до воды с участием электронов и протонов НАДФН2, НАДН2, реже витамин С: S-Н + О2 + RH2 → S-ОН + Н2О + R (где R = НАДФН2, НАДН2, витамин С) Монооксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР, их называют микросомальным окислением, и на внутренней поверхности внутренней мембраны митохондрии. 1. Микросомальные монооксигеназные системы Катализируют низкоспецифичные реакции. Эти монооксигеназы функционируют в комплексе с различными ЦПЭ: А. Цепь НАДФН2-Р450 редуктаза – Цитохром Р450 Донорами протонов и электронов для этой цепи являются НАДФН2. Субстратами являются гидрофобные вещества экзогенного (лекарства, ксенобиотики) и эндогенного (стероиды, жирные кислоты и т.д.) происхождения. Регуляция активности осуществляется индукцией синтеза ферментов. Открыто более 250 веществ-индукторов (барбитураты, спирты, кетоны, стероиды, ароматические углеводороды). 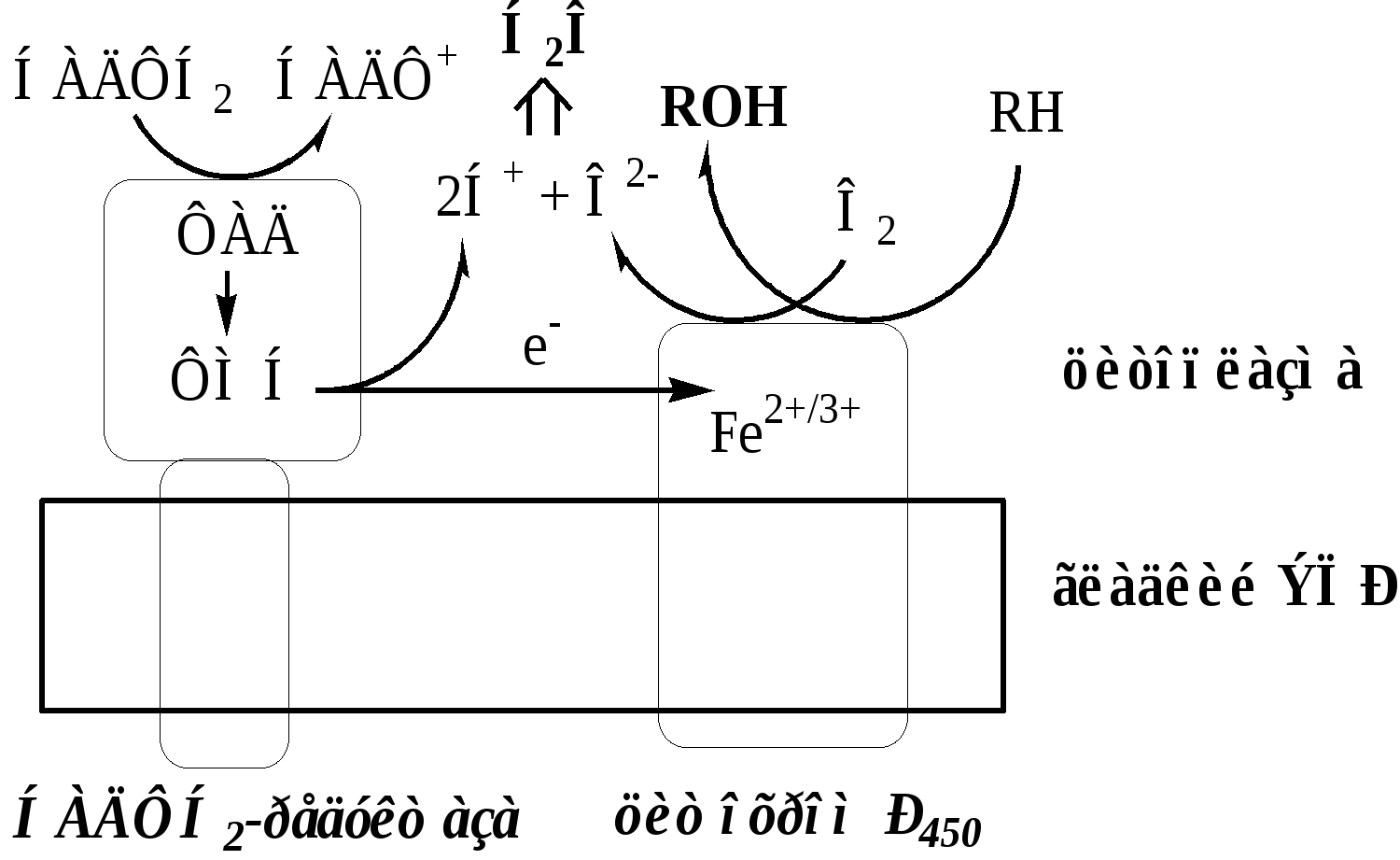 .НАДФН2-Р450 редуктаза. Цитозольный домен содержит 2 кофермента ФАД и ФМН, гидрофобный домен фиксирует фермент в мембране. НАДФН2-Р450 редуктаза переносит электроны с НАДФН2 на цитохром Р450. Цитохром Р450 – интегральный гемопротеин, содержит простетическую группу гем, имеет участки связывания для О2 и субстрата. Открыто 150 генов, кодирующих различные изоформы цитохрома Р450. Каждая из изоформ Р450 имеет много субстратов и отличается от других изоформ Р450 только белковой частью. Цитохром Р450 передает 2 электрона на 1 атом молекулы кислорода, который превращается в О2-, при взаимодействии с 2 протонами О2- дает воду. Второй атом молекулы кислорода включается в субстрат RH, образуя ROH. Б. Цепь НАДН2-цитохром b5 редуктаза – Цитохром b5 – стеароил-КоА-десатураза Донорами протонов и электронов для этой цепи являются НАДН2. 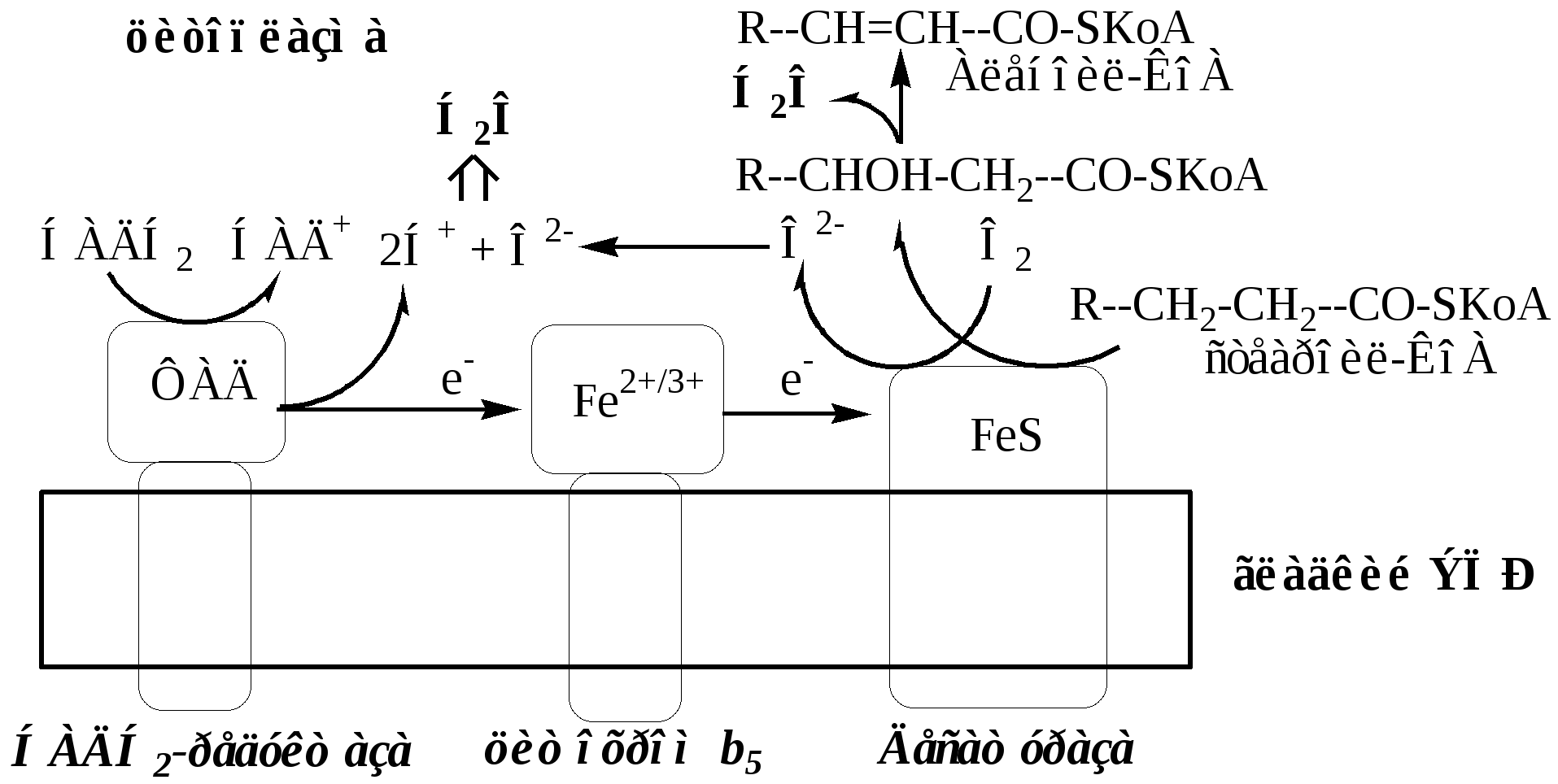 НАДН2-цитохром b5 редуктаза – двухдоменный белок, цитозольный домен содержит ФАД, гидрофобный домен фиксирует фермент в мембране. НАДН2-b5 редуктаза переносит электроны с НАДН2 на цитохром b5. Цитохром b5. Цитозольный домен содержит гем, гидрофобный домен фиксирует фермент в мембране. Цитохром b5 может передавать свои электроны на различные ферменты (цитохромР450, Стеароил-КоА-десатуразу и т.д.), образуя различные ЦПЭ, при этом он участвует в десатурации и элонгации жирных кислот, в синтезе холестерина, плазминогенов и церамида. Стеароил-КоА-десатураза – интегральный фермент, содержит негеминовое железо. Катализирует образование 1 двойной связи между 9 и 10 атомами углерода в жирных кислотах. Стеароил-КоА-десатураза переносит электроны с цитохрома b5 на 1 атом кислород, при участии протонов этот кислород образует воду. Второй атом кислорода включается стеариновую кислоту с образованием её оксиацила, который дегидрируется до олеиновой кислоты. В соединительной ткани монооксигеназы участвуют в гидроксилировании пролина в оксипролин в молекуле коллагена (пролингидроксилазы). Донором протонов и электронов является витамин С. С оксипролином зрелый коллаген приобретает механическую прочность. 2. Митохондриальные монооксигеназные системы Митохондриальные монооксигеназные системы локализованы на внутренней поверхности внутренней мембране митохондрий и катализируют высокоспецифичные реакции. Компонентами этих систем могут быть: НАДН2-зависимые ФАД-содержащее редуктазы, Fe2S2-белки (адренодоксин), цитохромы Р450, b5, элонгазы и т.д. 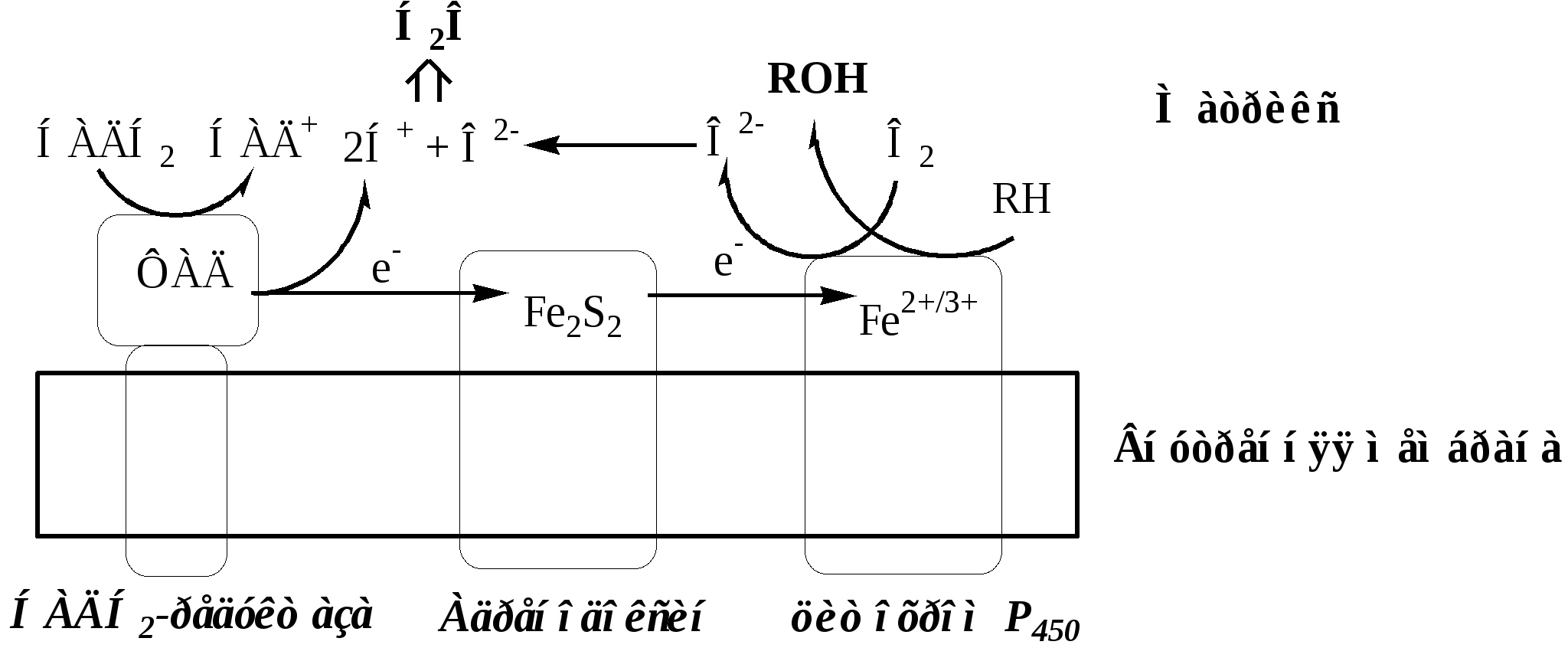 Митохондриальные монооксигеназные системы:
Диоксигеназные реакции Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода: S + О2 → SО2 Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Диоксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР. Гомогентизатдиоксигеназа печени, содержит Fe2+, участвует в катаболизме тирозина: 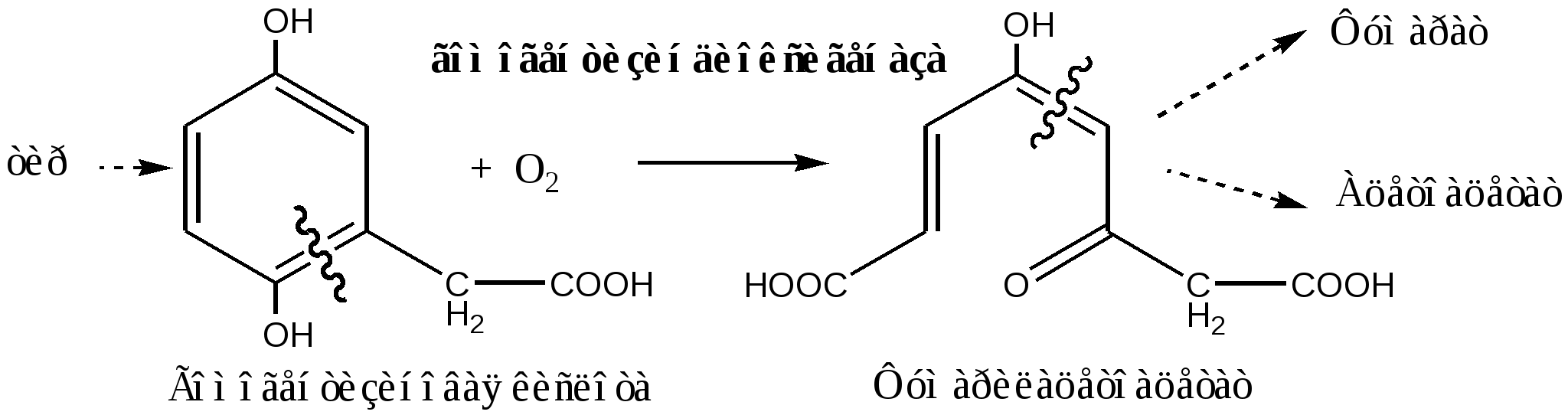 L-триптофандиоксигеназа печени, содержит гем, участвует в катаболизме триптофана: 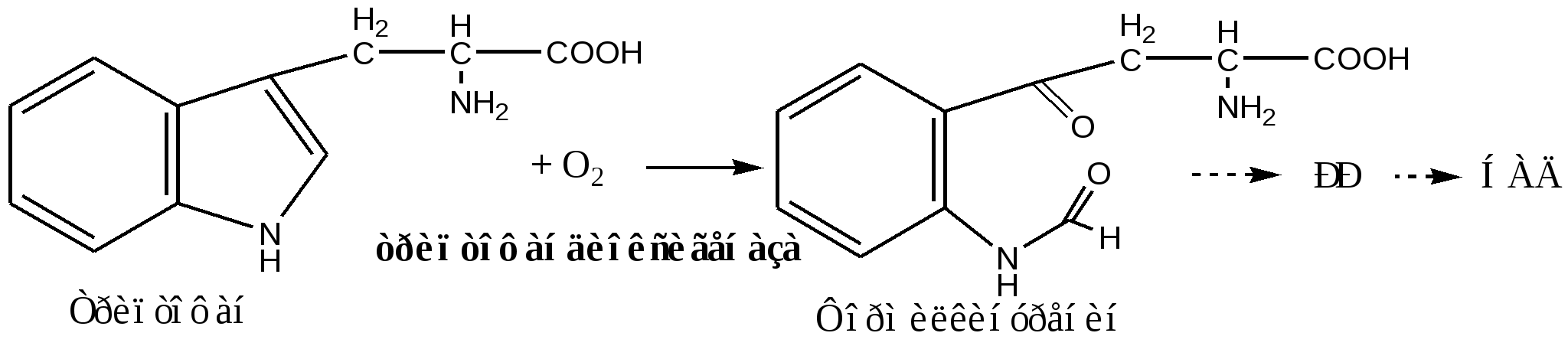 ПЕРОКСИДАЗНЫЙ И РАДИКАЛЬНЫЙ ПУТИ ИСПОЛЬЗОВАНИЯ КИСЛОРОДА Кислород - потенциально опасное вещество. Молекулярный О2 является бирадикалом (˙О::О˙), но он стабилен так как, 2 неспаренных е- внешней орбиты имеют параллельные спины, (подавляют радикальную активность друг друга). Кислород в составе молекулы Н2О стабилен, потому что его внешняя электронная орбита укомплектована е- (Н:О:Н). Химические соединения, в составе которых кислород имеет промежуточную степень окисления, имеют высокую реакционную способность и называются активными формами кислорода (АФК). К активным формам кислорода относятся свободные радикалы кислорода и перекиси. Свободный радикал - свободный атом или частица с неспаренным электроном. Образование активных форм кислорода АФК во многих клетках образуются в основном в ферментативных и неферментативных реакциях в результате последовательного присоединения е- к кислороду:
Ферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать ЦПЭ. Утечка е- из ЦПЭ на кислород является основным путем образования АФК в большинстве клеток:
Неферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать: 1). Металлы переменной валентности. Наличие в клетках Fe2+ или ионов других переходных металлов катализирует образования АФК. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала. Hb(Fe2+) + O2 → MetHb(Fe3+) + О∙2 H2O2 + Fe2+ → Fe3+ + HO- + HO· (реакция Фентона) HOCl + Fe2+ → Fe3+ + Cl- + HO· (реакция Осипова) 2). Радикалы. АФК, обмениваясь электроном, легко переходят друг в друга: О∙2 + Н2О2 → О2 + НО∙ + ОН- АФК также могут образовываться в организме неферметативно при гомолитическом разрыве связей под действием ионизирующего излучения. Ионизирующее излучение вызывает например, радиолиз воды с образованием Н2; Н2О2 и свободных радикалов: Н·, НО∙, О·. Это процесс в основном происходит на поверхности тела - в коже (понятие фотостарения). Свойства активных форм кислорода Кислородные радикалы, обладая высокой активностью, разрушают органические молекулы в реакциях свободно-радикального окисления (СРО). Большая часть этих реакций протекает с полиненасыщенными жирными кислотами липидов, и называется перекисным окислением липидов (ПОЛ). Реакции ПОЛ являются цепными. Наиболее химически активным соединением является гидроксильный радикал - сильнейший окислитель. Время его жизни очень короткое (1 миллиардная доля секунды), но за это время он мгновенно вступает в цепные окислительные реакции в месте своего образования. Супероксидный анион-радикал и перекись водорода более стабильные вещества, могут диффундировать от места образования, проникать через мембраны клеток. Однако, перекись водорода способствует образованию гидроксильного радикала по следующей реакции: Fe2+ + Н2О2 → Fe3+ + НО∙ + ОН- Использование активных форм кислорода в организме 1. Иммунная система. АФК используются фагоцитарными клетками - тканевыми макрофагами, моноцитами и гранулоцитами крови для разрушения бактерий, вирусов и онкоклеток.
При дефиците в клетках СОД, ферритина, а в плазме церулоплазмина, трансферрина активируются альтернативные реакции:
Фактор некроза опухоли 2. Поддержание гомеостаза. Эйказаноиды – медиаторы воспаления 3. Внутриклеточное пищеварение. В пероксисомах образуются АФК. Когда пероксисомы сливаются с фагосомами, АФК обеспечивают внутриклеточное пищеварение. Повреждающее действие активных форм кислорода в организме Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот и липидов биологических мембран. В белках происходит неферментативное окисление аминокислотных остатков гистидина, цистеина, триптофана. Таким образом, инактивируют многие ферменты. Особенно тяжелые последствия имеют повреждение ДНК и липидов. Радикалы НО∙ вызывают разрыв нитей ДНК, обладая, в зависимости от ситуации, мутагенным, канцерогенным или цитостатическим действием. Радикалы гидроксила инициируют цепную реакцию ПОЛ, при этом нарушаются физико-химические свойства мембран - проницаемость, рецепторная функция и работа мембранных белков. Повреждение барьера приводит к нарушению регуляции внутриклеточных процессов и тяжелым расстройствам клеточных функций. Свободно-радикальные реакции часто вызывают гибель клеток и целом ускоряют процесс старения организма. Антиоксидантная система В нормальных условиях процесс СРО находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика. Химические соединения и физические воздействия, влияющие на скорость СРО, делят на прооксиданты и антиоксиданты. Прооксиданты усиливают процессы СРО. Это высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа. Антиоксиданты тормозят СРО. Антиоксиданты, находящиеся в организме, образуют его ферментативную и неферментативную антиоксидантную систему. 1. Ферментативная антиоксидантная система К ферментам, защищающим клетки от действия активных форм кислорода, относят супе-роксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2 Изоферменты СОД находятся и в цитозоле (Cu2+ и Zn2+) и в митохондриях (Mn2+) и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода. СОД — индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется СРО. Каталаза - геминовый фермент, катализирует реакцию разрушения перекиси водорода. При этом образуется вода и молекулярный кислород: 2Н2О2 → H2O+ O2 Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления. Глутатионпероксидаза — обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2 + 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен. Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2: GS-SG + НАДФН2 → 2 GSH + НАДФ+. Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий. Фосфолипаза в мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах. 2. Неферментативная антиоксидантная система "Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол). Витамин Е (α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от СРО. Различают 8 типов токоферолов, но α-токоферол наиболее активен. α-Токоферол отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), а сам превращается в малоактивный свободный радикал, что прерывает ПОЛ: 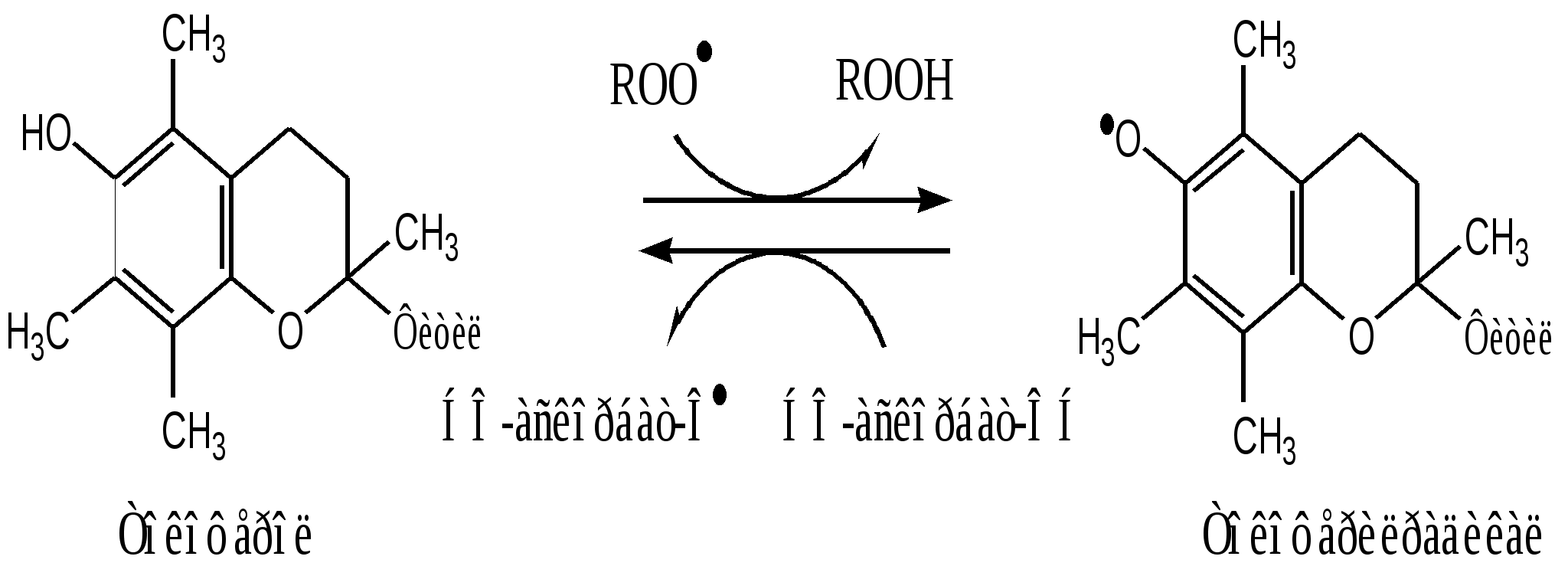 Регенерацию α-токоферола осуществляет витамин С. Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон. 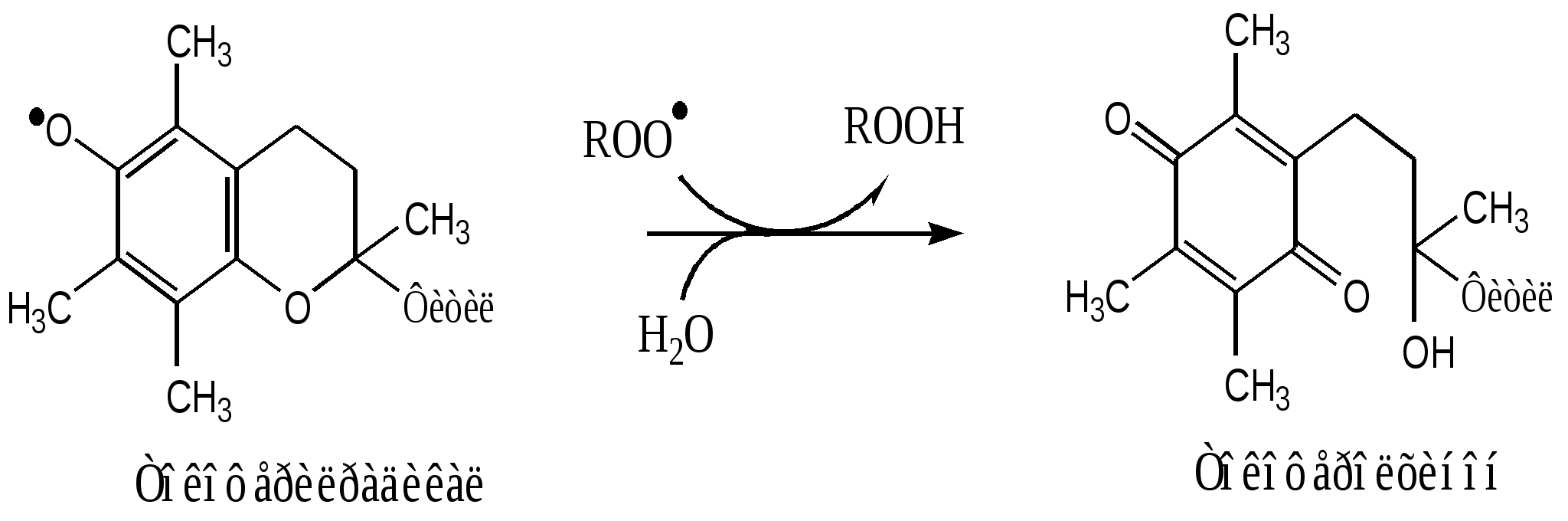 Витамин С ингибирует СРО с помощью двух различных механизмов: 1). восстанавливает в мембранах токоферолхинон до витамина Е: НО-аскорбат-ОН + α-ТФ-О· → α-ТФ-ОН + НО-аскорбат-О· (семидегидроаскорбиновая к-та) НО-аскорбат-О· + α-ТФ-О· → α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та) Регенерация аскорбиновой кислоты идет с участием ферментативных систем: а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохром b5: 2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+ б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы: 2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+ в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы: О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ+ г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы: О=аскорбат=О + 2GSH → НО-аскорбат-ОН + GS-SG 2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙ и инактивирует их. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ. Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону. Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина. Литература:
|
