мбг рк. РК МБГ СҰРАҚ ЖАУАП. 2билет 1 Крделі ауыз
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
|
11БИЛЕТ 1 Аминқышқылы құрылысы Табиғатта кездесетін 200 ден аса аминқышқылының 20 сы ғана нәруыз құрамына кіреді.Нәруыз құрамына кіретін аминқышқылдарының амин тобы да NH2 карбоксил тобы COOH да бір көміртек атомымен байланысқан.Ол көміртек атомы альфа-жағдайы деп аталады.Аминқышқылы молекуласындағы тізбектің құрамына кіретін екінші көміртек атомы бетта,үшінші-гамма,төртінші-эпсилон болып келеді.Нәруыз құрамына тек альфа жағдайындағы аминқышқылы кіреді.Ал қалғандары жасушада реакция аралық қосылыстар түрінде пайда болып,кейбір бактериялар үшін қоректік зат ретінде жұмсалады.Аминқышқылдарындағы бірінші тұрған альфа жағдайдағы көміртек атомын молекуланың «иіні» деп есептесек сол «иінмен» амин топтары карбоксил топтары тікелей байланысқан. Олай болса аминқышқылдары бір-бірімен өзара ұқсас топтар арқылы бекік байланысып,нәруыз молекуласының полипептидтік байланысын түзеді. 2 Транскрипция терминация сатысын сипатта. Транскрипцияның соңғы этапы – терминация немесе транскрипцияның аяқталуы. Терминацияға сигнал болып геннің аяқ жағында Г-Ц бай бөліктері орналасады. Г-Ц байланысы мықты әрі берік болғандықтан ДНҚ –ның екі жіпшесінің ажырауы қиындай түседі де транскрипция аяқталуына акеледі. Синтезделген пре-РНҚ –ның ДНҚ молекуласынан босап шығуын бактерияларда ерекше акуыз Rh-фактор аткарса, эукриоттарда жаңадан синтезделген пре-РНҚ-ның аяқ жағындағы ГЦ бай учаскесіндегі нуклеотидтердің әрекеттесуінен пайда болатын «ілмекшелер» атқарады. 12БИЛЕТ ДНҚ ның бірінші реттік құрылымы Днқ молекуласының полинуклеотид тізбегіндегі нуклеотидтердің реті ұрпақтан ұрпаққа берілетін генетикалық мәлімет. Полинуклеотид тізбегіндегі нуклеотидтердің реттеліп орналасуы ДНҚ молекуласының бірінші реттік құрылымы деп аталады. Нуклеотид тізбегіндегі әрбір мононуклеотидтер өзара 3', 5' фосфодиэфирлік байланыспен байланысқан, яғни бірінші нуклеотид дезоксерибозасының С3 орнындағы ОН тобы келесі мононуклеотидтегі О5 орнындағы фосфор қышқылымен өзара әрекеттесіп фосфодиэфирлік байланыс түзеді. 2) Трансляция ДНҚ молекуласындағы тұқым қуалаушылық ақпараттың экспрессиялануының келесі кезеңі ақуыз биосинтезі яғни трансляция кезеңі. Ақуыз биосинтезі жасушаның тіршілі үшін өте маңызды процесс болып табылады, себебі жасушаның тіршілік үдерістерінде ақуыз молекуласы түрліше қызметтер атқарып, әртүрлі биохимиялық реакцияларға қатынасып, ыдырап жойылып кетіп отырады. Трансляция немесе ақуыз биосинтезі полипептидтің N ұшынан басталып С ұшына қарай жүреді. Ақуыз биосинтезіне рибосоманың екі бөлшегі, а-РНҚ, т-РНҚ, 20 аминқышқылдар, аминоацил-т-РНҚ-синтетаза ферменттері және басқа –да қосымша ақуыз факторлары қатынасады және олар түрліше қызметтер атқарады. а-РНҚ ақуыз биосинтезі үшін матрица (қалып) болып табылады, р-РНҚ лар (5s рРНҚ, 5,8s рРНҚ, 18s рРНҚ, 28s рРНҚ) рибосома бөлшектерінің құрамына кіреді, ал рибосомалар болса цитоплазмада ақуыз биосинтезін жүргізуші органеллалар болып табылады. Рибосомалар гиалоплазмада еркін күйінде (полисомалар) кездесуі мүмкін, оларда ішкі ақуыздар синтезделінеді және мембраналармен байланысқан күйінде кездесуі мүмкін. Бұл жерде «экспорттық», мембраналық және лизосомалық ақуыз молекулалары синтезделінеді. Трансляция немесе ақуыз биосинтезіне еркін аминқышқылдар (жалпы саны 20) қатынаспайды, т-РНҚ лармен байланысқан аминоацил–т–РНҚ күйінде қатынасады. Әрбір аминқышқылдарына сәйкес келетін, оларды тасымалдайтын т-РНҚ-лар болады. Гиалоплазмада кездесетін еркін аминқышқылдар (20) өздеріне сәйкес келетін т-РНҚ–ларға қалай болса солай емін-еркін байланыса алмайды. Ол үшін алғаш аминқышқылдардың активтенуі қажет және бұл үдеріс энергия жұмсауды қажет етеді. Энергия көзі болып АТФ гидролизі саналады. Аминқышқылдарының активтенуін және активтенген аминқышқылдардың өздеріне сәйкес т-РНҚ молекуласының акцепторлық ұшына қондырылуын қадағалайтын, басқаратын ерекше ферменттер–аминоацил–тРНҚ –синтетаза ферменттері болады. Әрбір 20 аминқышқылдарына сәйкес келетін аминоацил-т-РНҚ-синтетаза ферменттері белгілі, демек олардың да соңы -20. Аминоацил–т-РНҚ-синтетаза ферменттерінде 2 танып білуші орталық болады: бірі-аминқышқылдарға, екіншісі т-РНҚ-ға арналған. Аминаацил-тРНҚ синтетаза ферментінің белсенді орталықтары т-РНҚ-ның а-РНҚ кодондарымен әрекеттесуі комплиментарлық және антипаралель принциптеріне сәйкес жүреді, яғни а-РНҚ кодондарының мағынасы 51→31 бағытында жазылған болса, т-РНҚ-ның антикодондары 31→51 бағытында оқылады. Бұл кезде кодонның және антикодонның алғашқы 2 нуклеотидтері бір-бірімен тек комплиментарлы байланысады (А-У және Г-Ц), ал үшінші негіздің байланысуы өзгеше болады: Т-РНҚ антикодонының Үшінші нуклеотиді Ц А У Г И Онымен әрекеттесетін Г У А Г У Ц У Ц А А-РНҚ кодонының нуклеотидтері: а) Егер т-РНҚ антикодонының үшінші нуклеотиді Ц не А болса онда ол тек бір түрлі кодонмен байланысады (Ц-Г; А-У); б) Ал, егер т-РНҚ антикодонының үшінші нуклеотиді У не Г болатын болса, ол 2 түрлі А У кодондармен байланыса алады (У Г ) Г ; Ц . в) Ал егер антикодонның 3 нуклеотиді инозин (И) болатын болса, онда ол 3 түрлі кодонмен жұптаса алады И-У,Ц,А; Әрбір т-РНҚ-лар аминқышқылдарды біренеше рет тасымалдай алады. Ақуыз синтезі рибосома бөлшектерінің (кіші бөлшегі, үлкен бөлшегі) өзара қосылып, біртұтас органелла пайда етуінен басталады (инициация). Рибосома бөлшектерінің қосылуы белгілі бір тәртіппен жүреді және ол рибосоманың белсенді (актив) орталықтарының қатынасуымен жүзеге асады. Рибосоманың актив (белсенді) орталықтары оның бөлшектерінің (кіші, үлкен) түйісуші беттерінде орналасқан. Біртұтас рибосома пішіні жүрекке ұқсас болады, оның оң жақ бөлігін –кіші бөлшек, сол жақ бөлігін –үлкен бөлшегі құрайды. Екі бөлшектер арасында үлкенді –кішілі қуыстар болады. Осы қуыстарда аРНҚ, пептидил-тРНҚ және кезекті аминоацил –тРНҚ орналасады. Рибосома бөлшектерінің түйісетін беттерінде аталған компоненттердің байланысу орталықтары және пептидтік байланыстарды қалыптастыратын, рибосоманың а-РНҚ бойымен жай жылжып отыруын катализдейтін орталықтар да болады. Сонымен рибосомада 4 белсенді (актив) орталықтар кездеседі: 1) а-РНҚ байланысатын орталық (М-орталық), бұл а-РНҚ-ның 51-трансляцияланбайтын учаскесінің 5-9 нуклеотидіне комплиментарлы 18Ѕ р РНҚ-ның бір учаскесі болып табылады. 2) Пептидил орталығы (П-орталық). Трансляция басталар алдында осы орталықпен инициаторлық аминоацил –т-РНҚ, яғни инициаторлық аминоацил т-РНҚи мет байланысады. Кейінірек П-орталықта өсіп келе жатқан полипептид тізбегіне енді–ғана қосылған пептедил-тРНҚ орналасады. 3) Аминқышқылы орталығы (А-орталық) –бұл орталықпен кезекті аа-т-РНҚ байланысады. 4) Пептедилтрансферазалық орталық (ПТФ-орталық)-полипептидтің аминқышқылдары арасында пептидтік байланыстарды пайда етуші және полипептидті бір аминқышқылына ұзартатын орталық. Осы 4 орталық рибосома бөлшектерінде түрліше орналасқан: кіші бөлшекте–түгелдей М-орталық, А-орталықтың негізгі бөлігі және П-орталықтың шамалы бөлігі орналасқан; үлкен бөлшекте - П және А орталықтардың қалған бөліктері, яғни П-орталықтың негізгі бөлімі, А-орталықтың шамалы бөлімі және түгелдей ПТФ орталығы орналасқан Ақуыз биосинтезінің яғни трансляцияның кезеңдері: Инициация Элонгация Терминация Трансляция немесе ақуыз биосинтезінің иницияциясы Ең алдымен а-РНҚ-ның 51-трансляцияланбайтын учаскесі рибосоманың кіші бөлшегімен (18Ѕ р РНҚ) байланысады. Бұл кезде инициаторлық кодон (АУГ) П-орталық деңгейінде орналасады, әрі қарай инициаторлық кодон мен (АУГ) инициаторлық аа-р-РНҚ (Мет-аа-т РНҚи мет) комплиментарлы байланысады. Ал, соңғысы үлкен бөлшектің П-орталығымен әрекеттесіп рибосоманың екі бөлшегінің біртұтас органеллаға жинақталуын қамтамасыз етеді. Сонымен қатар, трансляция иницияциясы үшін ГТФ және 3 иницияция факторлары-еİF-1, еİF-2, еİF-3, қажет. Бұлардың ішінде еİF-3 рибосоманың еркін кіші бөлшегіне қосылып, оның үлкен бөлшегімен күні бұрын байланысуын болдырмайды және онымен а-РНҚ-ның байланысуына көмектеседі. еİF-2 факторы инициаторлық аа-т РНҚ-ның байланысуын қамтамасыз етеді. Бұл кешен ГТФ-пен де байланысқан. Содан кейін Мет-т-РНҚ и мет, өз орнына, П-орталыққа орналасу барысында ГТФ-ГДФ-ға дейін гидролизденеді. Бұл кезде еİF-3 және, еİF-2 рибосоманы тастап шығып кетеді.Сонымен, белсенді біртұтас рибосоманың жинақталуы, яғни инициаторлық кешеннің түзелуі, бір макроэнергиялық байланыстың үзілуі арқылы жүреді. (ГТФ→ГДФ). Осы кезде бөлінетін энергия үдерістің қажетті бағытта жүруі үшін термодинамикалық стимулы болып табылады. Иницияциядан кейін трансляцияның негізгі кезеңі –элонгация (пептидтік тізбектің ұзаруы) басталады. Ол қайталанып отыратын циклдык сипатқа ие, яғни әрбір кезекті аминқышқылының полипептид тізбегіне қосылуы қайталанып отыратын ұқсас құбылыстардан тұрады. Элонгация циклдарі 3 сатыдан тұрады. а) аа-т-РНҚ байланысуы. Циклдың алғашқы сатысында рибосоманың бос А-орталығы а-РНҚ кодонына комплиментарлы антикодоны бар кезекті аа-т-РНҚ-мен байланысады. Жалпы алғанда бұл инициаторлық аа-т РНҚ-ның П-орталықпен байланысуы сияқты жүреді, яғни ГТФ молекуласы және 2 элонгация факторы (ақуыз) -ЕF -1и, ЕF-1ѕ пайдаланылады. ЕF-1и факторы ГТФ-пен және рибосомаға енген кезекті аа-т РНҚ-мен қосылып кешен пайда етеді. Егер осы аа-т РНҚ-ның антикодоны А-орталықтағы а-РНҚ –ның кодонына комплиментарлы болмаса, кешен бұл жерде тұрақтамай, диффузия жолымен рибосоманы тастап шығады. Ал егер, антикодон а-РНҚ кодонымен комплиментарлы болатын болса кешен ыдырап, оның аа-т-РНҚ-сы А-орталықпен байланысады. ГТФ ГДФ-ке дейін гидролизденеді, ал соңғысы ЕF-1и факторымен бірге босанып шығады да әрі қарай рибосомадан тыс ЕF-1ѕ –пен бірге ГДФ-ның ГТФ-ға айналуына қатынасады және аа-т-РНҚ-ның кезекті молекуласымен байланысады. б) Пептидтік байланыстың түзілуі. Циклдың алғашқы сатысынан кейін рибосоманың П-орталығында пептидил-т РНҚ, А-орталығында аа-т РНҚ орналасқан. Олардың акцепторлық ұштары және аминқышқылдар қалдықтары ПТФ-орталықта болады. Соңғысы, яғни ПТФ орталық пептидил-трансферазалық реакцияны қалыптастырады, яғни екі аминқышқылдар арасында пептидтік байланысты қалыптастырады. ПТФ реакциясы нәтижесінде пептидил 1 аминқышқылына ұзарады. в) Транслокация. Циклдың 3 сатысында а-РНҚ жаңадан түзілген пептидил-т РНҚ-мен бірге бір кодонға солға қарай жылжиды. Осының нәтижесінде П-орталықтағы аминқышқылы рибосомадан шығып кетсе, А-орталықтағы пептидил-т РНҚ П-орталыққа өтеді, А-орталықта а-РНҚ-ның келесі кодоны болады және кезекті аа-т РНҚ–мен комплиментарлы байланысуға дайын. Транслокация сатысына ГТФ және транслоказа деп аталатын элонгация факторы (ЕF-2) қатынасады.Осымен элонгацияның бір циклы аяқталып, келесі циклы басталады. Пептидтік тізбектің бір аминқышқылына ұзаруы үшін 2 ГТФ молекуласының энергиясы жұмсалады. Трансляцияның терминациялануы Трансляцияның аяқталуы туралы сигнал рибосоманың А –орталығына 3 «мағынасыз» кодонның кез-келгенінің –УАА, УАГ не УГА орналасуы болып табылады. Бұл кодонды аа-т-РНҚ емес , терминацияның ақуыздық факторлары (еRF) таниды. Мұндай факторлардың екеуі белгілі, олардың бірі-УАА, УАГ-кодондарын таныса, екіншісі- УАА және УГА кодондарын таниды. еFR факторлары «өздерінің» кодондарын танып пептидил трансферазалық (ПТФ) орталықтың гидролазалық белсенділігін стимулдайды. Осыған сәйкес т РНҚ мен пептид арасындағы байланыс гидролизденеді . Осыдан кейін пептидтік тізбек, т РНҚ және а-РНҚ диссоциацияланып рибосоманы тастап шығады, ал рибосома екі бөлшекке ыдырайды да жаңа полипептидті синтездеуге дайындалады. . 15БИЛЕТ 1.Ақуыздардың атқаратын қызметіне қарай бөлінуі 2.Прокариоттардағы инициация сатысы 1. Ақуыздардың қызметтері Өршіткі қызметін атқаратын нәруыздар - организмдегі химиялық реакцияларды жүзеге асырады. Ферменттер реакцияның жүруін ондаған, жүздеген мың есе тездетеді. Мысалы, қарын сөлінен бөлінетін пепсин ферментін айта аламыз. Тасымалдау- Нәруыздардың бұл тобы әртүрлі маңызды заттарды жасуша ішінде және бүкіл организм бойынша бір жерден екінші жерге тасымалдау қызметін жүзеге асырады.Мысалы, қан нәруызы гемоглобин оттекті қосып алып, оны дененің бүкіл ұлпалары мен мүшелеріне таратады. Ал Альбумин жасушаның энергетикалық шикізаты- май қышқылын тасымалдайды. Қозғалыс қызметін атқаратын нәруыздар Бұлшықеттің маңызды нәруыздары – актин және миозин. Нәруыздардың бұл тобы жасуша мен организмдегі түрлі қозғалыс процестерін жүзеге асырады. Мысалы, талшықтардың қозғалуы. Нәруыздардың жабынды тіректік және құрылыстық қызметі - бұл топқа көптеген нәруыздар жатады.Мысалға, тасбақа сауыты, құс тұмсығы, тырнақ, шаш, тері, ішек пен қантамырларлың қабырғасы осы нәруыздардан құралған. Құрылымдық нәруыздар – микрофибрилдер де осы топқа жатады Қорғаныштық қызмет атқаратын нәруыздар - мысалы, денеге түскен бөгде заттарды зарарсыздандыратын антиденелер- Иммуноглобулиндер жатады. Фибриноген нәруызы қан ұюына қатысады. Бұл жарақаттанғанда қан кетуден сақтайды. Қабылдағыш қызмет атқаратын нәруыздар - әртүрлі сигналдарды қабылдап, оларды өңдеуде үлкен рөл атқарады. Мысалы, родопсин нәруызы жарық сигналдарын қабылдап алып таратады. Коректік заттармен қамтамасыз ететін нәруыздар - мысалы, сүт нәруызы – казеин жасушада аминқышқылына дейін ыдырайды. 1г нәруыз толық ыдырағанда 17,6 кДЖ энергия бөлінеді№ 2.Пркариоттардағы инициация сатысы Прокариоттарда РНҚ-полимераза матрицалық тізбекті тауып, тікелей промотордың құрамындағы белігілі бір нуклеотидтер жұбының қатарын анықтайды – ол «Прибнов бокс» (5´-ТАТААТ-3´қатары). Оны анықтайтын РНҚ –полимеразаның құрамындағы σ(сигма) суббөлшегі болып табылады. Ол қатарлар транскрипция басталатын нүкте алдындағы нуклеотидтерден «-10» және «-35» ара-қашықтықта орналасқан. «-10» ауданында ТАТААТ қатары орналасқан , оны «Прибнов бокс немесе домен» деп атаймыз. «-35» ауданда ТТГАЦА қатары орналасқан , ол ДНҚ тізбегінің біреуінде орналасып, РНҚ полимеразаға қай тізбектен мәліметтерді көшіру қажет екенін көрсетеді. РНҚ-полимераза промотормен байланысып, ДНҚ-ның қос тізбегін алшақтатады. «-10» ауданындағы нуклеотидтердің айналасында «транскрипциялық көзше» пайда болады. Құрылып жатқан РНҚ тізбегіне бірінші болып пуриндік нуклеотидтер А мен Г орналасып, бірінші мен екінші нуклеотидтер арасында алғашқы фосфорлық байланыс түзіліп, 5´-3´ ұшына қарай бағытталады. СОдан кейін 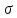 (сигма) суббөлшегі РНҚ-полимеразадан ажырап кетеді. Инициация кезінде 10 жұп негіздерден тұратын гибридті ДНҚ-РНҚ-олигонуклеотид синтезделеді де, транскрипцияның иницаициясы аяқталады. (сигма) суббөлшегі РНҚ-полимеразадан ажырап кетеді. Инициация кезінде 10 жұп негіздерден тұратын гибридті ДНҚ-РНҚ-олигонуклеотид синтезделеді де, транскрипцияның иницаициясы аяқталады. 19БИЛЕТ 1)Екінші реттік құрылымның а,в ширатпасы 2)эукариоттардағы рнк полимеразанын рөлі Екінші реттік құрылым.Пептидтік тізбектің көптеген фрагменттері алғаш а-ширатпада не в-құрылым күйнде болады.Ақуыз молекуласының кеңістікте мұндай қарапайым жинақталуын 2 реттік құрылым деп атайды.Глобулалы ақуыз молекуласында әртүрлі екінші реттік құрылымдар және құрылымсызда учаскелер кездеседі.Осы құрылымдағы полипептидік тізбектің кеңістікте орналасуы бөлінеді: 1)а-спираль 2)в- спираль 1)А-спираль Полипептид тізбегінің қаңқасы ширатылып аминқышқылдардың радикалдары сыртқа қарай бағытталған болады.Бұл құрылым кезінде аминқышқыл негіздері сутектік байланыспен қосылады.Бір спиральды орамға 3,6 аминқышқыл қалдықтары қатысады.Бір байланыстың болуына бір аминқышқылының NH тобы мен екінші аминқышқылының СО топтары қатысады. А-спиральды ақуыздар:миозин,а-кератин 2) в-спираль.Пептидтік тізбектердің негіздері иректелген конфигурациялы немесе бүктелген жапырақ тәрізді болып келеді.Мұнда полипептид тізбегінің қаңқасы ширатпаға ширатылмай ,көптеген ирелеңдеген қатпарларды пайда етеді. Бұл құрылым сутектің байланыспен байланысқан. В-құрылымды ақуыз түрлері:фибрион шелка,в-кератин. 2) Эукариотты РНҚ полимеразаларының үш класы (I, II және III) табылды. Олардың мөлшері прокариоттарға қарағанда әлдеқайда үлкен (молекулалық салмағы 500-600 кДа аралығында). Әдетте, бұл ферменттерде екі үлкен суббірліктер және бірнеше кіші (РНҚ-полимераза II үшін 14 суббірлікке дейін) болады. Эукариотты ядроларда РНҚ-полимеразаның үш мамандандырылған түрі табылды. РНҚ полимеразы I (немесе басқа номенклатура бойынша) ядродағы 18 S және 23 S рРНҚ синтезін жүзеге асырады; РНҚ полимераза II (немесе В) - хабаршы РНҚ синтезі Бұл РНҚ-полимеразаның ең жақсы зерттелген түрі. Транскрипция қатаң бақылауда жүруі керек екендігін ескере отырып, РНҚ-полимераза II промоторлармен байланысуы үшін транскрипция факторларының бүкіл жиынтығын қажет етеді. ТРНҚ, 5S рРНҚ және басқа ұсақ РНҚ синтездейтін РНҚ-полимераза ІІІ. [10] РНҚ-полимеразаның II арнайы тежегіші бозғылт сары токсин а-аманитин болып табылады. РНҚ-полимеразаның әр формасы кД екі үлкен суббірліктен тұрады [c.136] Жоғарыда айтылғандай, эукариоттық РНҚ полимеразалар өздерінің тазартылған ДНҚ молекулаларындағы промоутерлерін танымайды. Бұл үшін ДНҚ-ға бір немесе бірнеше учаскеге тән ақуыздар қосылуы керек. Мұндай белоктар транскрипция факторлары (TF) деп аталады. Олар прокариоттардың сигма факторларынан (а-факторлар) ДНҚ-мен РНҚ-полимеразадан тәуелсіз байланысуы мүмкіндігімен ерекшеленеді. I, II және III полимеразалар сәйкесінше TF1, TFD және TFIII тағайындалған әр түрлі транскрипция факторларының болуын талап етеді. Латын әрпі, әдетте, транскрипция коэффициентінің атауында рим цифрымен жүреді, қай фактор есеп бойынша оқшауланғанын көрсетеді. Эукариоттардағы транскрипция прокариоттық жасушалардағы транскрипцияға қарағанда әлдеқайда күрделі процесс. Үш эукариоттық РНҚ-полимеразалар (1, 11 және 111 полимеразалар) эволюциялық жолмен бактериальды ферментпен байланысты, бірақ олардың құрамында суббірліктер саны көп. 20БИЛЕТ 1.Днқның 3реттік құрылысы Нуклеин қышқылдарының екі түрі белгілі: ДНҚ, РНҚ. Нуклеин қышқылдары—полимерлер, олардың мономерлері болып нуклеотидтер саналады. Нуклеотидтер өз кезегінде 3 бөліктен құралған. Нуклеотидтер молекуласында азоттық негіздердің пуриндік -Аденин (А) не Гуанин (Г); немесе примидиндік - цитозин (Ц), Тимин (Т) не Урацил (У) деген түрлері, қант ретінде - дезоксирибоза не рибоза, 1 фосфор қышқылының қалдығы (монофосфат) кездеседі. Дезоксирибонуклеин қышқылының (ДНҚ) кұрылысы. ДНҚ (дезоксирибонуклеин қышқылы) нуклеотидттері-дезоксирибозадан, азоттық негіздерден, 1 фосфаттан (монофосфат) кұралған, олардың АМФ, д ГМФ, д ЦМФ, д ТМФ деп атайды. ДНҚ молекуласы қосширатпалы болып келеді (Ф. Крик, Д.ж. Уотсон). Оның алғашқы, екінші реттік, үшінші реттік құрылыстары белгілі. ДНҚмолекуласының алғашқы құрылысы-бір жіпшеде нуклеотидгердің (А, Г, Ц, Т) бірізділікпен тізбектеліп орналасуы болып табылады. ДНҚ алғашқы құрылысы фосфодиэфирлік байланыс арқылы тұрақтанады, яғни бір жіпшедегі нуклеотидтер бір-бірімен фосфаттық топ және қанттың гидроксил тобы арқылы байланысқан. ДНҚ молекуласының екінші реттік кұрылысы оның екі жіпшесіндегі азоттық негіздердің бір-бірімен сутектік байланыс арқылы комплиментарлы байланысуы (А-Т; Г-Ц) болып табылады. ДНҚ жіпшелері полярлы болады, яғни оның 5' және З1 ұштары белгілі. ДНҚ молекуласының қосширатпасы (тізбектері) бір-біріне антипараллель орналасқан; (51) ... АТТГАЦГГЦ ......(З1) (З1) ... ТААЦТГЦЦГ.......(51) Қос ширатпаның бір оралымында 10 жұп нуклеотидтер кездеседі, ал оралымның ұзындығы 3,4 нм тең. Сонымен қатар, А-Т арасында 2 сутектік байланыс болса, Г-Ц арасында 3 сутектік байланыс болады, сондықтан-да Г-Ц байланысы, А-Т байланысына қарағанда әлде қайда мықтылау болып келеді. ДНҚ молекуласының 3 реттік құрылысы ретінде оның ақуыздармен (гистондық ақуыздармен) байланысын айтуға болады. Хромосома ақуыздарының 60-80 пайызын негіздік және гидрофобтық аминқышқылдар (аргинин, лизин, валин, т.б.) көптеп кездесетін гистондық ақуыздар құрайды. Гистондық ақуыздар ДНҚ-мен негіздік радикалдар көмегі-мен, ал өзара гидрофобтық радикалдар арқылы әрекеттеседі. Хромосомаларда ДНҚ молекуласы гистондық ақуыздармен байланысып нуклеогистон құрайды, ол хроматин жіпшесі ретінде белгілі. Хроматин жіпшесінің тірегін нуклеосома денешіктері құрайды. Ол 4 түрлі гистондық ақуыздардың-гистон Н2А, гистон Н2в, гистон 3, гистон 4-(Н2а, Н,в, Н,, Н4) қос молекуласынан құрылған. Осындай әр бір денешікті ДНҚ молекуласы екі рет ширатылып оралады және оның ұзындығы 140 н.ж. тең. Нуклеосома денешіктері бір-бірімен тығыз жабысып орналаспай біршама алшақтау орналасқан. Нуклеосома денешіктерінің араларындағы ДНҚ учаскелерін линкерлік (жалғаушы) учаске деп атайды, ал әрбір линкерлік учаскемен гистондық ақуыздың 5-ші түрі - HI байланысқан. Хроматин жіпшесінде ДНҚ өте көп, 600.000-ға жуық, нуклеосома денешіктерін түзеді. Үзындығы 190 см жететін ДНҚ молекуласының өлшемі жағынан микроскопиялық, бірнеше микрометрге -180 мкм. тең, 46 хромосомаларда тығыздалып, ширатылып орналасуына нуклеосома денешіктері мүмкіндік береді. Хроматин жіпшелері митоз кезінде әрі карай ширатылып, қатпарланып, тығыздалып митоздық хромосомаларды туғызады. Митоздық хромосомаларда хроматин жіпшелері хромосоманын ұзына бойына көптеген рет қатпарлар пайда етеді (кейбір деректер бойынша 100 ретке дейін), осының нәтижесінде барлык хромосомалардың ұзындығы (180 мкм) ДНҚ молекуласының үзындығынан 100.000 есеге кем болады. Сонымен қатар нуклеосомалар күрылымдық (хроматин тірегі), реттеуші қызметтерді де атқарады. ДНҚ молекуласының бойында тұкым қуалаушылық ақпарат жазылған, ол негізінен (95%) ядрода, ал 5% цитоплазмада-митохондрияларда, хлоропласттарда шоғырланған. 2. Клеткалық циклда ДНК репликациясының алатын орны Жасушаның тіршілік циклі немесе митоздық айналым деп жасушаның пайда болуы, құрылысының күрделенуі, атқаратын қызметіне икемделуі, бөлінуі немесе тіршілігін жою кезеңдері аралығындағы әртүрлі құбылыстар жиынтығын айтамыз. Яғни жасуша циклі дегеніміз жасушаның митоздық екі бөлінуі арасындағы байқалатын құбылыстар жиынтығы. Ол 4 кезеңге бөлінеді: Пресинтетикалық G1 2п 2с Синтетикалық S 2п 4с Постсинтетикалық G2 2п 4с Митоз M 2п 2с Пресинтетикалық кезеңде жаңадан пайда болған жас жасуша өсіп аналық жасушаның мөлшеріне жетеді. Ол үшін жасушада құрылыс материалының(көмірсу,май және белок) синтезделуі қажет. Синтетикалық кезеңде ДНҚ молекуласы синтезделінеді де тұқым қуалаушылық материал 2п 4с күйінде кездеседі. Постсинтетикалық кезеңде жасуша бөлінуге дайындалады. Ол үшін жасушада көмірсу, май және белоктар синтезделіп, олардың қоры көбее түседі, органеллалар саны да көбееді,себебі келесі кезеңде (митоз) олардың бәрі де екіге бөлінуі қажет. Митоз - жасушаның бұрыс бөлінуі. Митоз дене жасушаларында байқалады. Митоз процессінде ядро күрделі өзгерістерге ұшырайды, жаңадан пайда болған жасушаларға тұқым қуалаушылық материалы тепе-тең бөлініп беріліп отырады. G1-Жасушалары қазір ғана бөлінген жас жаушалар, ағзалардың қалыпты санын қалпына келтіру. S-Синтетикалық кезең. Мұнда ДНҚ синтезі-оның репликациясы жүреді, яғни хромосомалар екі еселенеді. Sкезеңінің соңына қарай жасушаның барлық хромосомалары ДНҚның екі молекуласынан хромотидтерден тұрады. Репликация нәтижесінде түзілген екі хромотидтің бір хромосомасы бір-бірімен центромерге қосылған. Басқа қажетті заттардың: ферменттердің, АТФның, жиырыллғыш нәруыздың және т.б да синтезі қатарласа жүреді. G2-жасушалардың бөлінуге дайындығы. Бөлінуге қажетті құрылымдардың қалыптасуы- жиырылғыш нәруыздардың жинақталуы, олардың бөліну шүйкесі түзіледі. Жасушалар көлемінің ұлғаю үдерісі, яғнм өсуі жалғасады. 21БИЛЕТ 1.Рибосомалық РНҚ. Олар жасушадағы барлық РНҚ-лардың 80 % жуығын құрайды . Рибосомалық РНҚлар ядрода синтезделгенімен негізгі қызмет атқаратын орны – рибосомаларда. Рибосомалық РНҚ-лар рибосома субъединицаларының (үлкен және кіші) құрамына кіреді. Эукариоттық жасушаларда р-РНҚ-ның төрт типі ажыратылады : 28S pРНҚ, 18S рРНҚ , 5,8S рРНҚ және 5S рРНҚ. Бұлардың үшеуі: 28S, 5,8S, 5S р-РНҚ-лар және 45 ақуыз молекулалары рибосоманың үлкен суббірлігінің 60S құрамына, ал 18S рРНҚ және 30 ақуыз молекулалары рибосоманың кіші суббірлігінің 40S құрамына кіреді . Үлкен және кіші суббірліктер қосылып тұтас (80s) рибосома молекуласын құрайды. Прокариоттардың 23S; 16S ; 5S рРНҚ-ны анықтайтын гендерінің кластерлері бір оперон құрып, тұтасымен бір қызмет атқарып, бақыланады. Эукариоттар жасушасындағы р-РНҚ-ның синтезін бақылайтын гендер мультигендік тұқымдастар құрып хромосоманың ядрошық ұйымдастырушы аймағында орналасады. Жасушада мұндай гендердің саны 5-тен 300-ға дейін ауытқиды , және олардың ядрошық ұйымдастырушы аймақта ұзына бойы орналасуы біркелкі емес. рРНҚ синтезінің басталуы үшін РНҚ-полимераза 1-ді геннің промоторлық учаскесіне жалғайтын инициация факторының болуы қажет. Транскрипция жүріп, оның бірінші реттік өнімінің синтезделуіне рРНҚның барлық үш генімен бірге гендер арасындағы спейсерлік учаскелер де қатынасады . Синтезделіп түзілген бірінші реттік өнім процессинг нәтижесінде функциональдық активті жетілген р-РНҚ молекулаларына 18 S ; 5,8 S ; 28 S pРНҚ-ларға айналады . 5S рРНҚ-ға жауапты ген ядрошық ұйымдастырушы аймақтан тыс орналасқан . Р-РНК, молекуласынын ерекшелігінің бірі-гуанин (Г) және цитозин (Ц) сиякты азоттық негіздерінің мөлшерінің баскаларына карағанда әлде қайда көп болуы. Сонымен катар минорлык нуклеотидтер де жиі кездеседі, мысалы рибоза бойынша метилденген нуклеозидтер. Р-РНҚ-ның екінші реттік құрылымында қостізбекті учаскелер және ілмекшелер де көптеп кездеседі. 2.Генетикалық код – дегеніміз тұқым қуалаушылық ақпараттың, яғни 20аминқышқылдар туралы ақпараттың, ДНҚ молекуласындағы 4 нуклеотидтер ( А, Г, Ц, Т) арқылы қысқаша жазылу,сақталу және жүзеге асу жүйесі болып табылады. ДНҚ молекуласының екі тізбегі бір- бірінен қызметтік рөлі жағынан ерекшеленеді:олардың біреуі-кодтаушы немесе мағыналы, ал екіншісі - матрицалық (қалып) тізбектер болып табылады. ДНҚ молекуласындағы ақпараттың өлшем бірлігі болып триплет саналады, яғни 3 нуклеотид бір аминқышқылын анықтайды. 1954 жылы Американ ғалымы Г.Гамов теория күйінде генетикалық код 3 нуклоетидтерден тұруы мүмкін деген болжам айтқан. 1961 жылы Ф.Крик генетикалық код триплетті болатынын тәжірибе жасап дәлелдеді, яғни лабораториялық жағдайда 3 Урацилдің УУУ фенилаланин аминқышқылын анықтайтынын көрсетті. ДНҚ молекуласының кодтарына сәйкес келетін а-РНҚ триплеттерін кодондар деп атайды. 1964 ж. М.Ниренберг С Очао , Х.Хорана т.б еңбектерінің нәтижесінде барлық 64 кодонның мағынасы анықталып, олардың негізгі қасиеттері белгілі болды. 64 кодонның 61 – мағыналы кодондар, яғни 20 аминқышқылының біреуін анықтайды, ал 3- еуі УАА, УАГ,УГА мағынасыз кодондар, яғни ешқандай аминқышқылын анықтамайды,олар ақуыз синтезінің аяқталуын бақылайды, сондықтан оларды – стопкодондар, кодон терминаторлар деп те атайды. Генетикалық код, қасиеттері 1.Генетикалық код әмбебапты болады,яғни кодондар барлық тірі ағзаларда бірдей аминқышқылдарын анықтайды. 2.Генетикалық код коллинеарлы (сайкес) болады,яғни нуклеин қышқылдарындағы ( ДНҚ, РНҚ ) нуклеотидтер бірізділігі полипептид молекуласындағы аминқышқылдар бірізділігіне сәйкес болады. 3.Генетикалық код артық (вырожденный) болады,яғни әрбір аминқышқылы 2-6 кодон арқылы анықталады,тек метионин және триптофан аминқышқылдары Бір ғана кодон арқылы анықталады. Бір аминқышқылдарының кодондары бір-бірінен үшінші нуклеотидтеріарқылы ерекшеленеді, мысалы: серин кодондары УЦУ,УЦЦ,УЦА,УЦГ. 4.кодондар а- РНҚ тізбегінде бірінен кейін бірі үзіліссіз – үтірсіз, нүктесіз,бірізділікпен орналасады. 5.кодондар а –РНҚ тізбегінде бірін- бірі бастырмаламай орналасады. 6.кодандар нақтылы болады,яғни әрбір мағыналы кодондарға бір аминқышқылы сәйкес келеді 7.Кодондар триплетті ( 3 өрімді) болады. 22БИЛЕТ Приондар дегеніміз не Белгілі бір ақуыздың заңды түрде қайталанатын бұрыс фолдингі нәтижесінде дамитын өте зілді бір топ неврологиялық аурулар белгілі.Осы ақуызды, егер ол қалыпты конформацияда болатын болса,приондық ақуыз Pr Pc prion protein constitutive деп атайды. Ол мида табылған бірақ өызметі белгісіз. Кейбір ауру адамдарда осы полипептид басқа конформацида, яғни құрамында табиғи құрылымында болмайтын B – учаскелері көптеп кездесетін және агрегациялануға ынталы формада болады.Мұндай , өзгерген ақуызды прион proteinaceous infection particle деп атайды жәнен ол Pr Psc деп бейнеленеді. Ақуыздардың осындай бұрыс формасы басқа дұрыс формадағы ақуыздарды бұзып бұрыс формаға айналдырады. Сонымен приондар өздернің бастапқы молекулалары үшін антишаперондар қызметін атқарады және бұл үдеріс автокатализ күйінде жүреді, яғни бұзылған ақуыз келесі қалыпты ақуыздарды бұза жүреді, ақырында барлық ақуыз бұзылған күйге көшеді. Бұл үдеріс баяу жүреді, ауру бірнеше жыл ішінде дамиды, бірақ міндетті түрде жануарлармен адам ағзасының дүние салуына алып келеді. Ағзада приондардың алғашқы порциялары қалай пайда болады Өздігінен фолдинг қателігі нәтижесінде. Прион ақуызы геннің Pr P мутациясы салдарынан. Бұл кезде ауру тұқым қуалайды. Приондар кездесетін жануарлардың сиыр етін жегенде. Приондар – протеозалар әсерлеріне өте төзімді болады, сондықтан олар ас қорыту жолында бұзылмай нерв ұлпасына өтеді де өздерініңжағымсыз қасиеттеріне кіріседі. Приондар нуклеин қышқылы болмайтын бірегей инфекциялық агент болып саналады. Приондар – сиырлардың ерінді энцефалопатия немесе сиыр құтыруы ауруын туғызады. Егер адамдар осы сиырдың етін жесе , онда оларда Крейнцфельд- Якоб ауруы деп алалатын сырқат дамиды. Жаға Гвинеяның жергілікті тұрғындарының – күру ауруы да приондық ауруларға жатады. 2. Ақпаратты РНҚ пост транскрипция кезең сипаттаңыз Пре – РНҚ – лардың пісіп жетілуі – процессинг Пре –РНҚ молкуласының пісіп жетілуі 3 кезеңге бөлінеді. Кейбір нуклеотидтердің алынып тасталуы. Кейбір нуклеотидтердің жалғануы Олардың модификациялануы. Артық нуклеотидтердің алынып тасталуы ерекше нуклеозалар арқылы жүзеге асады.Экзонуклеазалар тізбектің бір ұшынан 31 не 51 бір бірлеп нуклеотидтерді алып тастайды, алэндонуклеазалар тізбекті бөлшектеп оны жеке- жеке фрагменттерге бөледі. Нуклеозалар тізбек ұштарынан артық нуклеотидтерді үзіп отырады.Мысалы пре –РНҚ ның 51 ұшында үнемі АТФ не ГТФ, ал 31 ұшында ГЦ – бай учаскелері болады. Сонымен бірге тізбек ұштарынан спейсерлік нуклеотидтер бірізділігі үзіліп алынып тасталады.Бұл – эндонуклеозалардың арқылы жеке РНҚ тізбектеріне кесіледі. Сонымен пре РНҚ молекуласының пісіп жетілуі процессинг барысында оларда көптеген нуклеотидтер транскрипциясыз байланысады. Пре – а-РНҚ – ның 51 ұшына қалпақшаның КЭП 7- метилгуанин және басқа да 3-4 нуклеотид қосылып жалғанады,ал 31 ұшына 200 – дей нуклеотидтен тұратын поли А – фрагмент қосылады. Бұл үрдісті полиаденилатполимераза ферменті катализдейді. Пре –РНҚ ның пісіп жетілуі процессинг маңызды құбылысы олрдың құрамында модифмкацияланған нуклеотидтердің пайда болуы. Пре а РНҚ да қалпақша нуклеотидтерінің рибоза қалдықтарының метилденуі байқалады. Жоғарыда сипатталған құбылыстар ядрода бірнеше пісіп жетілген РНҚ молекулалаларының пайда болуына алып келеді.Мыс: Мыңдаған аРНҚ молекулаларының түзілуіне. 23БИЛЕТ 1957 жылы Мезельсон, Болат және Джером Виноградта макромолекулалардың молекулалық салмағын және ішінара нақты көлемін (мысалы, ДНҚ) зерттеудің жаңа әдісі — тығыздық градиентіндегі тепе-теңдік ультра Центрифугалау туралы мақала жарияланды[en] [6]. Бұл әдіс ДНҚ молекулаларын олардың тығыздығы бойынша бөлуге мүмкіндік береді: әр молекула ерітіндінің тығыздығы оның өзгермелі тығыздығына сәйкес келетін градиент орнында тоқтайды. Авторлар бұл әдісті 14n және 15N азот изотоптары бар ДНҚ молекулаларын бөлу үшін қолданды . 15N радиоактивті емес, тек 14n-ден ауыр. Ауыр изотопы бар ДНҚ молекулалары Функционалды және екі есе артады. Мезельсон мен Болат Escherichia coli бактерияларының бірнеше ұрпағын 15N немесе 14n-ге бай ортада өсіріп, содан кейін олардың ДНҚ-ны цезий хлоридінің тығыздық градиентінде центрифугалау арқылы 15N-ДНҚ 14n-ДНҚ-ға қарағанда центрифугалық түтіктің түбіне жақын тоқтайтынын көрсетті. Репликация механизмін құру үшін бірнеше ұрпақ ішінде 15N бар ортада өскен E. coli (демек, олардың ДНҚ-сы тек 15N) 14n бар ортаға көшірілді, онда оларға тек бір рет бөлісуге рұқсат етілді. Осы жасушалардан оқшауланған ДНҚ тығыздығы 14n-ге бай ортада өсетін бактериялардың ДНҚ тығыздығынан жоғары болды, бірақ 15N ортада өсетін бактериялардың ДНҚ тығыздығынан аз болды. Бұл ДНҚ репликациясының консервативті сипаты туралы гипотезаға қайшы келді, онда ДНҚ жоғары және төмен тығыздығы бар екі фракцияға бөлінеді, бірақ аралық емес. Осылайша, алғашқы гипотеза алынып тасталды . Алайда, нәтиже репликацияның дисперсті механизмін жоққа шығармады, онда аналық ДНҚ бөлімдері аналық ДНҚ бөлімдерімен ауысады. Дисперсті репликация гипотезасы бойынша бактериялардың ДНҚ тығыздығы барлық молекулалар үшін бірдей болуы керек және бірінші буын жасушаларының ДНҚ тығыздығы мен ең жеңіл ДНҚ тығыздығы арасында аралық орын алуы керек. Алайда жасушаларда ауыр ДНҚ (бірінші буын) және гибридті ДНҚ (екінші буын) бірдей мөлшерде болатындығы белгілі болды. Бұл факт дисперсті репликация механизмінің гипотезасын жоққа шығарды . Ақуыз биосинтезі немесе Трансляция. Бұл - өте маңызды үдеріс. Мұнда ДНҚ, РНҚ, АТФ және нәруыздардың қызметі бірігеді. Биологиялық маңызы: Жасушаның тіршілік үдерісіне, әр түрлі биохимиялық реакцияларға қатысып, ыдырап жойылып отырады, ал олардың орнын толтыру ақуыз молекуласының жаңадан синтезделінуі арқасында жүзегі асады. Ақуыз биосинтезі полипептидтің N ұшынан басталып C ұшына қарай жүреді. Ақуыз биосинтезіне: Рибосома, а-РНҚ, т-РНҚ-лар, 20 аминқышқылдары, аминоацил-т-РНҚ синтетаза ферменті, ақуздық факторлар қатысады. ДНҚ-да жазылған тұқым қуалау акпараты РНҚ-ның ақпараттык (аРНҚ) молекулаларымен цитоплазмаға беріліп, арнайы органоидтар — рибосомалардың жәрдемімен нәруыз синтезделеді. 20 аминқышқ. Т-РНҚ лармен байланысу үшін, алғашқы аминқышқ. автивтенуі қажет, активтенуі үшін энергия қажет, Энергия көзі болып АТФ гидролизі болып табылады. Ақуыз биосинтезің кезеңдері: Транскрипция және трансляция Транскрипция – тірі жасушалардағы рибонуклеин қышқылының биосинтезпроцесі. Ол дезоксирибонуклеин қышқылы (ДНҚ) матрицасында жүреді. Транскрипция аденин, гуанин, тимин жəнецитозиннің қайталанбалы тізбегінен тұратын ДНҚ молекуласындағы генетикалық ақпараттың іске асуының бірінші кезеңі. Транскрипция арнайы ДНҚ жəне РНҚ полимераза ферменті арқылы жүреді. Транскрипция нəтижесінде РНҚ молекуласының полимерлі тізбегі түзіледі. Бұл тізбек ДНҚ молекуласының көшірілген бөлігіне комплементарлы болады. Трансляция— полипептид тізбегінің гендегі иРНҚ негі- зінде ақпаратқа сай түзілуі. Трансляция болашақ белокқа тəн иРНҚ-на жазылған нуклеотидтер кезегін түзілетін белоктардың амин қьішқылдарының кезегіне ай- налдырады. Бұл жұмысқа иРНҚ-нан басқа рибосомалар, тРНҚ,аминоацил синтетазалар, белоктан тұратын инициация, элонгация жəне терминацияфакторлары қосылған күрделі құрамдар қатынасады. Трансляция 5 кезеңнен тұрады: 1 кезең Ақуыз синтезі 20 аминқышқ. Қатысады, АТФ, Mg 2+, 20 аминоацил-т-РНҚ синтетаза ферменті қажет. Аминоацил-т-РНҚ синтетаза ферментінің қызметі – Жіберілген қатерліктерді жөндеп отырады. 2 кезең Полипептидтік тізбектің иннициациясы жалғасады, оған а-РНҚ, ақуыз синтезін бастаушы кодон қажет. 3 кезең Элонгация – Аминқышқ бірінен кейін бірі полипептидтік тізбек болып орналасуы. Оған 3 молекула ГТФ, 1 АТФ гидролизі кезінде түзілетін энергия қажет. 4 кезең Терминация – Синтездің аяқталуы, оған АТФ, ақуыз синтезінің біткенін білдіретін а-РНҚ кодондар, ақуыздық факторлар қажет. 5 кезең кеңестіктегі полипептидтік тізбектің орналасуы және процессинг. Бұл кезеңде полипептидтер өзінің құрылымдық орнын табады. Ақуыз синтезінің реттелуі оған 3 фермент қатысады: 1 Репрессибилді – ақуыздар синтезін тежеу (анаболизм) реак. кездеседі. 2 Индуцибелді – ақуыздар синтезін жылдамдату (катаболизм) реак. Кездеседі. 3 Констиуитивті – ақуыз синтезінің жылд. Тұрақты ұстап тұру. (гликолиз, лимон қыщқ.) құрамына кіретін ферменттер. 24БИЛЕТ 1.Аминқышқылдар құрылым Қазіргі кезде табиғатта аныкталған аминкышкыллардын жалпы саны-300-дей, бірак акуыз молекулаларында олардын тек 20- аминқышқылдары ғана кездеседі. Бүл аминкышкылдарды ахуыздык, протеиндік аминқышқылдар деп атайды. а -Аминкышкылдарынын барлығының қүрылысы жалпы алғанда бір-біріне үқсас, яғни олар амин тобынан (NHj), көмірсутектен (СН), карбоксил топтарынан (СООН) құрылған қаңкадан (остав) және ортаңғы көміртек атомымен ( С а ) альфа орны бойынша байланысқан радикалдан түрады. Кейбір ақуыздарда басқа да сирек кездесетін аминқышқылдар болады. Мысалы, коллагееде – гидроксипролин, гидроксилизии; протромбинде – карбоксиглутамин қышқылы. Сонымсн қатар, адам агзасында синтезделу мүмкіншіліктсрінс қарай, аминкышкылдарды - алмастыруға болмайтын амшосышкыллар (палии, лейцин, июлейцнн, треонин, метионин, лизни, фенилаланин, триптофан) агзада синтезделмейді, ағзаға тек ас күрамында енуі қажет. Жартылай алмастыруға болатын аминқышкылдар (аргинин, тиронш, шетиднн) - агзада синтезделінеді, бірак олардыц агзадагы коры жеткіліксіз болгандыктаи әлсін-әлсін ас қүрамында сіңіуі қажет. Алмастыруга болатын аминкышқыддар (глицин, аланин, серии, аспарапін қышкылы, глутамин кышкылы, аспарагин, глутамин, иистеин, пролин) - ағзада синтезделінеді деп боледі 2.Фолдинг түсінігі Акуыз молекуласының III реттік, табиги (нативті) күрылымының түзілуіне онын белгілі бір лигандпен байланысуы айтарлықтай эсер етеді. Акуыз-лиганд әрекетгесулердің бірнеше түрлері белгілі; 1) Лиганд акуызбен байланысып онын күрылымын түрақгандырады. бірак конформациясынын өзгеруіне айтарльпсгай эсер етпейді. Мысалы, лизоцимнің Ca 2+ ионымен байланысуы; 2) Лиганд.акуыздың III ретпк күрылымын айтарлықтай өзгертсді және тек осы күйікде ол белсенді болады. Мысалы, кальмодулин Саг* ионын байланыстырганнан кейін белсенділіх касиетке не болады. 3) Лиганд болмаған жагдайда акуыз еріген шумак (глобула), яғни ешкандай үиунші күрылымы қалыптаспаған күйінде болады, мысалы лактальбуминнін Са1* ионымен байланысуы. CaJ* ионы болмаган жағдайда лактальбуминнін II ретік күрылымы бүзылады. 4) Лигаңдсыз ақуыздын II реттік күрылымы толык калыптаспаган, ал ІІІ-ретпк қүрылымы мүлдем болмайды. Пептидтік тізбек ішінара созылган күйде болады. 5) Лигандсыз акуыз молекуласы түгелдей созылған, яғни кеэдейсок шумақ күйде болады. 6) Лигаңдпен байланысу ақуыз домендерінш не субъединкцаларынын өте үлкен және күрделі қайтакүрылуларына алып келеді. Мысалы, гемоглобиннің оттегімен әрекетгесуі. Ақуыз фолдингі лезде, бір сәтте, жүзеге аспай, бірнеше сатыларга созылатынын 1972 ж. О.Т.Птицин айткан болатын. Ол сатылар төмендегідей: 1) Глобулалы ақуыздың бастапкы формасы-трансляцияның тікелей өнімі - хездейсоқ шумак, болып саналады. Ол майысып, нрелеңдеп созылған тізбек күйінде болады. 2) Әрі карай а-ширатпа,р-қүрылым жәнс күрылымсыз учаскелерден түратын ақуыздың II ретік күрылымы калыптасады. Бүл үдерістін аягында шумактың сыгылып кысылуы нәтижесінде еріген глобула түзіледі. Бүл күрылымньщ табиғи, нативті қүрылымнан ерекшелігі аминкышкылдар радикалдары өздерінін түпкілікті серіктерін «таба» алмай, кез-келгенімен байланысады. Бүл кезде аминкышкылдар арасындагы байланыстар және ақуыз конформациясы түрақсыз болады. 3) Бірак, ақуыз ерте ме, кеш пе термодинамикалык ең тиімді қүрылымын тауып, көтгеген радикалдараралык байланыстар түзеді, ягни табиғи, нативті, формасына фолдингталады. Ірі молекулалы акуыэдардын калыпты фолдингі не рефолдинп үшш лигандтармен қатар кейбір фолдингпң косымша акуыздарынын кажетгілігі аныкталады. 25БИЛЕТ Адам организмі қажетті аминқышқылдарының жартысынан астамын өздігінен синтездей алады. Ал сегіз аминқыщқылын адам организмі синтездей алмайды. Олар ауыстырылмайтын аминқышқылдары деп аталады. Организмде синтезделмейтін аминқышқылдарын адам қоректік заттармен қабылдауы керек. Барлық аминқышқылдары мал етінің құрамында болатындықтан, ет аминқышқылдарының негізгі көзі болып саналады. Ал әр өсімдіктің құрамында өзіне тән жеке аминқышқылдары болады. Аминқышқылдары медицинада дәрі-дәрмек, ал ауыл шаруашылығында мал азығына үстеме қорек ретінде пайдаланылады. Өнеркәсіпте синтетикалық талшық(капрон, нейлон) алу үшін де аминқышқылдары қолданылады. Аминқышқылдардың жіктелуі Табиғатта кездесетін барлық аминқышқылдарға жалпы қасиет амфотерлік, яғни әрбір аминқышқылының құрамында кем дегенде бір қышқылдық бір негіздік топтарының болуымен сипатталады. Жалпы формулада көрсетілгендей аминқышқылдары бір-бірінен R-радикалының химиялық табиғатымен ерекшеленеді. Белок синтезі кезінде пептидтік байланыс түзуге қатыспайтын және а –көміртек атомымен байланысқан аминқышқылы молекуласы түрінде берілген. Барлық а-амин және а-карбаксил топтары белок молекуласындағы пептидті тізбек түзуге қатысады. Осы кезде олар өздерінің аминқышқылдарына еркін сәйкес қышқылды-негізді қасиетін жоғалтады. Сондықтан да белок молекулаларының құрылымының түрлі ерекшеліктері және қызметі оның химиялық табиғатына және аминқышқыл радикалдарының физико-химиялық қасиеттеріне байланысты. Осыған байланысты белоктар бірқатар өзіне негізделген ерекшеліктерімен және басқа биополимерлерге тән емес химиялық жекешеліігімен ерекшеленеді. Басқа принциптер ұсынылғанына қарамай, аминқышқылдарының радикалдарының химиялық құрылыс негізіне байланысты аминқышқылдарын бөледі. Аминқышқылдарын ароматты және алифатты деп бөледі, сонымен қатар күкірт және гидроксил топтары бар аминқышқылдарыы деп атайды. Көбіне бөліну аминқышқылының зарядының табиғатына негізделген. Егер радикал нейтрал болса, онда олар нейтрал аминқышқылы деп аталады. Көбіне мұндай қышқылдарда бір амин, бір карбаксил тобы болады. Егер аминқышқылының құамында амин немесе карбоксил топтары болса, онда олар сол қасиетке сәйкес қышқылды немесе негізді деп аталады. Амиқышқылдарының қазіргі рационалды бөлінуі радикал полярлығына негізделген, яғни олардың сумен әрекеттесу қабілетіне байланысты. Ол амиқышқылыныңң төрт класын біріктіреді: 1) полярсыз-гидрофобты, 2) полярлы-гидрофильді-зарядталмаған 3)теріс зарядталған, 4)оң зарядталған. Келтірілген аминқышқылдар мыңдаған белоктардың құрамында әртүрлі мөлшер қатынасында болады, бірақ аталған аминқышқылдарының толық саны кейбір жеке белоктарда болмайды. Табиғи белоктардың көпшілігінде 20 аминқышқылы болады, кейбір белоктарда аминқышқыл туындылары: оксипролин,оксилизин, дийодтирозин, фосфосерин және фосфотреонин табылған. Бастапқы екі аминқышқылы біріктірілген ткань белоктарында кездеседі коллагенде ал дийодтирозин қалқанша безінің гормонының негізгі құрылысы болып табылады. Осы сияқты бұлшық ет миозинінде E-N –метилизин табылған. |
