2кт
1.Протективный иммунитет при вирусных инфекциях.
Протективный иммунитет– это ответ на реинфицирование путем распознавания антигена предсуществующими антителами (преформированными) и эффекторными Т-клетками с последующим удалением возбудителя. Иммунологическая память– проявляется в том, что в ответ на реинфицирование происходит распознавание антигена с помощью В - и Т-лимфоцитов памяти.
2.Особенности иммунитета при протозойных инвазиях.
Для возбудителей протозойных инфекций характерно чрезвычайное разнообразие антигенного состава. Особенности обусловлены внутриклеточной локализацией возбудителей, изменчивостью их поверхностных антигенов, наличием антигенов, общих с антигенами клеток человека, иммуносупрессивными свойствами паразитов. К тому же большинство этих возбудителей имеют довольно сложный механизм жизненного цикла, что еще более затрудняет иммунную защиту. . К этому следует добавить то обстоятельство, что сами возбудители наделены иммуносупрессорным действием, а также то, что при данных патологических процессах реализуется выраженный поликлональный митогенный эффект, истощающий защитные возможности иммунной системы, не формируя резистентности.
При протозойных заболеваниях могут образовываться Ig М и IgG , но специфичность их крайне низка вследствие их образования в результате поликлональной активации В-лимфоцитов и антигенной изменчивости паразитов.
Выздоровление наступает при активации Т-лимфоцитов (Тс, Тh). Полноценный постинфекционный иммунитет формируется очень редко
3.Значение биологических особенностей простейших в формировании иммунитета.
Естественный иммунитет. При протозойных инфекциях естественный иммунитет, так же как при инфекциях другой этиологии, может быть абсолютным и относительным. Абсолютный иммунитет обусловлен полным несоответствием условий в организме хозяина для развития и размножения возбудителей инфекции. Относительный иммунитет выражается в большей или меньшей способности организма преодолевать инфекцию. Эта способность, как и при инфекциях, вызываемых возбудителями другой природы, может зависеть от ряда условий.
4.Особенности иммунитета при глистных инвазиях.
Глистные инвазии (аскаридоз, трихинеллез) способствуют стимуляции синтеза IgE. На месте внедрения возбудителя образуется инфильтрат, состоящий из эозинофилов, базофилов и тучных клеток. В некоторых случаях паразитическим червям удается избежать распознавания благодаря слою перекрестно-реагирующих антигенов с организмом хозяина.
Индукция специфических иммунных реакций при инфекциях может быть причиной формирования иммунопатологических состояний (аллергические, аутоиммунные реакции и иммунологическая недостаточность).
Так, при внезапном высвобождении больших количеств антигенов в результате гибели микроорганизмов в сенсибилизированном организме образуются иммунные комплексы, вызывающие аутоиммунные гломерулонефриты. Это осложняет течение стрептококковых, пневмококковых и стафилококковых инъекций. Токсические иммунные комплексы могут образовываться и при персистируюших вирусных инфекциях. Особенно четко это проявляется при остром вирусном гепатите А, когда гибель гепатоцитов проявляется типичными клиническими симптомами, совпадающими с началом иммунного ответа. Появление антител в избытке антигена приводит к образованию токсических иммунных комплексов, а возникновение иммунных комплексов в избытке антител при разрушении инфицированных клеток приводит к элиминации возбудителя.
Большинство глистных инвазий сопровождается аллергическими реакциями, чаще иммунокомплексными (тип III) или клеточными (тип IV). Встречаются такие атопические реакции (тип I) при аскаридозе, крапивнице и бронхиальной астме.
+Аутоиммунные реакции часто сопровождают инфекционные заболевания. Классическим примером их являются поражения суставов и эндокарда при ревматизме, вызываемом, как известно, β-гемолитическим стрептококком. В их реализации принимают участие несколько механизмов: модификация собственных антигенов возбудителями или их токсинами, наличие перекрестно-реагирующих антигенов между хозяином и микроорганизмом, интеграция вирусной нуклеиновой кислоты в геном хозяина, модификация белков клетки-мишени белковыми структурами вирусов, внедрившихся в нее.
Иммунологическая недостаточность, особенно по Т-звену, практически всегда сопровождает бактериальные, вирусные, грибковые и паразитарные заболевания. Эти состояния могут быть преходящими или вызывать серьезную патологию, проявляться немедленно или отсроченно, когда инфекция давно перенесена, сопровождаться пестрой клинической картиной (частые ОРЗ, грипп) или протекать бессимптомно, выражаясь в хронизации инфекционных процессов. При острых, особенно вирусных, инфекциях возможно катастрофическое ослабление иммунной реактивности, при хронических (малярия) происходит более замедленное функциональное истощение иммунной системы.
5.Реакции гиперчувствительности I (немедленного) типа. Механизмы развития.
Анафилаксия. Атопии. Выявление сенсибилизации к неинфекционным аллергенам. Десенсибилизация.
ГНТ I типа (медиаторный, реагиновый) развивается преимущественно на аллергены белкового происхождения (пыль, пыльца растений, лекарственные препараты). Эти аллергены активны в очень низких дозах и способны диффундировать через кожу и слизистые. На стадии сенсибилизации под влиянием аллергена при участии Т-хелперов 2-го типа образуются IgE и IgG4 (реагины), связывающиеся с рецепторами к Fc-фрагментам (FcR) на мембранах базофилов и тучных клеток (тканевые аналоги базофилов). На стадии разрешения аллерген связывается с фиксированным IgE, что приводит к дегрануляции базофила или тучной клетки и массивному выбросу накопленных в ней биологически активных веществ – гистамина, гепарина, серотонина, лейкотриенов. Это приводит к расширению сосудов, развитию отеков, воспаления, спазма гладкой мускулатуры (бронхоспазма), а в самом ярком случае – к анафилактическому шоку (анафилаксии). Кроме того, в тучных клетках и Т-хелперах 2-го типа активируется синтез ИЛ-4 (стимулирует рост В-лимфоцитов и тучных клеток, а также способствует дифференциации Тхелперов во второй тип)
и ИЛ-5 (участвует в синтезе IgE).
Анафилаксия – это реакция ГНТ, сопровождающееся состоянием шока и несущая угрозу жизни человека. Наиболее часто анафилаксия развивается после парентерального введения аллергена, при этом доза решающего значения не имеют. Анафилаксия развивается в течение периода от нескольких секунд до часа. Ведущий патогенетический механизмы – сильная периферическая вазодилатация из-за резкого увеличения концентрации БАВ. Симптомы анафилактического шока включают резкое падение АД, отек гортани, ларинго- и бронхоспазм, затруднение дыхания, спутанность сознания, обморок. Около 10% случаев заканчиваются летальным исходом. Пассивная анафилаксия возникает в организме реципиента вследствие соединения аллергена с аллергическими антителами, полученными от активно сенсибилизированного донора. Эту методику чаще всего используют на морских свинках, причем вызывают не генерализованную, а местную сенсибилизацию (кожную анафилаксию). Методом пассивной анафилаксии можно: • установить точное количество антигена и антител и их соотношения, нужные для воспроизведения анафилактических реакций; • получить точную информацию о следствиях взаимодействия антиген – антитело в организме с нормальной реактивностью; • выявить некоторые аллергические заболевания или состояния.
Атопии – это локальные реакции ГНТ I типа у генетически предрасположенных к ним лиц. В отличие от анафилаксии, атопия может развиваться в ответ на многие небелковые вещества, сенсибилизация при ней длительна, а симптомы варьируют в зависимости от типа аллергена и индивидуальных особенностей человека. Классическими формами атопии являются атопический дерматит, аллергический ринит и аллергическая астма.
Сенсибилизацию T-клеток выявляют: 1) по выделению ими цитокинов (медиаторов ПЧЗТ) в реакциях подавления (ингибиции) миграции лейкоцитов, угнетения прилипаемости лейкоцитов; 2) по изменению Т-активного розеткообразования; 3) по усилению пролиферации Т-клеток под влиянием аллергенов - реакция бласт-трансформации с морфологическим учетом блаетов или по увеличению включения медленного 3Н-тимидина в их ДНК и в других тестах, или по усилению экспрессии молекул активации - CD25 и других.
Десенсибилизация предполагает введение больному постепенно возрастающих доз аллергенов с целью ослабления или устранения клинических симптомов, возникающих при последующем естественном контакте с данными аллергенами. При правильном проведении десенсибилизация не только ослабляет или устраняет клинические симптомы, но и уменьшает продолжительность аллергического заболевания и препятствует его прогрессированию. Десенсибилизация приводит к реципрокным изменениям в содержании аллергенспецифических IgE и IgG в крови. После первого введения аллергена концентрация специфического IgE в сыворотке возрастает, но в ходе лечения постепенно падает ниже исходного уровня. Уменьшается и степень обычного сезонного повышения концентрации IgE. Симптомы заболевания исчезают еще до снижения уровня этого иммуноглобулина. Уровень аллергенспецифического IgG в ходе такой терапии, напротив, увеличивается.
6.Реакции гиперчувствительности II типа. Комплементзависимия и антителозависимая цитотоксичность. Механихмы повреждения клеток крови и других клеток и тканей организма. Методы предупреждения.
ГНТ II типа (цитотоксический) может развиваться в ответ на широкий круг аллергенов, связанных с мембранами клеток: низкомолекулярные соединения, лекарства, аутоантигены, микробные антигены. На стадии сенсибилизации аллерген адсорбируется на различных клетках организма. Против него вырабатываются IgM и IgG. На стадии разрешения антитела своими Fab-фрагментами связываются с аллергенами, находящимися на поверхности клеток различных органов (крови, печени, почек, эндотелия), с образованием комплекса антиген-антитело. Далее происходит цитолиз клеток, опосредуемый двумя основными механизмами: 1) комплементзависимый (с образованием мембраноатакующего комплекса); 2) антителозависимая клеточная цитотоксичность: - цитолиз NK-клеткой (перфорины); - поглощение макрофагом (необходимо наличие рецепторов к Fc-фрагментам и опсонизация комплементом). Клинические проявления ГНТ II типа обусловлены разрушением клеток и развитием воспаления. Время их появления обычно составляет 4-12 часов. Наиболее характерные заболевания и синдромы, связанные с этим типом ГНТ: • злокачественная миастения (слабость мышц, АТ к ацетилхолиновым рецепторам); • вульгарная пузырчатка (образование пузырей на коже и слизистых, АТ к молекулам межклеточной адгезии); • синдром Гудпасчера (нефрит + кровоизлияния в легкие, АТ к базальной мембране); • аутоиммунный гипертиреоз (АТ к рецепторам ТТГ); • гемолитическая анемия и другие цитопении (часто индуцируются лекарствами); • гемолитическая болезнь новорожденных (повреждение эритроцитов Rh+ плода при повторной беременности у Rh– матери).
7.Реакции гиперчувствительности III типа (иммунокомплексные). Механихм развития. Сывороточная болезнь, ее предупреждения.
ГНТ III типа (иммунокомплексный) чаще развивается в ответ на аллергены, которые: - длительно циркулируют в организме; - присутствуют в больших количествах; - являются растворимыми. Примерами таких аллергенов могут быть бактериальные и вирусные антигены при хронических инфекциях или введенные в организм сывороточные антигены. На стадии сенсибилизации аллерген циркулирует в организме в больших количествах и против него вырабатываются IgG и IgM. На стадии разрешения выработанные антитела образуют с аллергеном комплекс антиген-антитело (иммунный комплекс), которые в норме поглощаются фагоцитами. Однако из-за избытка антигенов фагоциты не справляются с наплывом иммунных комплексов, и последние оседают в различных тканях. Оседая в тканях, иммунные комплексы активируют комплемент, что приводит к выделению анафилотоксинов и развитию воспаления с привлечением в очаг нейтрофилов, тромбоцитов и макрофагов. Они дополнительно выделяют повреждающие ткани протеолитические ферменты и медиаторы воспаления. В итоге совместное действие комплемента, медиаторов воспаления и ферментов приводит к разрушению клеток ткани. Реакция ГНТ III типа активно протекает уже в первые сутки, однако клинические проявления обычно появляются через 2-10 дней. Наиболее характерные заболевания и синдромы, связанные с этим типом ГНТ:
• сывороточная болезнь – развивается через 8-10 дней после однократного введения гетерологичной сыворотки (например, лошадиной) и сопровождается повышением температуры, увеличением селезенки, лейкоцитозом, в тяжелых случаях осложняется васкулитами и гломерулонефритом; • феномен Артюса – местная реакция на введение аллергена в ткань (подкожно или внутримышечно), которая повреждается в результате высвобождения лизосомальных ферментов в местах отложения иммунных комплексов вплоть до некроза; • ревматоидный артрит; • системная красная волчанка и люпус-нефрит; • аутоиммунный гепатит; • аутоиммунный тиреоидит.
8.Реакции гиперчувствительности IV (замедленного) типа. Механизм развития. Контактная аллергия. Гиперчувствительность при инфекционных заболеваниях. Методы предупреждения.
К гиперчувствительности замедленного типа (ГЗТ) относится реакция IV типа. Она характеризуется следующим: • опосредована клеточным иммунным ответом; • развивается не ранее чем через 24 часа; • среди эффекторных молекул наибольшее значение имеют лимфокины; • антигистаминные препараты неэффективны. ГЗТ может развиваться в ответ на следующие аллергены: - простые химические вещества (будучи гаптенами, вызывают иммунный ответ только после связи с белками организма, например белками кожи); - микробные антигены; - лекарственные вещества; - аутоантигены. На стадии сенсибилизации аллерген инициирует типичный клеточный иммунный ответ с образованием Т-хелперов 1-го типа, часть которых может дифференцироваться в особые клетки – Т-эффекторы ГЗТ. Меньшую роль играют образующиеся Т-киллеры. На стадии разрешения Т-эффекторы ГЗТ и Т-хелперы 1-го типа активируют макрофаги и вместе с ними в больших количествах продуцируют цитокины (ФНО, хемотаксический фактор, интерфероны, ИЛ-1, 6, 12), которые привлекают в очаг вокруг аллергена гранулоциты, Т-киллеры, макрофаги и способствуют развитию воспалительной реакции.
9.Микробные аллергены. Методы выявления сенсибилизации организма: кожные пробы и лабораторные тесты.
Сенсибилизацию T-клеток выявляют: 1) по выделению ими цитокинов (медиаторов ПЧЗТ) в реакциях подавления (ингибиции) миграции лейкоцитов, угнетения прилипаемости лейкоцитов; 2) по изменению Т-активного розеткообразования; 3) по усилению пролиферации Т-клеток под влиянием аллергенов - реакция бласт-трансформации с морфологическим учетом блаетов или по увеличению включения медленного 3Н-тимидина в их ДНК и в других тестах, или по усилению экспрессии молекул активации - CD25 и других.
Особенности кожных тестов
• Прямые аллергопробы – делаются для диагностирования заболеваний, развивающихся из-за повышенной чувствительности к определенному веществу. При данном исследовании аллергены и кожный покров находятся в плотном контакте: выполняется аппликация, скарификационная проба, прик-тест.
• Косвенные кожные пробы – способ проверки, разработанный для обнаружения аллергического раздражителя. Сначала раздражитель вводится под кожу, далее берут кровь из вены, чтобы определить уровень антител. Устанавливают аллергены после контакта с кожным покровом.
10.Иммунодефициты. Классификация. Примеры.
Иммунодефициты (ИД) — это изменения иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. При ИД снижение функциональной активности основных компонентов иммунной системы ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости. Различают первичные (наследственные) и вторичные (приобретенные) иммунодефицитные состояния.
Первичные ИД связаны с генетическими дефектами в развитии иммунной системы, которые рано или поздно приводят к тем или иным проявлениям иммунологической недостаточности.
Вторичные ИД — это нарушения в иммунной системе, не являющиеся результатом генетических дефектов. Иммунологическая недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную систему.
11.Аутоиммунные болезни. Методы их диагностики.
АУТОИММУННОЕ ЗАБОЛЕВАНИЕ - это болезнь иммунной системы, обусловленная тем, что под влиянием генетически-обусловленных факторов и/или факторов внешней среды, утрачивается толерантность к антигенам собственного организма, что ведет к развитию иммуноопосредованных органоспецифических или системных патологических процессов.
В основе развития аутоиммунного заболевания лежит 1)самоподдерживающийся иммунный ответ, 2) направленный против собственных антигенов организма, 3)вызывающий повреждение клеток и тканей, экспрессирующих эти антигены.
Общим принципом диагностики аутоиммунных заболеваний является обнаружение аутоантител или сенсибилизированных лимфоцитов, но ситуация осложняется тем, что наличие указанных факторов может наблюдаться у здоровых лиц и у пациентов с аутоиммунным процессом без клинического проявления. Точная диагностика аутоагрессии возможна при наличии следующих критериев: а) прямое доказательство циркулирующих или связанных аутоантител или сенсибилизированных лимфоцитов, направленных против Аг, ассоциированного с данным заболеванием; б) повышенное содержание в сыворотке иммунных комплексов или наличие их в тканях, лимфоцитарная инфильтрация ткани; в) идентификация аутоантигена, против которого направлен иммунный ответ; г) перенос аутоиммунного процесса лимфоцитами или с помощью сыворотки, содержащей АТ; д) возможность создания экспериментальной модели заболевания с соответствующими морфологическими нарушениями путем переноса сыворотки или лимфоцитов
12.Иммуномодуляторы. Классификация. Примеры.

13.Роль факторов врожденного и приобретённого иммунитета при инфекции, вызванной вирусом COVID-19.
-PRPs (паттерн-распознающие рецепторы).TLR4 распознает S-белок, через систему адаптерных белков стимулирует секрецию эпителиальными клетками и макрофагами цитокинов:IL-1β, IL-6,8,21,ФНОβ. В свою очередь, IL-1β активирует нейтрофилы, также увеличивают синтез гиалуроновой кислоты, ум. Газообмен в легких.
Вирусная РНК активирует TLR3, 7. Это приводит к продукции IFNα и других провоспалительных цитокинов.
Е протеин активирует ионные каналы, выход К и поступление Са.Это активирует NOD-рецепторы, образование инфламмасомы, выход IL-1β, который, в свою очередь, стимулирует макрофаги, цитотоксические Т-лимф., нейтрофилы.
-нейтрофилы (рекрутируют др. нейтрофилы и моноциты, выделяют активные формы кислорода, ферменты, вызывающие деструкцию тканей)
-провоспалительные цитокины IL-6,8
-белки острой фазы: С-реактивный белок
Механизмы уклонения от факторов врожденного имм-та.
-Образование 2-х-мембранных везикул, препятствующих распознаванию РНК
-подавление синтеза IFNα («отсроченный синтез»), например, с помощью М-белка вируса, который подавляет сигнальные пути активации синтеза IFNα.Некоторые протеазы вируса также подавляют образование IFNα.
-белок вируса orf8 подавляет синтез IFNβ
-рецепторная часть S-белка (RBD)изменяет свою конфигурацию, что приводит к избеганию вирусом распознавания
Патологические реакции системы врожденного иммунитета
-Цитокиновый «шторм»-неконтролируемая активация иммунной системы, приводящая к системной воспалительной реакции, дистресс-синдрому, полиорганной недостаточности. Ув-ние цитокинов объясняют и сходством фрагментов первичной структуры S-белка с интерлейкинами, интегринами, рецепторами и компонентами комплемента. Поэтому протеолиз структур
вируса также может увеличивать число цитокинов и рекрутировать лейкоциты из кровяного русла
-Избыток нейтрофилов на фоне лимфопении
-Снижение уровня IL-10
Факторы приобретенного иммунитета при COVID-19:
-Тх1
-Тцит(CD8)
-Тх17
-Тх2
-В-лимфоциты
Особенности приобретенного иммунитета при COVID-19
-увеличение числа цитотоксических CD8 Т-лимфоцитов, снижение числа ЕК и CD4Т-хелперов
-активация синтеза перфоринов и гранзимов Т-лимфоцитами
-увеличение числа Тх17
-истощение пула Тreg (супрессоров)
14. Иммунопатогенез коронавирусной инфекции COVID-19.
► SARS-CoV-2 — одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae.
► Генетическая последовательность SARS-CoV-2 на 79% схожа с SARS-CoV.
► Патогенез COVID-19 еще недостаточно изучен. Предполагается два пути попадания в клетку: рецептором вируса может служить рецептор к ферменту АПФ2 или трансмембранный гликопротеин
CD147. Не установлен и преимущественный путь проникновения вируса в клетку.
► АПФ2.
•S-белок короны вирусов по своей структуре имитирует ангиотензинпревращающий фермент
2 (АПФ2). Благодаря этому вирусные частицы успешно связываются с рецепторами АПФ2
(их много на поверхности клеток легких — альвеолоцитов), после чего впрыскивают свою РНК
внутрь клетки.
•Взаимодействие вируса с этими рецепторами осуществляется посредством субъединицы S2 через
гептад-повторы 1 и 2 (HR1 и HR2).
•Афинность к рецептору АПФ2 S-протеина вируса SARS-CoV-2 в 10–20 раз больше, чем
у SARS-CoV-1, что обуславливает большую контагиозность.
•Молекулы, которые обеспечивают инвагинацию клеточной мембраны с комплексом вирус-рецептор, не известны.
► CD147.
•Механизм проникновения в клетку такой же, как и при проникновении через АПФ2. Рецептор
CD147 относится к семейству иммуноглобулинов.
•По данным лабораторных исследований in vitro, для блокирования пути проникновения через
CD147 могут быть эффективны моноклональные антитела (меполизумаб).
► Попав в клетку, РНК запускает процесс репликации вируса. Вирус собирается несколькими независимыми частями, после этого пузырьки, содержащие вирион, сливаются с плазматической мембраной, происходит выделение вируса.
► В отличие от других патогенных коронавирусов, вызывающих сезонное ОРВИ, SARS-CoV-2 реплицируется в верхних дыхательных путях без выраженной клинической картины.
15.Неспецифическая и специфическая профилактика заболевания, вызываемого вирусом COVID-19.
-Прежде всего, желательно воздерживаться от посещения мест массового скопления людей и избегать поездок на общественном транспорте в часы пик. Не следует находиться в одном помещении с лицами, имеющими видимые признаки ОРВИ: кашель, чихание, выделения из носа.
-При нахождении в общественных местах и транспорте обязательно носите средства индивидуальной защиты органов дыхания: маски или респираторы. Маски необходимо менять каждые 2-3 часа либо по мере увлажнения и правильно их утилизировать. Еще одним методом профилактики является соблюдение социальной дистанции до других граждан на расстоянии не менее 1,5 метра.
-Часто мойте руки с мылом и обрабатывайте их спиртосодержащими кожными антисептиками или влажными дезинфицирующими салфетками. Рекомендуется также выполнять правила респираторного этикета: во время кашля и чихания прикрывать рот и нос одноразовыми бумажными платочками и сразу же их выбрасывать. При отсутствии салфеток чихать и кашлять нужно в сгиб локтя. Избавьтесь от привычки прикасаться к лицу необработанными руками, особенно нельзя трогать слизистые оболочки глаз, носа и рта.
-Чистите и дезинфицируйте контактные поверхности, используя бытовые моющие средства, обладающие вирулицидным действием.
-Пользуйтесь только индивидуальными предметами личной гигиены (полотенцами, посудой). Не принимайте пищу из общих тарелок и упаковок, не пейте напитки с кем-то из одних бутылок.
-В случае появления таких симптомов, как повышение температуры тела, головная боль, слабость, кашель, затрудненное дыхание, боли в мышцах, тошнота, рвота, диарея, не занимайтесь самолечением, оставайтесь дома и обращайтесь за медицинской помощью по телефону. Сведите к минимуму контакты со здоровыми людьми, особенно с пожилыми и лицами с хроническими заболеваниями. Настоятельно рекомендуется изолироваться в отдельную комнату, пользоваться индивидуальными предметами личной гигиены и одноразовой посудой, следовать предписаниям лечащего врача и соблюдать постельный режим.
-Несмотря на действенность средств неспецифической профилактики коронавирусной инфекции, самым эффективным методом предотвращения заражения считается вакцинация.
3кт
1.Имуннобиологические препараты, их классификация и характеристика.
1. ИБП, получаемые из живых или убитых микробов (бактерий, вирусов, грибов) или микробных продуктов и используемые для специфической профилактики и терапии. К ним относятся живые и инактивированные корпускулярные вакцины, субклеточные вакцины из микробных продуктов, анатоксины, бактериофаги, пробиотики;
2. ИБП на основе специфических антител. К ним относятся иммуноглобулины, иммунные сыворотки, иимунотоксины, антитела-ферменты, рецепторные антитела,мини-антитела;
3. Группа иммуномодуляторов для иммунокорекции, лечения и профилактики инфекционных и неинфекционных болезней, иммунодефицитов. Различают экзогенные иммуномодуляторы (адъюванты, антиметаболиты, гормоны) и эндогенные (интерлейкины, интерфероны, пептиды тимуса, миелопептиды идр).
4. Группа адаптогенов. Это сложные химические вещества растительного, животного или иного происхождения с биологической активностью и действием на иммунную систему. К ним относят экстракты женьшеня, элеутерококка и др. растений, биологически активные пищевые добавки.
5. Группа диагностических препаратов с помощью которых можно обнаруживать антигены, антитела, ферменты, продукты метаболизма, биологически активные пептиды и др
2.Классификация традиционных вакцин по способам их приготовления и характеру используемого антигена, их достоинства и недостатки.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Плюсы: высокая иммуногенность
Недостатки живых вакцин:
сложно комбинируются и плохо дозируются
категорически противопоказаны людям, страдающим иммунодифицитом
вызывают вакциноассоциированные заболевания
относительно нестабильны в процессе производства, транспортировки, хранения
при использовании необходимо строго соблюдать меры, предохраняющие микроорганизмы от отмирания и гарантирующие сохранение активности препаратов, и др
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Достоинства: • безопасны. Создают иммунитет примерно на 1 год. • достаточно стабильны. • Не требуют хранения на холоде. Недостатки: • Менее иммуногенны, чем живые • требуют применения нескольких доз (бустерные иммунизации). • реактогенны (токсичны) • сложно ассоциировать • Пример - противококлюшная вакцина. Сейчас мало используются.
3.Вакцины нового поколения. Принципы получения, применения.
Генно-инженерные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета. Возможны несколько вариантов создания генно-инженерных вакцин. • Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы. • Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением Аг и его использованием в качестве иммуногена. • Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин.
Рекомбинантные векторные вакцины как бы сочетают в себе положительные качества живых и инактивированных вакцин. При репликации в организме рекомбинантного вируса с встроенным чужеродным геном, кодирующим синтез гликопротеина, который может быть экспрессирован на поверхности клеток и может индуцировать развитие как гуморального, так и клеточного иммунного ответа. Субъединичные вакцины могут индуцировать развитие только гуморального иммунного ответа.
РНК-вакцина – это разновидность вакцины, которая производится из информационной РНК. ДНК-вакцина – это вакцина, производящаяся из ДНК.
4.Популяционный иммунитет. Вакцины как инструмент формирования популяционного иммунитета.
Популяционный иммунитет — это неспособность инфицированных особей распространять эпидемическую вспышку из-за отсутствия контакта с достаточным количеством восприимчивых особей. Это происходит при наличии индивидуального иммунитета, который может быть приобретен через естественную инфекцию или через вакцинацию.
Человек прошедший вакцинацию является барьером для не вакцинированных людей.
5.Вакцины, применяемые как терапевтические препараты (гоновакцина, стафилококковая аутовакцина, экспериментальная ДНК-вакцина против ВИЧ-инфекции)
Гоновакцина

Стафилококковая аутовакцина Стафилококковая вакцина представляет собой. инактивированную взвесь патогенных стафилококков. Используют с целью специфическо:-о лечения больных с заболеваниями стафи лококковой этиологии. Формирует приобретенный искусственный активный антибактериальный иммунитет.
Экспериментальная днк-вакцина против вич-инфекции
 
6)практические основы вакцинопрофилактики:
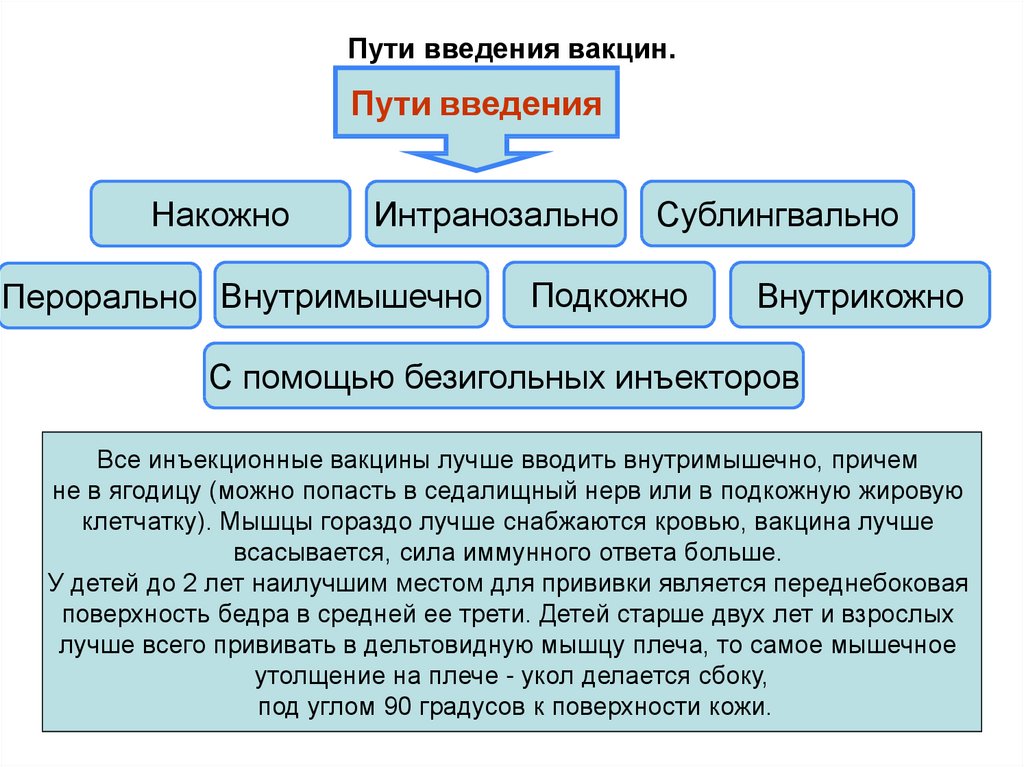
поствакцинальные осложнения:
• неспецифические (могут развиться в ответ на любую вакцину):
- аллергические реакции (сыпь, дерматит, отеки, анафилактический шок);
- аутоиммунные реакции (энцефалит, менингоэнцефалит, полиневрит, миокардит,
системная красная волчанка, дерматомиозит, артрит);
- афебрильные судороги;
• специфические (характерны для определенных вакцин):
- БЦЖ: регионарные подмышечные лимфадениты (БЦЖиты), требующие про-
тивотуберкулезной терапии, а иногда и хирургического удаления л/у;
- БЦЖ: «холодные» абсцессы, требуют химиотерапии и хирургического лечения;
- БЦЖ: келоидные рубцы, обезображивающие и неуклонно растущие (лечение
малоэффективно);
- БЦЖ: остеомиелит – расплавление кости, редкое опасное осложнение;
- БЦЖ: диссеминированная БЦЖ-инфекция, схожая с туберкулезной инфекци-
ей, чаще развивается у детей с ВИЧ-инфекцией, летальность превышает 80%;
- ОПВ (оральная (живая) вакцина против полиомиелита): вакциноассоциирован-
ный полиомиелит; с целью предотвращения этого редкого осложнения исполь-
зуют схему с первой прививкой инактивированной вакциной.
Наиболее реактогенной среди применяемых в РБ вакцин является БЦЖ – живая вакци-
на против туберкулеза. В то же время польза от применяемых вакцин (число спасенных
жизней и предотвращенных тяжелых осложнений) на порядки превышает потенциальный
вред (число тяжелых и смертельных осложнений).
Поствакцинальные осложнения могут быть вызваны следующими причинами:
• неудовлетворительное качество вакцины, нарушение правил хранения, транспор-
тировки и дозирования;
• неправильная техника проведения вакцинации, нарушение правил асептики;
• индивидуальная реакция организма;
• обострение хронических заболеваний (туберкулеза, ревматической болезни и др.);
• острая инфекция в поствакцинальном периоде (интеркуррентная);
• первичные и вторичные иммунодефициты.
К противопоказаниям к вакцинации относят:
• абсолютные:
- тяжелая реакция, ранее возникшая при введении той же самой вакцины;
- осложнения при введении предыдущей дозы этой же вакцины;
- иммунодефицитные состояния (для живых вакцин);
• относительные:
- ОРЗ/ОРВИ, протекающее с повышением температуры тела (отвод на 2-4 недели);
- декомпенсация хронических заболеваний (печени, почек, диабета);
- переливания крови или иммуноглобулинов (отвод на 3 месяца);
- недоношенность высоких степеней;
• ложные (необоснованно включаются в список противопоказаний):
- дисбактериоз;
- анемия;
- аллергия, атопический дерматит, астма, экзема, в т.ч. в семье;
- некоторые врожденные заболевания (болезнь Дауна и др.) при условии отсутствия
иммунодефицита;
- осложнения в семье после вакцинации.


6) препараты содержащие антитела, классификация
К сывороточным иммунным препаратам относятся:
- иммунная сыворотка – это сыворотка крови (то есть ее жидкая часть без форменных элементов и фибрина) человека или животного, иммунизированного каким-либо антигеном и содержащая антитела к нему;
- иммуноглобулины – выделенные из сыворотки антитела без балластных веществ;
- моноклональные антитела – перспективные препараты
Классификации сывороток
I. По специфичности:
• нормальные (содержат множество антител неизвестной специфичности);
• иммунные (содержат в том числе антитела к определенному антигену, полученные в
результате иммунизации).
II. По способу получения:
• гомологичные (из сывороток иммунизированных или переболевших людей);
• гетерологичные (из сывороток иммунизированных животных, чаще лошадей).
III. По объекту действия антител:
• антимикробные (сибирская язва, чума, стрептококки, стафилококки);
• антитоксические (дифтерия, столбняк, ботулизм, противогангренозная);
IV. По назначению:
• диагностические (для проведения серологических реакций);
• лечебно-профилактические.
7)гомологичные и гетерологичные лечебные иммунные сыворотки и иммуноглобулины, получение;
Иммунные сыворотки получают из крови искусственно иммунизированных животных и людей-доноров (в этих целях используют периферическую, плацентарную и абортную кровь). Для получения высоких титров AT лошадей и кроликов иммунизируют дробным введением соответствующих Аг в больших дозах. Препараты, изготовляемые из крови животных, содержат гетерологичные AT, поэтому человеку такие гетерологичные (чужеродные) сыворотки вводят при соблюдении мер предосторожности. Например, столбнячную антисыворотку (получаемую из крови иммунизированных лошадей) вводят после постановки кожных проб на чувствительность, дробно по Безрёдке на фоне приёма десенсибилизирующих средств.
Препараты, изготовляемые из крови иммунизированных доноров, содержат гомологичные AT; гомологичные сыворотки лишены многих побочных эффектов гетерологичных сывороток. Гомологичные сыворотки применяют для профилактики и лечения вирусных гепатитов, кори, столбняка, ботулизма и др. После введения гетерологичных сывороток состояние невосприимчивости длится 2-3 нед, эффект гомологичных AT сохраняется 4-6 нед.
Иммуноглобулины получают осаждением из сыворотки крови, что освобождает их от балластных компонентов. Затем препараты очищают и концентрируют. Ig применяют для лечения и профилактики кори, клещевого энцефалита, стафилококковых инфекций, столбняка и других инфекций.
8) моноклональные АТ. Применение, гуманизированные АТ;
Моноклональные антитела (мкАТ) – это антитела, специфичные только к одной антигенной детерминанте и продуцируемые одной гибридомной клеткой.
Гибридома – это гибрид опухолевой миеломной клетки и плазматической клетки, который от опухолевой клетки получает способность к неограниченному росту и размножению, а от плазматической – способность продуцировать специфические антитела.
Гибридому (а значит и моноклональные антитела) получают следующим образом:
1) мышь иммунизируют, затем отбирают у нее антителообразующие клетки (АОК, то есть плазмоциты) из селезенки;
2) добавляют клетки из культуры миеломы (ПЛ, плазмоцитомы) и обрабатывают полиэтиленгликолем, который провоцирует слияние клеточных мембран;
3) гибриды переводят на селективную ГАТ-среду, в которой выживают только гибридомы (АОК+ПЛ), а остальные гибриды и негибридные клетки гибнут;
4) с помощью серологических или молекулярно-генетических тестов отбирают те гибридомы, которые продуцируют антитела нужной специфичности (ведь из селезенки были отобраны самые разные АОК);
5) при размножении гибридомы ее несколько раз пересевают, отбирая те клетки, которые вырабатывают наибольшие количества специфичных иммуноглобулинов (предпочтительно IgG); гибридомы можно хранить в жидком азоте.
Моноклональные антитела специфичны к определенному антигену. Их можно использовать для того, чтобы «найти» или идентифицировать этот антиген и, если нужно, разрушить его. Моноклональные антитела широко применяются в клинических лабораториях, и возможности их использования постоянно растут. Пока они применяются главным образом в целях диагностики. Из 150 диагностических моноклонапьных антител, применяемых в настоящее время, примерно одна треть используется для выявления беременности.
Гуманизированные антитела - это антитела от видов, не относящихся к человеку, белковые последовательности которых были модифицированы для увеличения их сходства с вариантами антител, вырабатываемых естественным образом у людей. Процесс «гуманизации» обычно применяется к моноклональным антителам, разработанным для введения людям (например, антителам, разработанным как противораковые препараты).
9)антитоксические иммунные сыворотки и иммуноглобулины, их дозирование( международные антитоксические единицы – МЕ)
Антитоксические сыворотки получают иммунизацией лошадей возрастающими дозами анатоксинов, а затем и соответствующими токсинами. Сыворотки подвергают очистке и концентрации методом «Диаферм-3»,контролю на безвредность, апирогенность, затем титруют т. е. определяют содержание антитоксинов в 1 мл препарата.
Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины – это очищенные и концентрированные иммунные сыворотки.
Иммуноглобулины, как и иммунные сыворотки бывают гомологичными и гетерологичными. Гомологичные получают из крови людей, гетерологичные – из крови животных.
Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный) иммуноглобулин – получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия – получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции;
Специфическая активность сывороток или количество антител выражается в международных антитоксических единицах (ME), принятых ВОЗ. За 1 ME принимается то минимальное количество сыворотки, которое способно нейтрализовать определенную дозу токсина, выражающуюся в стандартных единицах, обозначаемых как смертельные, некротические или реактивные дозы в зависимости от вида токсина и способа титрования.
10)антимикробные (антибактериальные и противовирусные) иммуноглобулины, их дозирование;
Антимикробные сыворотки (иммуноглобулины). Получение, применение.
+Антибактериальные сыворотки получают гипериммуннзацией лошадей соответствующими убитыми бактериями или антигенами и содержат антитела с агглютинирующими, литическими и опсонизирующими свойствами. Они не нашли широкого применения в силу их малой эффективности. Антибактериальные сыворотки относятся к нетитруемым препаратам, так как общепринятой единицы измерения их лечебной силы нe существует. Поэтому антибактериальные лечебные сыворотки дозируются в объемных единицах, непосредственно у постели больного, исходя из степени тяжести заболевания.для очистки и концентрации антибактериальных сывороток и некоторых антивирусных используют метод, основанный
на разделении белковых фракций нативных сывороток и выделении активных иммуноглобулинов этиловым спиртом при низкой температуре (метод водно-спиртового осаждения на холоду).
Препарат в некоторых случаях оказывает защитное действие или чаще смягчает клиническое течение болезни. Очень важно правильное соблюдение дозировки иммуноглобулина (0,02 мл на 1 кг веса). Продолжительность профилактического действия препарата 3—6 месяцев. Иммуноглобулины направленного действия готовят из сыворотки крови людей-добровольцев, подвергшихся специальной иммунизации против определенной инфекции. Такие препараты содержат повышенные концентрации специфических антител и используются для лечебных целей. В настоящее время получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций.
11)методы предупреждения возможных осложнений после введения иммунных сывороток, иммуноглобулинов;
После введения иммунных сывороток или иммуноглобулинов возможны осложнения в виде анафилактического шока и сывороточной болезни. Потому перед введением таких препаратов необходимо ставить аллергическую пробу на чувствительность к ним пациента, а вводить - по Безредке, т.е. дробно небольшими количествами.
Для ↓ риска осложнений все гетерологичные сыворотки вводят дробно по Безредке:
1) внутрикожно в предплечье 0,1 мл сыворотки, разведенной 1:100;
2) через 30 мин подкожно 0,1 мл неразведенной сыворотки;
3) через 60-90 мин вводят всю необходимую дозу (обычно внутримышечно).
На каждом этапе следят за проявлениями аллергических реакций. Допустимо появление папулы до 1 см с небольшим покраснением.
Иногда прибегают к активно-пассивной иммунизации, т.е. к одновременному введению вакцины и сыворотки для формирования кратковременного пассивного иммунитета с заменой его через несколько недель активным, возникающим в ответ на введение вакцины. К такому методу иммунизации прибегают при профилактике столбняка у раненых, профилактике бешенства и в некоторых других случаях.
12)Пассивно-активная (экстренная или пост контактная) иммунизация при некоторых инфекционных заболеваниях;
А. Активная иммунизация — введение антигена для стимуляции иммунного ответа и развития иммунитета. Повторная иммунизация способствует более выраженному иммунному ответу и повышению устойчивости к возбудителю. При инфекциях с длительным инкубационным периодом, например при бешенстве, активная иммунизация позволяет предупредить заболевание даже после заражения. В зависимости от типа антигена активная иммунизация приводит к формированию временного или постоянного иммунитета.
Б. Пассивная иммунизация — введение антител к каким-либо антигенам. С помощью пассивной иммунизации можно создать только временный иммунитет продолжительностью 1—6 нед. Хотя пассивная иммунизация вызывает кратковременное повышение устойчивости к возбудителю, ее действие проявляется немедленно. Повторная пассивная иммунизация не усиливает иммунитет и часто сопровождается осложнениями. Ее обычно проводят после контакта с возбудителем и при невозможности активной иммунизации.
К пассивной иммунизации прибегают для создания временного иммунитета после контакта с возбудителем инфекции в тех случаях, когда активная иммунизация по тем или иным причинам не проводится заранее (например, против цитомегаловируса , против бешенства).
Пассивную иммунизацию применяют также для лечения заболеваний, вызванных бактериальными токсинами (в частности, дифтерии ), укусов ядовитых змей, укусов пауков и для специфической ( анти-Rh0(D)-иммуноглобулин) и неспецифической ( антилимфоцитарный иммуноглобулин) иммуносупрессии.
Для пассивной иммунизации пользуются тремя видами препаратов:
- нормальными человеческими иммуноглобулинами (устаревшее название - гаммаглобулин ) для в/м или в/в введения;
- специфическими человеческими иммуноглобулинами с высоким содержанием антител против определенных возбудителей (например, против вируса гепатита В или против вируса varicella-zoster - специфическими сыворотками, в том числе антитоксическими, полученными от иммунизированных животных. |
 Скачать 0.76 Mb.
Скачать 0.76 Mb.






