Масс-спектрометрия биомолекул. 3 Базовые принципы массспектрометрии
 Скачать 102.87 Kb. Скачать 102.87 Kb.
|
|
Цель данной главы – дать читателям, которые менее знакомы с масс-спектрометрией, краткий прошлый материал современного МС инструментария и познакомить с техниками, на которые будут ссылаться в следующих главах. Идея заключается в том, чтобы оснастить читателя базой знаний, которая будет использоваться позже, для совершения информированного выбора в использовании частичного инструмента или техники для специфической задачи. 3.1. Базовые принципы масс-спектрометрии. Почти век спустя после введения концепта масс-спектрометрии (МС) Дж. Дж. Томпсоном, эта техника стала незаменимым аналитическим инструментом во многих областях науки и техники. В этой части мы кратко рассмотрим большую часть важных концептов и определения, относящиеся к МС. Акцент делался на те функции МС измерений, который частично релевантные для МС анализа биологических макромолекул, которые изложены в следующих главах этой книги. Базовые принципы масс-спектрометрических измерений используют способность электрических и магнитных полей оказывать влияние на заряженные частицы: Mr=q×(E+[r×B]). (Здесь мы предполагаем, что взаимодействие имеет место в вакууме: то есть, диэлектрическая константа равна одному и магнитная восприимчивость – нолю). Поскольку величина каждого из этих взаимодействий определена как для заряда q так и для массы m частицы, её траектория r является универсально зависимой в масса-зарядном соотношении. Только заряженные частицы могут быть перемещены за счет электромагнитных полей; однако, все нейтральные молекулы должны быть ионизированы перед анализом. Таким образом, типичный масс-спектрометр обычно обеспечивает две различные функции (ионизация и анализ массы. Основываясь на этом рассмотрении, масс-спектрометр — это аналитический прибор, который испаряет и ионизирует молекулы, и измеряет ионное множество как функцию ионного, масса-зарядного соотношения. В большинстве типов масс-спектрометров, такие измерения на самом деле выполнены за счет первичного разделения ионов (либо пространственного, либо временного) основываясь на их масса-зарядном соотношении, с последующей детекцией каждого типа иона. (рис. 3.1) За исключением того, что образец уже находится в газовой фазе, он должен улетучиваться до или одновременно с ионизацией. Чувствительность анализа очевидно зависит от эффективности ионизации, то есть фракция нейтральных анализируемых молекул, которые, конвертированы в ионы и переведены в следующий сегмент прибора, где выполняется анализ массы. Ионизация довольно часто сопровождается диссоциацией анализируемых молекул, приводящих фрагментированные ионы, которые в большинстве случаев могут быть более многочисленны, нежели квази-молекулярные ионы (последние представляют собой неповрежденные анализируемые молекулы М с дополнительным зарядом, например, M.+, MH+). Также фрагментация усложняет масс-спектр, который часто обеспечивает полезной структурной информацией, и является предметом обсуждения в больших деталях в следующих отделах это главы. Ионы продуцируются в источнике ионизации и переводятся в массовый анализатор, где измеряется отношение массы-заряда. Физические принципы таких измерений широко варьируются среди многих различных типов анализаторов массы и будут рассмотрены позднее в этой главе. В оставшейся части этой секции мы рассмотрим некоторые общие характеристики и функции анализа массы и их уместность при масс-спектрометрии биополимеров. Суммарный заряд qна ионе это множество простых (электрон или протон) зарядов e (в системе СИ, e=1,6022×10-19C; в CGS, e=4,8032×10-10esu): Q=±ze Где zэто всегда целое положительное число. Следовательно, для соотношения масса-заряд — это всегда выражается как m/z, а не m/q. Масса иона в целом отличается от массы нейтральной молекулы. Различие должно быть весьма незначительным (например, для ионов, полученных при удалении или присоединении электрона, M*+или М*-). Однако, как мы увидим в следующем разделе данной главы, получение заряда у биополимеров почти всегда сопровождается существенным набором (или потерей) массы (например, [M+nH]n+, [M+nH+mNa](n+m)+, [M-nH+mNa](n-m)-), который не может быть проигнорирован. В этом последнем утверждении мы сделали неявное предположение, что рассматриваемому полимеру может быть утверждена масса, также как у любого другого физического объекта. Как выясняется, выяснение макромолекулярной массы это не настолько тривиальная задача, как может показаться. С тех пор, как измерение масс то один из главных объектов масс-спектрометрии как аналитической техники, необходимо исследовать концепт макромолекулярной массы с большими деталями. 3.1.1. Стабильные изотопы и изотопное распределение. Каждая молекула имеет уникальный химический состав; однако, всегда некоторая «физическая» гетерогенность ассоциирована с присутствием стабильных изотопов (ядра имеют одинаковое количество протонов, но разное число нейтронов). Существование стабильных изотопов было продемонстрировано экспериментально Фрэнсисом Эстоном, также их существование постулируется как минимумом четвертью века, предшествующей этому открытию (за которое была присуждена Нобелевская премия по химии в 1922). Фракции «тяжелых» изотопов элементов, которые вездесущи в биологических молекулах (C, N, H, O, Pи т.д.) но обычно не превышают 1% (см. Таблицу 3.1). Тем не менее, если молекула содержит большое число атомов каждого элемента, вклад тяжелых изотопов может стать очень значительным. Мы проиллюстрируем это используя углерод, элемент которого имеет 2 стабильных изотопа, 12С (98,9%) и 13С (1,1%), и фуллерен, C60 молекула. Вероятность того, что каждый атом углерода С60 представлен «легким» изотопом может быть посчитана как P0=(0,989)60=0,515, что означает почти половину всех фуллереновых молекул содержащих как минимум один 13С атом. Вероятность, что kи только kснаружи 60 карбоновых атомов являются 13С может быть легко посчитано: Pk=Ck60×(0,011)k×(0,989)60-k, гдеCk60 это биноминальный коэффициент (число возможных комбинаций элементов k из 60). График Pk, как функция массы, или, более точно, число атомов углерода 13C (рисунок 3.2) представлено как изотопное распределение фуллерена. Тривиальное расширение данной выше формулы дает изотопное распределение для гипотетической молекулы, построенной из nатомов А с двумя стабильными изотопами, xA(относительное множество p0) и X+1A (относительное множество p1=1-p0): Pk=Cnk×(p1)k×(p0)n-k. Легко показать, что это выражение может быть расширено включая больше 2 элементов; например, изотопное распределение для молекулы AnBmможет выражено как свертка двух биноминальных распределений: 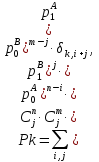 гдеp0A, p1A, p0B, и p1B представлены как относительные множества xA, x+1A, YBи Y+1B, соответственно, и 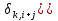 это типичный символ Кронекера, или проще это типичный символ Кронекера, или проще 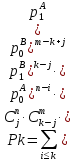 С другой стороны, более интуитивно, первое представление используется как продукт двух биноминалов 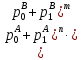 , чье раскрытие дает относительное множество Pkвидов изотопов, чьи массы превышают массы XAnYBmмассовых субъединиц k. Дальнейшее раскрытие главного варианта полиатомной молекулы AnBm…Zq относительно простое: , чье раскрытие дает относительное множество Pkвидов изотопов, чьи массы превышают массы XAnYBmмассовых субъединиц k. Дальнейшее раскрытие главного варианта полиатомной молекулы AnBm…Zq относительно простое: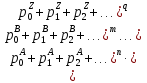 . .Несмотря на сою аналитическую элегантность, последнее упомянутое равенство требует вычислительных затрат и редко используется для расчета изотопных распределений больших полиатомных молекул с высокой точностью. Изотопные распределения многих элементов (металлы в частности) показывают скорее некоторые характеристичные паттерны, которые иногда обеспечивают уникальные «изотопные сигнатуры» вместе с маленькими молекулами. Изотопные распределения большего числа биополимеров не являются «говорящими» (настолько насколько элементный состав с этим связан). Вместо этого, большое число атомов представленных в «типичной» биомолекуле приводит к запутанному изотопному распределению которое увеличивается по мере увеличения размера макромолекулы. Наиболее коммерческие масс-спектрометры имеют встроенное программное обеспечение, которое рассчитывает изотопные распределения. Большой спектр таких программ также доступен в интернете. Для удобства пользователя, ввод данных часто доступен в двух форматах, главный (использующий молекулярную формулу AnBm…Zq) или пептид- и белок ориентированный (использующий аминокислотную последовательность АaanBbbm…Zzzqили просто аминокислотную последовательность). Большая часть основывающихся на сети программ в настоящее время рассчитывает изотопные распределения, учитывая «естественное» колличество стабильных изотопов для каждого элемента. Вычисления изотопных распределений для белковвыраженные в среднем, которые обогащены (или обеднены) определенными изотопами требуют более гибких алгоритмов. Строго говоря, в каждом из посчитанных изотопных распределений показанных на рисунке 3.4, только моноизотопный пик это действительно одиночный пик, вместе с остальными пиками в кластере, являющимися составными пиками, представленными двумя или более видами ионов. Например, моноизотопный пик убиквитина на рисунке 3.4 говорит об ионных видах (12С3781H63114N10516O11832S)+, в то время как следующий пик представляет пять различных видов, которые обычно упоминаются как изобарические виды или изобары. Эти пять изобаров, (12С3781H63114N10516O11832S)+ … (ещё пять разных наборов изотопов) имеют немного различающиеся массы за счет неравного расхождения 13С, 2H, 15N, 17O и 33Sот ближайших целых чисел (см. Таблицу 3.1). Также изобары малых пептидов могут быть разрешены в некоторых случаях, настоящий уровень технологии измерения масс не позволяет такое различение для молекул для белков и пептидов больше 1 кДа. Следовательно, в следующем обсуждении не сделали различия между изобарами, и «составная» природа «изотопных пиков» будет проигнорирована. (Важное исключение будет представлено в главе 5, где разрешение трех изобарических пиков убиквитина будет продемонстрировано). 3.1.2. Макромолекулярная масса: термины и определения. |
