Контрольная работа по биохимии. Биохимия_Вариант 6. 3 Пептидная связь
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
Сфинголипиды (сфингофосфолипиды)Сфингомиелины. Это наиболее распространенные сфинголипиды. В основном они находятся в мембранах животных и растительных клеток. Особенно богата ими нервная ткань. Сфингомиелины обнаружены также в ткани почек, печени и других органов. При гидролизе сфингомиелины образуют одну молекулу жирной кислоты, одну молекулу двухатомного ненасыщенного спирта сфингозина, одну молекулу азотистого основания (чаще это холин) и одну молекулу фосфорной кислоты. Общую формулу сфингомиелинов можно представить так: 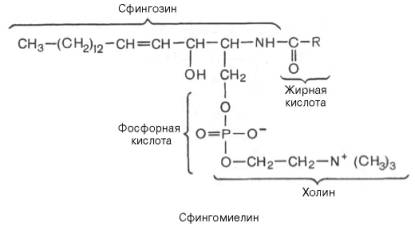 Общий план построения молекулы сфингомиелина в определенном отношении напоминает строение глицерофосфолипидов. Молекула сфин-гомиелина содержит как бы полярную «головку», которая несет одновременно и положительный (остаток холина), и отрицательный (остаток фосфорной кислоты) заряды, и два неполярных «хвоста» (длинная алифатическая цепь сфингозина и ацильный радикал жирной кислоты). В некоторых сфингомиелинах, например выделенных из мозга и селезенки, вместо сфингозина найден спирт дигидросфингозин (восстановленный сфингозин): 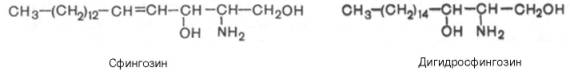 Сфингомиелины-кристаллич. бесцв. в-ва, т. пл. 170-220 °С (с разл.). Присутствуют в тканях животных (печени, почках, легких, селезенке, эритроцитах и в нервной ткани). Особенно много сфингомиелинов в сером и белом в-ве мозга, а также в оболочке аксонов периферич. нервной системы. Сфингомиелины устойчивы к слабощелочному и слабокислотному гидролизу, гидролизуются полностью при нагр. в 2-3 н. НС1, давая смесь жирной к-ты R'COOH, сфингозинового основания RCH(OH)CH(NH2)CH2OH, холина и фосфорной к-ты. Осн. представители сфингозиновых оснований - 4-сфингенин [R = СН3(СН2)12СН=СН] и сфинганин [R = СН3(СН2)14], жирных к-т-насыщенные и моноеновые к-ты (пальмитиновая, стеариновая, докозановая, лигноцериновая и др.). Лецитин является представителем фосфатидов (холинфосфоглицериды) – группа сложных липидов, содержащих фосфорную кислоту. 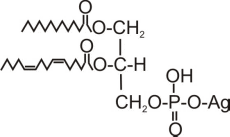 Рисунок 1 – Химическая формула лецитина Согласно СанПиН 2.3.2.1293-03 “Гигиенические требования по применению пищевых добавок”: лецитин обозначается индексом Е 322; название пищевой добавки - лецитины, фосфатиды (Lecithins); технологические функции - антиокислитель, эмульгатор [3]. По классификации пищевых добавок, согласно предложенной системе цифровой кодификации (основные группы) лецитин относят к группе: Е300 – Е399 – антиокислители (антиоксиданты). Лецитин классифицируется по следующим технологическим классам пищевых добавок: вещества, регулирующие консистенцию продуктов (эмульгаторы); вещества, способствующие увеличению сроков годности пищевых продуктов (антиокислители (антиоксиданты), ингибиторы окисления)[1]. 4 Свойства лецитина Лецитин способствует скорейшей дисперсии жиров и жидкостей. Лецитиновые порошки снижают плотность поверхностного натяжения жировых компонентов и оказывают эмульгирующее действие. Таким образом, жиры максимально быстро растворяются в воде или других жидкостях. Лецитин является хорошим инстантизатором и увлажнителем. Лецитин обеспечивает равномерное и быстрое смачивание порошковых субстанций водой. В зависимости от показателя жирности порошка, необходимо использовать разные лецитины. Для маложирных субстанций подойдут лецитины с низким уровнем гидрофильно-липофильного баланса, и скорость смачивания будет замедлена. Для жирных порошков потребуется лецитин с высоким показателем гидрофильно-липофильного баланса, и смачивание тогда будет проходить быстрее. Способность модифицировать вязкость. Благодаря свойству лецитинов снижать натяжение жировых поверхностей, ими можно покрывать шоколад, молочные и сахарные продукты. В таком случае, лецитин будет повышать их текучесть и облегчать перемешивание. Лецитин препятствует налипанию пищи на металлические стенки погружных баков, оберегает продукты от воздействия аэрозольных распылителей и способствует их правильному формованию[7]. Лецитин обладает гидрофобными и гидрофильными поверхностно – активными свойствами фосфолипидов, являющихся его основным компонентом. Как правило, эти фосфолипиды содержат: Фосфотидилхолина ( PC, 13-18%) Фосфотидиэтаноламина (РЕ, 10-15 %) Фосфотидилиностола (PI, 10-15%) Фосфатидной кислоты (РА, 5-12%) Помимо фосфолипидов, соевые лецитины содержат триглицериды, стеролы, в небольших количествах жирные кислоты, углеводороды и сфинголипиды. «Фракционирование» (разложение) этих комплексных смесей или добавление к ним таких элементов как рафинированное масло или других ПАВ дает возможность создания новых продуктов, предназначенных для тех или иных специфических целей. Обезжиривание лецитина улучшает типовой состав фосфолипидов, как это следует из графика ниже[8]. 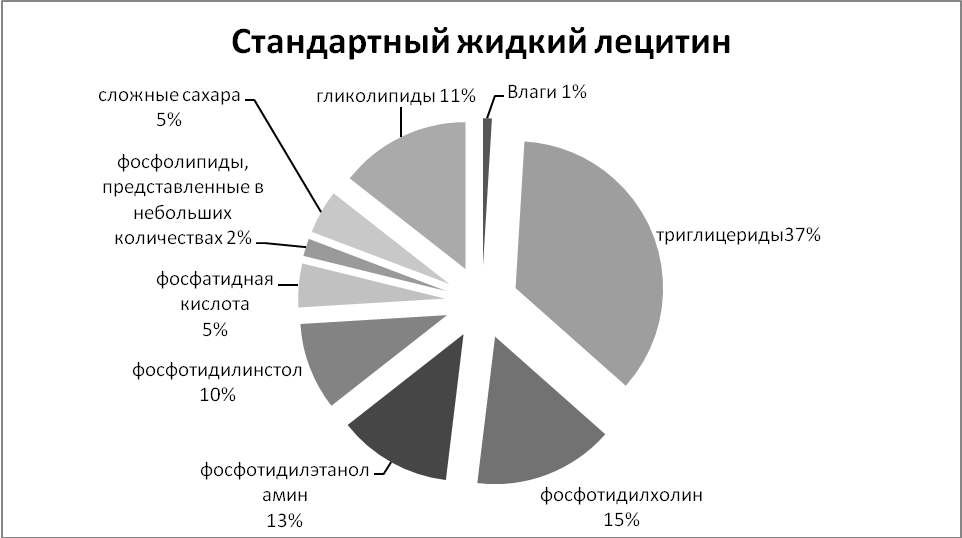 Рисунок 2 – Стандартный жидкий лецитин 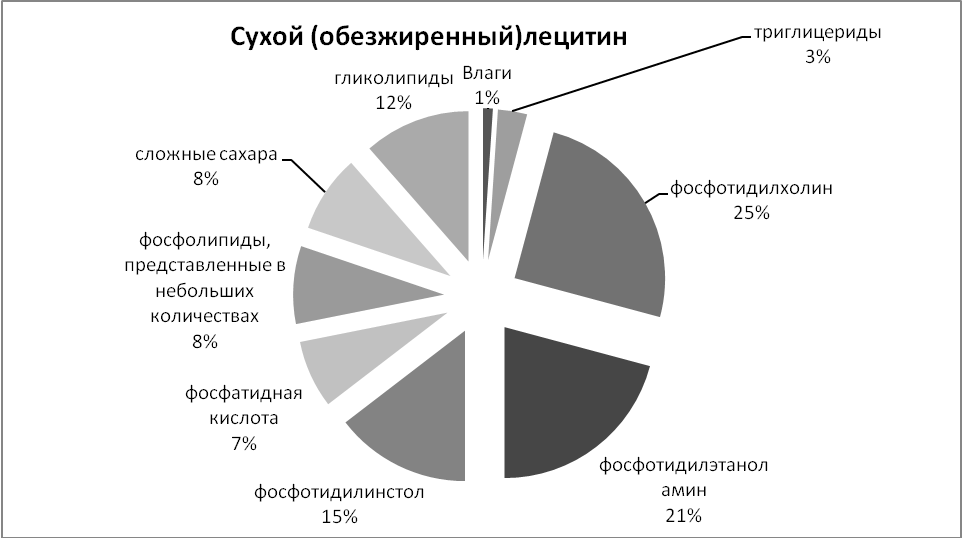 Рисунок 3 – Сухой (обезжиренный) лецитин 5 Применение лецитина Лецитин находит применение в различных областях пищевой и непищевой промышленности. В пищевой промышленности эмульгирующие свойства лецитина используются в производстве маргаринов, растворимых растительных и молочных продуктов, готовых к употреблению глазурей. Смазывающие и высвобождающие свойства лецитина используются в таких продуктах, как жиры для жарки и аэрозольные покрытия. Лецитин также используется для изменения вязкости шоколадных продуктов и глазурей различных типов. В производстве хлебобулочных изделий применение лецитина приводит к улучшению обрабатываемости теста, лучшему объему, увеличению сроков годности. В производстве крекеров, печений, кексов и пирогов применение лецитина улучшает свойства шортенинга и действует как агент высвобождения из форм. Лецитин также может применяться в пищевой промышленности как антиоксидант (вещество, которое препятствует окислению). В роли антиоксиданта лецитин применяется как вещество, препятствующее старению шоколада[9]. Витамины, входящие в состав ферментов. Привести примеры. Витамины (от лат. vita - жизнь), группа органических соединений разнообразной химической природы, необходимых для питания человека, животных и других организмов в ничтожных количествах по сравнению с основными питательными веществами (белками, жирами, углеводами и солями), но имеющих огромное значение для нормального обмена веществ и жизнедеятельности. Первоисточником Витамины служат главным образом растения (см. Витаминоносные растения). Человек и животные получают Витамины непосредственно с растительной пищей или косвенно - через продукты животного происхождения. Важная роль в образовании Витамины принадлежит также микроорганизмам. Например, микрофлора, обитающая в пищеварительном тракте жвачных животных, обеспечивает их витаминами группы Витамины Витамины поступают в организм животных и человека с пищей, через стенку желудочно-кишечного тракта, и образуют многочисленные производные (например, эфирные, амидные, нуклеотидные и др.), которые, как правило, соединяются со специфическими белками и образуют многие ферменты, принимающие участие в обмене веществ. Биологическая роль витамина В1, определяется тем, что в виде ТДФ он входит в состав как минимум трёх ферментов и ферментных комплексов: в составе пируват- и ос-кетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбоксилировании пирувата и ос-кетоглутарата; в составе транскетолазы ТДФ участвует в пентозофосфатном пути превращения углеводов. В слизистой оболочке кишечника после всасывания витамина В2 происходит образование коферментов FMN и FAD по схеме: Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восстановительных реакциях (см. разделы 2, 6, 9, 10). Никотиновая кислота (витамин РР) в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ (см. раздел 2). Синтез NAD в организме протекает в 2 этапа: Пантотеновая кислота (витамин В5) используется в клетках для синтеза кофермен-тов: 4-фосфопантотеина и КоА (рис. 3-1). 4-фосфопантотеин - коферменг пальмитоилсинтазы. КоА участвует в переносе ацильных радикалов в реакциях общего пути катаболизма (см. раздел 6), активации жирных кислот, синтеза холестерина и кетоновьж тел (см. раздел 8), синтеза ацетилглюкозаминов (см. раздел 15), обезвреживания чужеродных веществ в печени (см. раздел 12). Все формы витамина В6 используются в организме для синтеза кофер-ментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фос-форилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата. 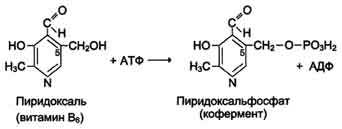 Пиридоксалевые ферменты играют ключевую роль в обмене аминокислот: катализируют реакции трансаминирования и декарбоксилирования аминокислот, участвуют в специфических реакциях метаболизма отдельных аминокислот: серина, треонина, триптофана, серосодержащих аминокислот, а также в синтезе тема (см. разделы 9, 12). Биотин (витамин Н) выполняет коферментную функцию в составе карбоксилаз: он участвует в образовании активной формы СО2. Суточная потребность в витамине В12 крайне мала и составляет всего 1-2 мкг. Витамин В12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях (рис. 3-2). Метил-В12 - кофермент, участвующий в образовании метионина из гомоцистеина. Кроме того, метил-В12 принимает участие в превращениях производных фолиевой кислоты, необходимых для синтеза нуклеоти-дов - предшественников ДНК и РНК. Дезоксиаденозилкобаламин в качестве кофермента участвует в метаболизме жирных кислот с нечётным числом углеродных атомов и аминокислот с разветвлённой углеводородной цепью (см. разделы 8, 9). Витамин К участвует в реакциях карбоксилирования в качестве кофермента. Задачи Определите ИЭТ пептида (>, < или =7,0) Про-Лиз-Тир-Глн-Три. Напишите формулу данного пентапептида и все возможные пептиды, состоящие из тех же аминокислот. При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии. Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд (табл. 1-3). Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд. Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд. 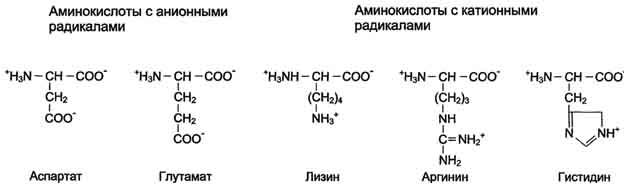 Схема. Структура полярных заряженных аминокислот в диссоциированной форме Таблица 1-3. Изменение суммарного заряда аминокислот в зависимости от рН среды 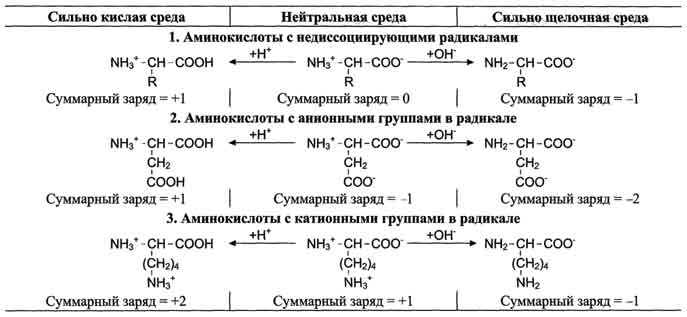 Рассчитайте объем 0,2 М раствора гидроксида калия, необходимого для титрования 200 мл 0,15 М раствора аспарагиновой кислоты, находящейся в изоэлектрической точке. Составьте превращения в соответствии со схемой: Глутаминовая кислота → α-кетоглутаровая кислота →янтарная кислота → фумаровая кислота →яблочная кислота. Укажите ферменты, ускоряющие отдельные этапы реакции. Определите изоэлектрическую точку следующих аминокислот: глицина, α-аланина, β-аланина, изолейцина, саркозина и двух дипептидов: глицилглицина и глицилаланина при 25°С, зная, что значения рКапри указанной температуре соответственно равны:
Решение: Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Амфотерные молекулы (цвиттер-ионы) содержат как положительные, так и отрицательные заряды, наличием которых определяется pH раствора. Заряд различных функциональных групп таких молекул может меняться в результате связывания или, наоборот, потери протонов H+. Величина изоэлектрической точки такой амфотерной молекулы определяется величинами констант диссоциации кислотной и осно́вной фракций: Для перечисленных амфотерных молекул, используя формулу, получим:
Белок содержит 0,8% цистеина. Вычислите минимальную молекулярную массу этого белка. Решение: Ответ: Молекулярная масса фрагмента ДНК равна 500 000. Рассчитайте объем фрагмента молекулы ДНК (нм3) при условии, что она имеет форму цилиндра. Решение: Относительную молекулярную массу одного нуклеотида принимаем за 345. Определим число нуклеотидов, входящих в состав одной молекулы ДНК. Длина одного нуклеотида в цепи молекулы ДНК равна 0, 34 нм. Следовательно, длина фрагмента двухцепочечной ДНК равна: Примерная ширина двойной спирали ДНК 2 нм. Принимая форму молекулы ДНК за цилиндрическую, получим r = 1 нм. Тогда объем фрагмента молекулы ДНК равен: Ответ: Список литературы Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник/Под ред. акад. АМН СССР С. С. Дебова. — 2-е изд., перераб. и доп. — М.: Медицина, 1990. —528 с. Биохимия : учебник для вузов / Под ред. Е.С. Северина. —М.: Гэотар-Мед, 2003. — 779 с. Ленинджер А. Основы биохимии / Перевод с англ. В.В. Борисова, М.Д. Дроздовой, С.Н. Преображенского. – М.: Мир, 1985. – Т.1. 367 с.; Т. 2. 368. с.; Т. 3. 320 с. |
