охт. охт ответы 34-44. 34. Сырьевая база азотной промышленности
 Скачать 465.4 Kb. Скачать 465.4 Kb.
|
|
34. Сырьевая база азотной промышленности. Сырьем для получения продуктов в азотной промышленности являются атмосферный воздух и различные виды топлива. В технических расчетах принимают, что воздух содержит 79% азота и 21% кислорода. Азот воздуха используется в процессах получения аммиака и других продуктов азотной технологии. В некоторых схемах не требуется выделять азот из воздуха в чистом виде; в других схемах используют чистый жидкий или газообразный азот. Поскольку ресурсы атмосферного азота ограничены, то сырьевая база азотной промышленности в основном определяется вторым видом сырья –топливом, применяемым для получения водорода или водородосодержащих газов. Начиная с 60-х годов доля твердого топлива (каменного угля, кокса) как сырья для получения водорода резко сокращалось. В настоящее время основным сырьем является природный газ (93%). Вместе с тем дальнейшее развитие экономики, рост ее энерговооруженности требуют все большего увеличения добычи горючих ископаемых, в первую очередь нефти и газа. По мере истощения мировых запасов газа и нефти, а также изменения цен на эти виды сырья все большее значение будут приобретать каменный уголь, запасы которого значительно превышают запасы нефти. Из природных горючих ископаемых получают технологические газы (синтез газы), содержащие водород, а также СО и другие примеси. Затем они подвергаются различным видам очистки. Аммиак—ключевой продукт различных азотосодержащих веществ, применяемых в промышленности и сельском хозяйстве. Аммиак NH3 – основание, умеренно сильный восстановительный агент и эффективный комплексообразователь по отношению к катионам, обладающим вакантными связями. Синтез аммиака из элементов осуществляется по уравнению реакции: N2 + 3H2 = 2NH3 Реакция обратимая, экзотермическая, при высоких температурах становится еще более экзотермической. 35. Получение технологических газов из твердых топлив и природного газа. Технические газы (синтез-газы)— химические вещества и их соединения в газообразном или жидком (при сжижении) состоянии, получаемые искусственным путём при разделении атмосферного воздуха, выделением из углеводородного сырья или химическими способами, хранящиеся под давлением в специальных сосудах и используемые в производственных и бытовых целях. Технические газы используют в производстве товаров (металлургия, химическая промышленность), при выполнении строительно-монтажных работ, добыче углеводородов, в пищевой промышленности, сельском хозяйстве и т.д.. Синтез-газ из твердого топлива. Первым из основных источников сырья для получения синтез-газа явилось твердое топливо, которое перерабатывалось в газогенераторах. В состав синтез-газа входят такие вещества как CO и H2. В зависимости от метода получения синтез-газа соотношение CO:Н2 в нем варьируется. Также, помимо данных веществ синтез-газ может содержать и другие вещества – инертные газы (N2) и серосодержащие соединения (H2S), если исходное сырье содержало серу. От не нужного присутствия в синтез-газе таких веществ как углекислый газ и сера избавляются путем очистки селективными растворителями. Сегодня существуют три основных метода получения синтез-газа. 1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и происходит по формуле: C + H2O → H2 + CO. Данная реакция является эндотермической, и равновесие при температуре 900-1000 сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермическая реакция сгорания угля, которая обеспечивает необходимый тепловой баланс. Ее формула: 2C + O2 → 2CO. Газификация угля происходит в газогенераторах, которые представляют собой шахту цилиндрической формы. Сверху этой шахты загружается топливо, а снизу подаётся дутье. Слой топлива поддерживается колосниковой решёткой. Подаваемое в газогенератор дутьё вначале проходит через зону золы и шлака 0, где оно немного подозревается, а далее поступает в раскаленный слой топлива (окислительная зона, или зона горения 1), где кислород дутья вступает в реакцию с горючими элементами топлива. Образовавшиеся продукты горения, поднимаясь вверх по газогенератору и встречаясь с раскалённым топливом (зона газификации II), восстанавливаются до окиси углерода и водорода. При дальнейшем движении вверх сильно нагретых продуктов восстановления происходит термическое разложение топлива (зона разложения топлива III) и продукты восстановления обогащаются продуктами разложения (газами, смоляными и водяным и парами). В верхней части газогенератора происходит сушка топлива теплом поднимающихся газов и паров (зона IV). В зависимости от того, в каком виде подаётся в газогенератор кислород дутья, состав генераторных газов изменяется. 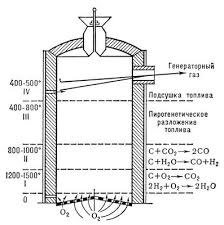 Синтез-газ из природного газа. Синтез-газ из углеводородных газов (природного, попутного, газов переработки др. топлив) в наст. Время является основным источником получения аммиака и метанола. Процесс получения водородосодержащих газов: высокотемпературная кислородная конверсия, каталитическая парокислородная конверсия в шахтных реакторах, каталитическая пароуглекислотная конверсия в трубчатых печах. 2.Конверсия метана. Данная реакция взаимодействия водяного пара и метана проводится при повышенной температуре (800-900 градусов) и давлении при присутствии никелевых катализаторов (Ni-Al2O3). Формула данного процесса: CH4 + H2O → CO + 3H2 . Также в качестве сырья в данном способе вместо метана можно использовать любое сырье, содержащее углеводород. 3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300 градусов заключается в термическом окислении углеводородов. Формула данной реакции: CnH2n + 2 + 1/2nO2 → nCO + (n + 1)H2 . Данный способ применим к любому сырью, содержащему углеводороды, но наиболее часто используется высококипящая фракция нефти - мазут. 36. Конверсия метана водяным паром. Углекислотная конверсия метана в синтез-газ СО + Н2 - одна из важнейших химических реакций, пригодная для промышленного получения водорода и дающая начало синтезу углеводородов (жидкое топливо) и других технически ценных продуктов. Существует три метода окислительной конверсии метана в синтез-газ: - паровая конверсия CH 4 + H2O CO + 3H 2 (∆Н = +206 кДж/моль) -парциальное окисление кислородом CH4 + 1/2 O2 CO + 2 H2 (∆Н = -35,6 кДж/моль) -углекислотная конверсия CH4 + CO2 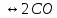 + 2H2 (∆Н = +247 кДж/моль) + 2H2 (∆Н = +247 кДж/моль)В промышленности используется практически лишь метод паровой конверсии (1). Реакцию проводят на нанесенном Ni-катализаторе при высокой температуре (700-900 °С).  37. Конверсия окиси углерода. Конверсия окиси углерода CO Для увеличения содержания водорода в составе синтетического газа применяется процесс конверсии окиси углерода CO, полученной в предыдущих процессах производства синтетического газа из углеводородного сырья. На выходе из установок парового риформинга, реакторов частичного окисления или генераторов коксового газа и др. синтетический газ содержит H2, CO, CO2, CH4 и воду в состоянии химического равновесия при высоких температурах от 700 до 1400 °C в зависимости от рабочего давления и состава смеси исходного сырья и технологического пара или воды. Путем конверсии окиси углерода CO значительная часть CO, содержащегося в крекинг-газе, используется для дополнительной выработки водорода в соответствии с химической реакцией CO + H2O <=> H2 + CO2 Этот процесс экзотермический, и в итоге он протекает в химическом равновесии. Применяются три различных варианта конверсии окиси углерода CO: Высокотемпературная (HT) конверсия CO при температуре от 300 до 450 °C со снижением концентрации CO до 2,5 % в сухом весе на выходе из реактора Среднетемпературная (MT) или так называемая изотермическая конверсия CO при температуре от 220 до 270 °C со снижением концентрации CO до 0,5 % в сухом весе на выходе из реактора. Низкотемпературная (LT) конверсия CO при температуре от 180 до 250 °C со снижением концентрации CO до 0,2 % в сухом весе на выходе из реактора Для каждого процесса применяется специальный катализатор в реакторе с неподвижным слоем для получения максимального выхода готового продукта H2. Технология высокотемпературной конверсии применяется как стандартная почти на каждой водородной установке. Низкотемпературная конверсия окиси углерода CO обычно применяется после высокотемпературной для переработки газа со сниженным содержанием окиси углерода CO. 38. Неизотермический процесс в химическом реакторе. В неизотермическом режиме температура в реакторе изменяется вследствие выделения (поглощения) тепла реакции и теплообмена с посторонним теплоносителем. При расчете процесса в химическом реакторе в неизотермическом режиме используются балансовые уравнения массы и тепла. Проточный реактор идеального смешения Неизотермический процесс в проточном реакторе идеального смешения описывается балансовыми уравнениями массы и тепла, которые преобразуются в математические модели 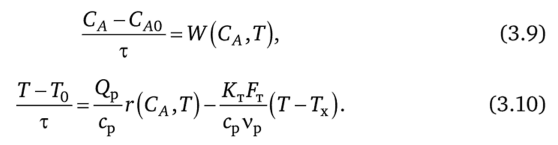 Первое слагаемое в правой части уравнения (3.12) описывает влияние на температуру процесса тепловыделения реакции, второе — теплообмен с посторонним теплоносителем с температурой Тх через поверхность FT. Уравнения (3.11) и (3.12) имеет нелинейную зависимость от концентрации СА и температуры Г, и данную систему уравнений необходимо решать с помощью численных методов. При адиабатическом протекании процесса в реакторе обмен тепла с посторонним теплоносителем отсутствует и существует связь между температурой и степенью превращения  QPCA0 где —-= ATaд — адиабатический разогрев реакционной смеси в реакторе. Реактор идеального вытеснения Рассмотрим химический процесс в реакторе, работающем в режиме идеального вытеснения с учетом теплообмена. Уравнения, описывающие данный процесс, — обыкновенные дифференциальные уравнения первого порядка, получаемые из уравнений материального и теплового баланса.  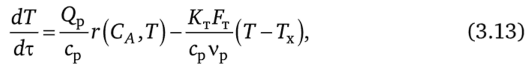 при т = 0;CA = CA0; T = T0. Уравнения (3.12) и (3.13) являются нелинейными дифференциальными уравнениями и аналитически в общем виде не решаются. При адиабатическом протекании процесса в реакторе обмен тепла с посторонним теплоносителем отсутствует, второе слагаемое в уравнении 3.13 отсутствует и, выражая уравнение 3.12 через степень превращения вещества А, выразим связь между температурой и степенью превращения: 39-40. Модель гетерогенного процесса <<Сжимающаяся сфера и ядро>>. Влияние условий на скорость превращений. 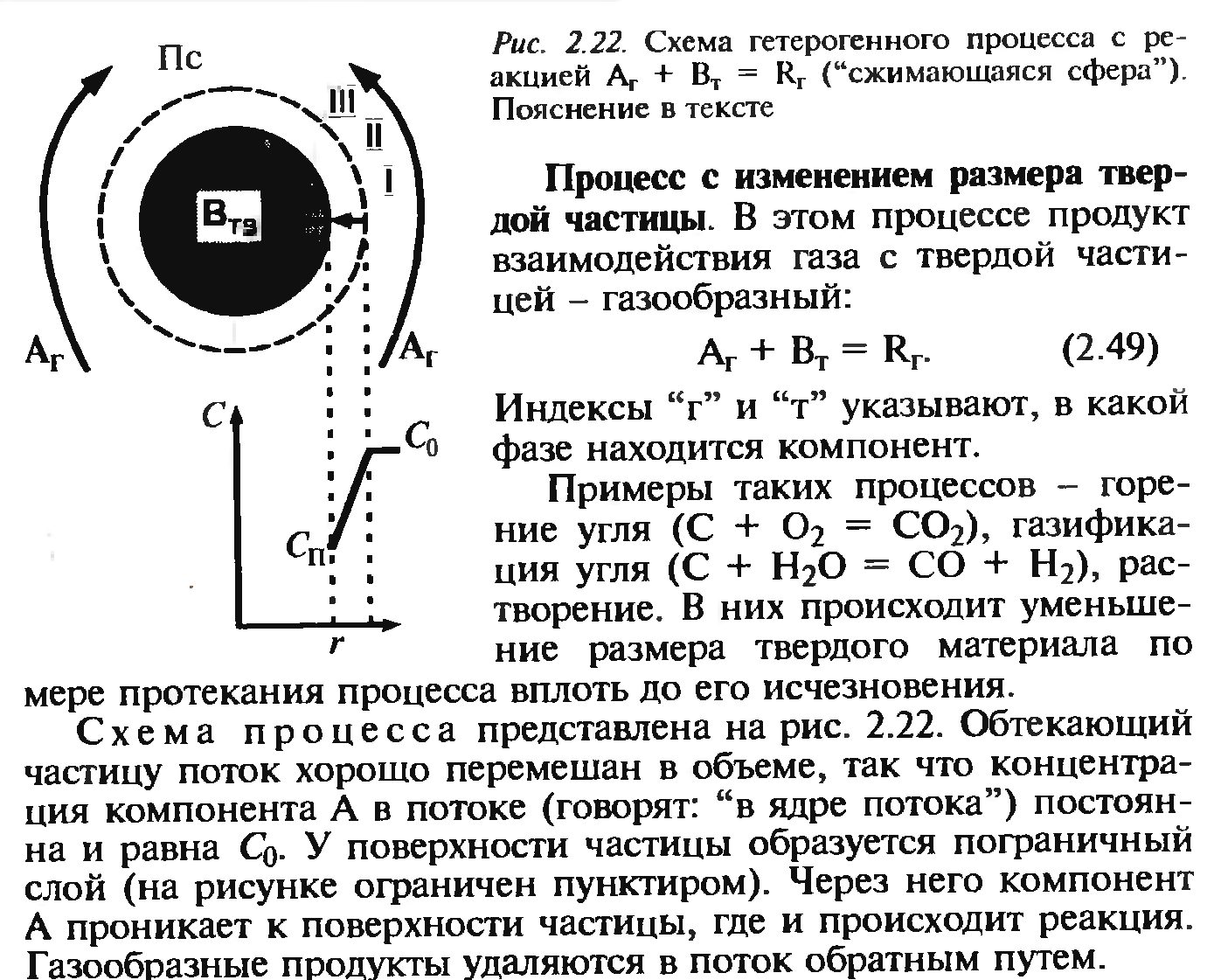   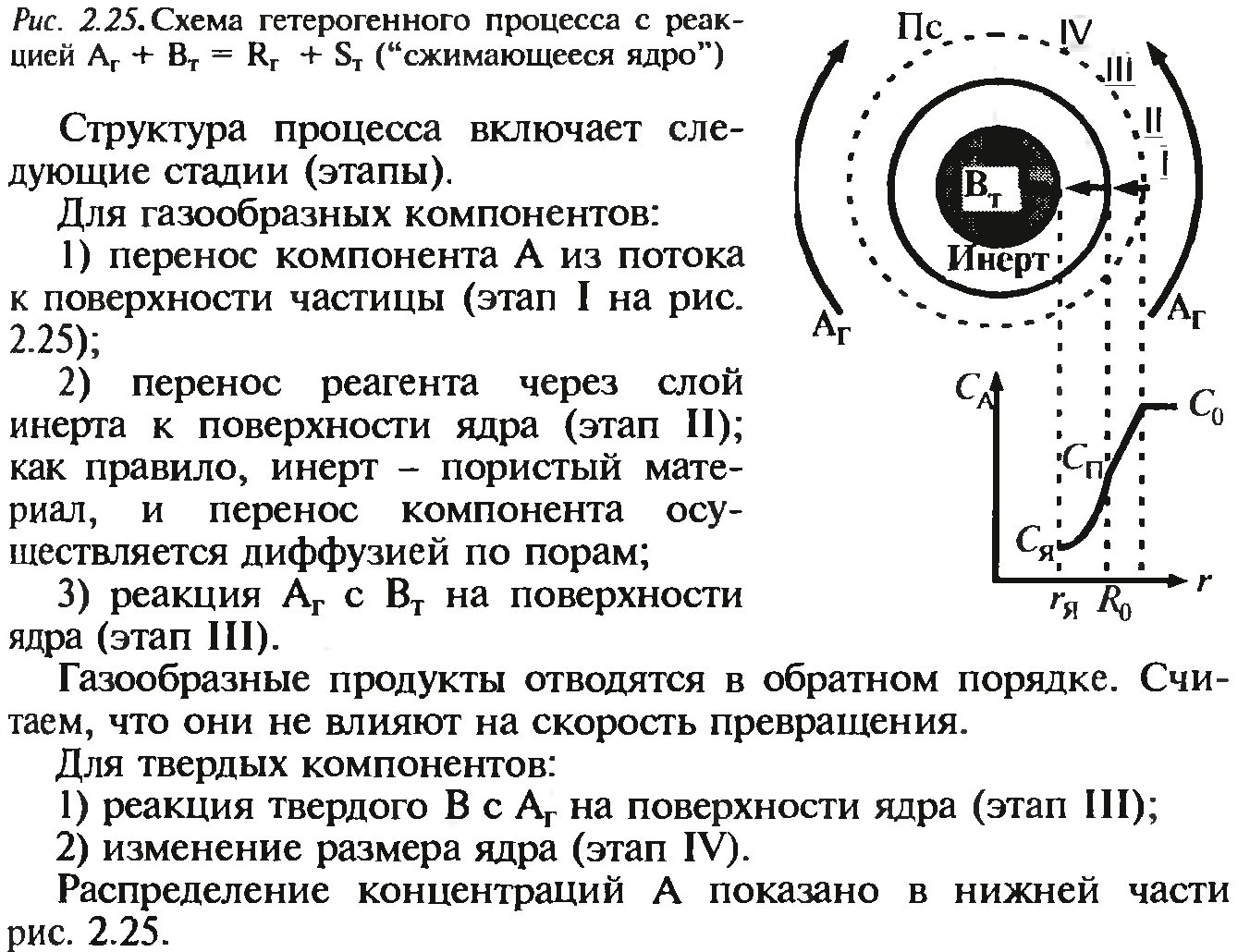  41. Расчет константы равновесия. Химическим равновесием называется такое состояние обратимой химической реакции aA + bB = cC + dD, при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия: где Ci – концентрации компонентов в равновесной идеальной смеси. Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов: Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов: Для идеальных газов Pi = CiRT и Pi = XiP, где P – общее давление, поэтому KP, KC и KX связаны следующим соотношением: KP = KC (RT) c+d–a–b = KXP c+d–a–b. (9.4) Константа равновесия связана с Изменение 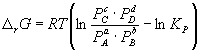 . (9.7) . (9.7)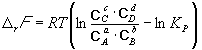 . (9.8) . (9.8)Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты. 42. Физико-химические основы процесса конверсии аммиака Окисление аммиака кислородом воздуха без катализатора возможно только до N2. На кат. между аммиаком и кислородом протекают следующие параллельные реакции: 4NH3 + 5O2 = 4NO + 6H2O; H=— 946 кДж 4NH3 + 3O2 = 2N2 + 6H2O; H= — 1328кДж ( Реакции сопровождаются значительной убылью свободной энергии, протекают с большой скоростью, практически необратимо (до конца). Q, выделяющейся в результате, достаточно чтобы процесс протекал автотермично. Катализаторы Наиболее селективным и активным катализатором - Pt, сплав с Pd и Rh. Окисление аммиака — многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. В процессе окисления NH3 нестойких промежуточных соединений, которые в результате распада и перегруппировки дают оксид азота (II) и элементный азот. Влияние температуры. При повышении температуры выход NO возрастает. На платине реакция окисления аммиака начинается при 195 °С. Заметное количество оксида азота (II) начинает появляться при 300 °С. При высокой температуре: растет скорость реакции окисления аммиака и уменьшается время контактирования. Влияние давления. С ростом давления наблюдается снижение выхода оксида азота (II). Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размеры аппаратов 43. Окисление оксида азота (II) Реакция окисления 2NO + O2 = 2NO2; DH = – 124 кДж(4.2) обратима, протекает с уменьшением объема и сопровождается выделением тепла. Следовательно, снижение температуры и повышение давления способствует образованию NO2. При температурах до 100 ºС равновесие реакции практически полностью сдвинуто в правую сторону. Окисление диоксида азота – самая медленная стадия получения азотной кислоты. Она сильно зависит от концентрации реагентов, давления температуры. Применение воздуха, обогащенного кислородом (или чистого кислорода) позволяет получать НГ[2] с повышенным содержанием оксида азота (II) и увеличить скорость окисления NO в NO2. Реакция окисления NO в NO2 ускоряется при понижении температуры, а с повышением замедляется почти до полного прекращения. Это объясняется тем, окисление NO в NO2 идет через образование промежуточного продукта – димера оксида азота (II): 2NO =(NO) 2; DH < 0(4.5) O2 + (NO) 2 = 2NO2; DH < 0(4.6) Таким образом, уменьшение скорости окисления оксида азота в диоксид с повышением температуры можно объяснить сильным снижением концентрации димера. Обычно переработку нитрозных газов ведут при температурах 10 – 50 ºС, при которых часть диоксида полимеризуются в N2O4. Итак, нитрозные газы, поступающие на абсорбцию, содержат NO2, N2O4, NO, N2O, N2, N2O3. 44. Абсорбция нитрозных газов. Абсорбционная аппаратура в производстве азотной кислоты. Все оксиды азота, за исключением NO взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота с водой протекает через две макростадии – физическое растворение этих газов в воде и последующее их химических взаимодействий с водой с образованием азотной и азотистой кислот. Азотистая кислота -малоустойчивое соединением и распадается на азотную кислоту, оксид азота (II) и воду. Суммарно взаимод.NO2 с водой можно представить уравнением Образующийся NO снова окисляется до NO2 Образующийся NO частично окисляется в растворе О2, но его большая часть взаимодействует с кислородом уже в газовой фазе. Одновременно с абсорбцией и протеканием хим. реакций в р-ре в газовой фазе так же частично протекают те же реакции, приводящие к образованию азотной кислоты. При взаимодействии паров воды и NO2 в газовой фазе происходит образование кислотного тумана. При ↓t и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение практически прекращается. Следует также отметить, что степень окисления NO зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности контакта фаз. Достаточно большой объем газовой фазы между тарелками позволяет достичь высоких степеней газофазного окисления NO в NO2, можно считать, что в абсорбционной колонне протекает превращение:  Для отвода избыточного тепла на тарелках установлены плоские змеевидные холодильники с циркулирующей в них водой. |
